阿帕替尼联合GP方案治疗晚期非小细胞肺癌的疗效及安全性
李发祥
非小细胞肺癌(NSCLC)早期往往缺乏特异性,隐匿进展,难以诊断,发现时大多已是中晚期[1]。晚期NSCLC患者无法进行手术治疗,主要治疗方法为放、化疗,控制病情进展,但效果并不乐观。阿帕替尼是一种血管内皮细胞生长因子受体-2(VEGFR-2)抑制剂,其可通过竞争性与VRGFR-2的ATP结合,抑制VEGFR的磷酸化状态,使其无法被激活,进而阻断下游通路,抑制肿瘤血管生成,达到抗肿瘤目的[2]。GP方案是治疗晚期NSCLC的标准一线化疗方案,在临床广泛应用,但其客观缓解率不高,30%左右[3]。因此,针对NSCLC的联合化疗非常有必要。为了探讨阿帕替尼联合GP方案治疗晚期非小细胞肺癌的临床疗效及对肿瘤标志物的影响,本文选取70例晚期非小细胞肺癌患者进行研究,现报告如下。
1 资料与方法
1.1 一般资料
选取2014年3月至2016年3月我院收治的70例晚期非小细胞肺癌患者。纳入标准:均经过病理学检查确诊;临床分期为ⅢB期~Ⅳ期;卡氏评分(Kamofsky)>60分;预计生存期>3个月;白细胞计数(WBC)≥4.0×109/L;血小板计数(PLT)≥80.0×109/L;所有患者均知情同意;本研究经过医院伦理委员会批准。排除标准:合并严重肝肾等脏器功能障碍;对研究药物过敏;精神疾病;未遵医嘱服药;无法耐受化疗。根据随机区组设计法,将所有患者分为观察组和对照组,各35例。观察组有男性19例,女性16例;年龄57~78岁,平均(65.2±5.3)岁;病理类型:腺癌13例,鳞癌10例,腺鳞癌9例,大细胞癌3例;临床分期:ⅢB期12例,Ⅳ期23例。对照组有男性20例,女性15例;年龄56~79岁,平均(65.9±6.4)岁;病理类型:腺癌12例,鳞癌11例,腺鳞癌10例,大细胞癌2例;临床分期:ⅢB期13例,Ⅳ期22例。2组患者在病症、年龄、性别等基线资料上比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
对照组给予GP方案化疗,吉西他滨(江苏豪森药业,国药准字 H2030104) 1 000 mg/m2,与250 ml生理盐水混合进行静脉滴注,第1、8天,静滴30~60 min;顺铂(江苏豪森药业,国药准字 H2030104)25~30 mg/m2,与500 ml生理盐水混合进行静脉滴注,第1~3天,静滴30~60 min。观察组在对照组基础上加用甲磺酸阿帕替尼(江苏豪森药业,国药准字 H2030104)治疗,850 mg/次,1次/天,连续服用。2组均以21 d为1个疗程,连续治疗2个疗程后进行疗效评价。
1.3 观察指标
(1)近期疗效:治疗结束后,根据标准进行疗效评价。(2)肿瘤标志物水平:癌胚抗原(CEA)采用磁微粒化学发光法检测,试剂盒来自北京利德曼生化股份有限公司。血管内皮生长因子(VEGF)和细胞角质蛋白19片段(CYFRA21-1)采用化学发光免疫法检测,试剂盒来自武汉伊莱瑞特生物科技股份有限公司。检测设备为日本HITACHI7170S全自动生化分析仪。(3)生存情况:随访时间13~24个月,注意记录2组患者2年生存期及1年生存率;(4)毒副作用发生情况:在治疗过程中,密切关注患者化疗毒副作用发生情况,包括白细胞减少、血小板减少、胃肠道反应、心脏毒性、肝肾功能损害等。
1.4 疗效评价
根据RECIST实体瘤评价疗效[4]:完全缓解(CR);病灶完全消失至少1个月,无新发病灶;部分缓解(PR):肿瘤缩小50%以上,时间维持1个月以上;稳定(SD):肿瘤缩小50%以下或增大25%以下;进展(PD):病灶增大25%以上,或出现新病灶。客观缓解率(ORR)=(CR+PR)%,疾病控制率(DCR)=(CR+PR+SD)%。
1.5 统计学分析
应用SPSS 19.0软件对研究结果进行统计学分析和处理,用t检验方法对计量资料进行检验;用χ2检验方法对计数资料进行检验。检验水准:P<0.05表示差异有统计学意义。
2 结果
2.1 2组患者近期疗效的比较
观察组的总缓解率和疾病控制率(57.1%,85.7%)显著高于对照组(28.6%,54.3%),差异有统计学意义(P<0.05)。结果见表1。
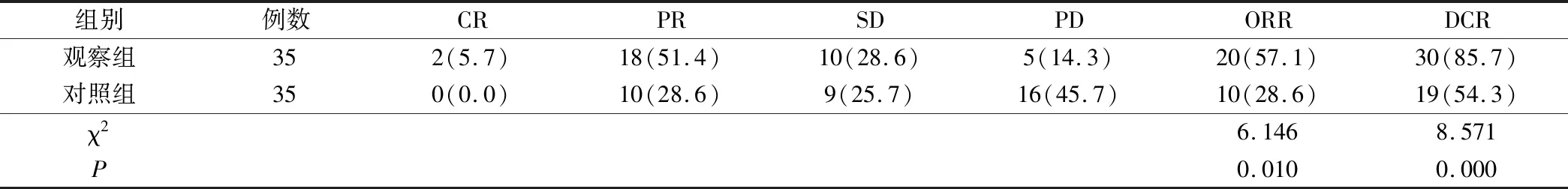
表1 2组患者近期疗效的比较(例,%)
2.2 2组患者肿瘤标志物水平的比较
治疗前2组患者血清CEA、VEGF、CYFRA21-1水平差异无统计学意义(P>0.05),2组患者治疗后血清CEA、VEGF、CYFRA21-1水平均低于治疗前(P<0.05),且观察组血清CEA、VEGF、CYFRA21-1水平显著低于对照组(P<0.05)。结果见表2。

表2 2组患者肿瘤标志物水平的比较
注:#为2组治疗前比较,P>0.05;△为本组治疗前后比较,P<0.05;*为2组治疗后比较,P<0.05。
2.3 2组患者生活质量评分的比较
治疗前2组患者SF-36评分、KPS评分差异无统计学意义(P>0.05),2组患者治疗后SF-36评分、KPS评分均高于治疗前(P<0.05),且观察组SF-36评分、KPS评分显著高于对照组(P<0.05)。见表3。
2.4 2组患者生存情况的比较
观察组中位生存期为(11.24±2.75)月,显著高于对照组的(9.32±2.59)月,差异有统计学意义(t=2.943,P=0.011)。观察组1年生存率为37.1%(13/35),略高于对照组的 34.3%(12/35),但无统计学差异(χ2=2.739,P=0.103)。
2.5 2组患者不良反应的比较
观察组的白细胞减少、血小板减少、胃肠道反应及肝肾功能损害均显著低于对照组(P<0.05),而心脏毒性无统计学差异(P>0.05)。结果见表4。

表3 2组患者生活质量评分的比较分)
注:#为2组治疗前比较,P>0.05;△为本组治疗前后比较,P<0.05;*为2组治疗后比较,P<0.05。
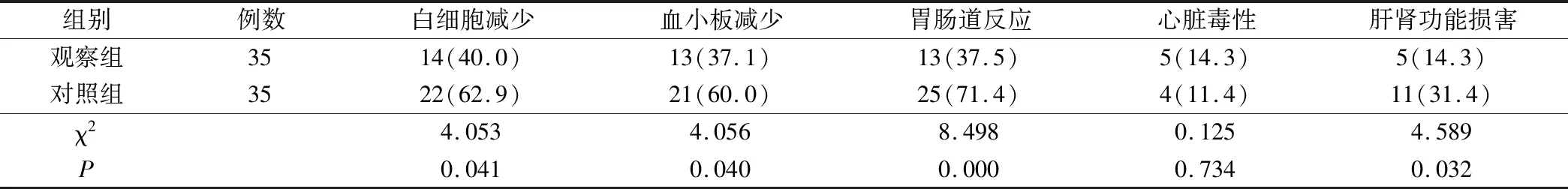
表4 2组患者不良反应的比较(例,%)
3 讨论
近年来,肺癌的靶向治疗受到临床工作者的广泛关注。有研究表明[5],VEGF/VEGFR2信号转导通路对血管内皮生成有重要作用。VEGF与VEGFR-2结合可产生一系列调控机制,可提高血管通透性,诱导内皮细胞增殖,与肺癌的发生、发展密切相关。甲磺酸阿帕替尼是一种小分子抗血管生成靶向药物,其主要作用机制是可与酪氨酸激酶(PTK)的ATP结合,使PTK无法激活,从而阻断VEGFR-2,抑制丝裂原活化蛋白激酶(MAPK)的活化,抑制血管内皮细胞的增殖;还可通过抑制VEGF受体酶,使其失活,抑制VEGF生成,最终阻碍肿瘤血管生成,产生抗肿瘤作用[6]。石明伟等研究表明[7],阿帕替尼对晚期NSCLC有一定疗效,且产生的毒副作用患者可以耐受。
GP方案是吉西他滨和顺铂的联合化疗方案,是美国综合肿瘤网络中心(NCCN)指南推荐的晚期NSCLC标准化疗方案[8]。顺铂属于细胞周期肺特异性药物,作用机制是在DNA的嘌呤和嘧啶碱基处,与其形成链内、链间交叉联结,由此破坏DNA功能,抑制肿瘤细胞DNA的复制,产生广谱抗肿瘤作用;而吉西他滨则是一种二氟核苷类抗代谢药物,在DNA合成和修复中,其可竞争性嵌入DNA双链,抑制DNA合成和修复,可与顺铂联合产生协同作用,加强抑制肿瘤细胞增殖的效果,因此产生更强的抗肿瘤作用[9]。
本文研究结果表明,观察组的总缓解率和临床控制率显著高于对照组,观察组中位生存期显著高于对照组(P<0.05),说明阿帕替尼与GP方案联合可有效提高晚期NSCLC的疗效。原因是GP方案中的药物能抑制肿瘤细胞DNA的复制产生抗肿瘤作用,而阿帕替尼则是靶向性抑制血管内皮细胞的增殖和VEGF的释放,通过影响肿瘤血管生成产生抗肿瘤作用,两者具有不同的药理作用机制,因此可产生协同作用,加强抗肿瘤药效,从而提高疗效。与对照组比较,观察组中位生存期延长了2个月,但对1年生存率无影响。
CEA是一种可溶性酸性糖蛋白,带有人类胚胎抗原决定簇,主要存在于癌组织和胚胎组织,是一种非器官特异性肿瘤相关抗原,在消化道肿瘤、乳腺癌、肺癌等肿瘤患者体内,其水平异常升高[10]。CEA可促进肿瘤细胞与机体正常细胞的结合,导致肿瘤的转移。VEGF通过与靶细胞结合,促进血管内皮细胞的增殖,抑制内皮细胞凋亡,诱导蛋白酶表达,导致肿瘤不断新生血管,加重肿瘤病情,并且还会提高转移的风险[11]。CYFRA21-1是细胞角蛋白19的2个单克隆抗体,是细胞骨架的标志物,主要分布于肺、乳腺上皮,在正常人体内,含量很低,当发生癌变时,由上皮释放入血,在肺鳞癌中的灵敏度最高[12]。CEA、VEGF、CYFRA21-1对于NSCLC具有较高的临床应用价值,可以作为NSCLC的诊断、病情监测及疗效评估。本文研究结果中,观察组血清CEA、VEGF、CYFRA21-1水平显著低于对照组(P<0.05)。提示观察组患者病情得到缓解,肿瘤的生长受到抑制,因此该三项肿瘤标志物水平显著下降。
另外,观察组SF-36评分、KPS评分显著高于对照组(P<0.05)。观察组的白细胞减少、血小板减少、胃肠道反应及肝肾功能损害发生率均显著低于对照组(P<0.05)。说明通过阿帕替尼的应用,可减少化疗药物的用量,进而降低毒副作用,有效提高患者的生存质量,提示其联合应用安全可靠。
综上,阿帕替尼联合GP方案可显著提高晚期非小细胞肺癌患者的近期疗效,降低血清肿瘤标志物水平,延长生存期,且并不会明显增加毒副作用。

