曲妥珠单抗、吉西他滨、紫杉醇联合疗法对转移性乳腺癌患者血清肿瘤标志物和免疫功能的影响
严 婕 何建怀 胡雄强
乳腺癌是发生在乳腺导管上皮及末梢导管上皮的恶性肿瘤,其中1/4~1/3患者免疫组化和病理确诊为人表皮生长因子受体2(HER-2)阳性。HER-2 阳性乳腺癌患者恶性程度高,转移率高,预后较差[1]。目前针对不同分子靶点的抗肿瘤药物与针对相关基因的特异性治疗方案也逐渐成为临床研究和应用的热点。曲妥珠单抗是一种重组DNA衍生的人源化单克隆抗体,它以肿瘤细胞上的HER-2蛋白为靶点,通过阻断HER-2转导通路,从而抑制肿瘤细胞的增殖。有报道指出,应用曲妥珠单抗对乳腺癌患者进行新辅助化疗时,可提高患者的客观缓解率[2]。吉西他滨属于细胞周期特异性药物,体内经脱氧胞嘧啶核苷激酶磷酸化成为具有活性的二磷酸及三磷酸核苷,抑制核苷酸还原酶,干扰脱氧核糖核酸合成,致癌细胞死亡,对乳腺癌具有一定疗效,且患者耐受性良好。为进一步积极探索临床治疗新方案,我们以80例乳腺癌患者作为研究对象,探析了曲妥珠单抗联合吉西他滨及紫杉醇治疗HER-2阳性乳腺癌患者的临床疗效,现进行如下报告。
1 资料与方法
1.1 一般资料
研究对象选取为2015年1月至2017年1月间于我院进行治疗的80例乳腺癌患者。上述患者均经病理组织学及细胞学检查并结合临床诊断等均符合晚期乳腺癌诊断标准,本研究经医院伦理委员会审核予批准。入组标准:①预计存活时间>6个月;②卡氏评分>70分;③ECOG评分≤2分;④免疫组化和病理确诊为Her-2阳性;⑤患者知情并自愿加入研究。排除标准:①具有放化疗史;②年老体弱且伴有心肺肝等重要器官功能异常者;③哺乳期或妊娠期;④精神疾病或神志不清者。利用随机数字表法将上述患者分为2组,其中对照组40例,年龄37~60岁,平均年龄(43.25±5.41)岁,TNM分期:Ⅱ期 26例、Ⅲ期 14 例,给予吉西他滨联合曲妥珠单抗治疗;研究组40例,年龄36~61岁,平均年龄(44.01±5.54)岁,TNM分期:Ⅱ期25例、Ⅲ期 15例,给予曲妥珠单抗、吉西他滨联合紫杉醇治疗。对比2组患者的一般基线资料,统计学差异不明显(P>0.05)。
1.2 方法
对照组给予吉西他滨联合曲妥珠单抗治疗。吉西他滨,以生理盐水或5%葡萄糖溶液进行稀释,d1、d8,剂量:1 000 mg/m2,静脉滴注1 h,每3周为1个周期,持续6个周期。滴注前3天开始肌注地塞米松每次8 mg,12 h/次及口服西咪替丁300 mg,10 h/次,进行治疗预处理以防止胃肠道反应。给药前30~60 min,先给扑热息痛和苯海拉明,以预防过敏反应。曲妥珠单抗静脉滴注,每周1次,第1周剂量4 mg/kg,之后每周2 mg/kg,每3周为1个周期,持续6个周期。研究组在此基础上再联用紫杉醇,剂量:175 mg/m2静脉输注前必须用5%葡萄糖注射液或0.9%生理盐水稀释,稀释液终浓度应为0.3~1.2 mg/ml,每3周为1个周期,持续6个周期。
1.3 观察指标与疗效判定
①于治疗前后分别抽取空腹外周静脉血10 ml,待高速离心分离后,用于检测血清肿瘤标志物水平,包括:配癌抗原(TNF-α)、糖蛋白125(CA125)、糖蛋白153(CA153)和多肽特异性抗原(TPS)指标水平变化情况。采用酶联免疫吸附法(ELLISA法),试剂盒购于美国罗氏,按说明进行相应操作。②于治疗前后抽取空腹静脉血5 ml,待分离血清后检测T淋巴细胞亚群(CD3+、CD4+、CD8+)及自然杀伤细胞(NK)指标水平变化情况。采用美国赛默飞公司生产流式细胞仪及相应配套试剂盒进行检测。③以WHO制定的实体瘤疗效评价标准并结合实际影像学检查,可分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。客观缓解率= CR+PR,临床受益率=CR+PR+SD。④比较用药期间不良反应发生情况:如:骨髓抑制、腹泻、肝损伤、肾功能异常等。
1.4 统计学处理
采用统计学软件(SPSS 19.0)对数据进行处理分析,其中计数资料进行χ2检验,计量资料进行t检验,以P<0.05作为统计学差异判定标准。
2 结果
2.1 2组患者治疗前后肿瘤标志物水平变化比较
2组患者血清中CEA、CA125、CA153和TPS指标治疗前比较,统计学差异均不明显(P>0.05),治疗后较治疗前均明显降低(P<0.05),且研究组较对照组下降更为显著(P<0.05),见表1。
2.2 2组患者治疗前后免疫功能指标变化比较
对照组和研究组CD3+、CD4+、CD4+/CD8+及NK治疗前比较无统计学差异(P>0.05),治疗后上述指标组内比较均显著下降(P<0.05),且研究组较对照组降低更明显,差异有统计学意义(P<0.05),见表2。

表1 治疗前后肿瘤标志物水平变化比较
注:*为与治疗前比较,P<0.05;#为与对照组比较,P<0.05。

表2 治疗前后免疫功能指标变化比较
注:*为与治疗前比较,P<0.05;#为与对照组比较,P<0.05。
2.3 2组患者临床疗效比较
研究组患者治疗后的客观缓解率和临床受益率均显著高于对照组,统计学差异明显(P<0.05),见表3。
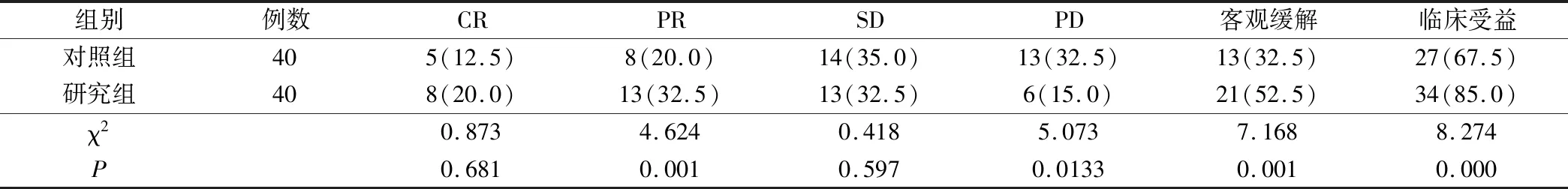
表3 2组患者临床疗效比较(例,%)
2.4 2组患者不良反应发生情况
治疗期间,2组患者发生骨髓抑制、腹泻、肝损伤、肾功能异常等不良反应发生率比较,差异均无统计学意义(P>0.05),见表4。
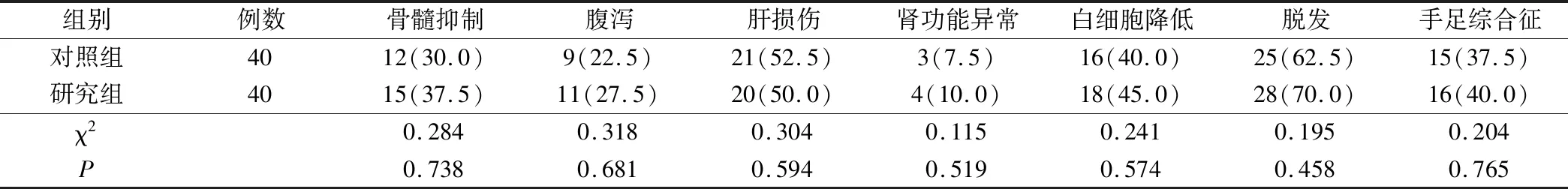
表4 2组患者不良反应发生情况比较(例,%)
3 讨论
恶性肿瘤是严重威胁人类健康的常见病和多发病,近年来,其发病率呈递增趋势,且患者呈现年轻化。由于细胞表面蛋白HER-2是由HER-2基因生成的,约30%乳腺癌患者体内HER-2基因过表达或HER-2蛋白表达水平较高,在乳腺癌的病程进程中发挥重要作用。HER-2阳性与患者淋巴结转移、组织学分级差及病灶大等多种预后不良因素密切关联[3]。无论是作为手术治疗后的辅助治疗或者是不能进行手术的替代治疗,化疗已成为乳腺癌综合治疗中不可或缺的一部分。通过辅助化疗,可有效降低肿瘤灶期,提高局部乳腺癌手术切除率[4],其中新辅助化疗是最常见的一种方法,即手术前通过全身化疗的方式来提高患者抗癌疗效,延长生存周期[5]。
曲妥珠单抗是一种人源化针对HER-2受体的单克隆抗体,2002年美国FDA批准上市使用,作为第1个乳腺癌靶向治疗药物。曲妥珠单抗主要通过与HER-2受体结合内吞进入肿瘤细胞核内,从而阻断了HER-2循环到肿瘤细胞膜,使HER-2蛋白质加速旁路降解,最终抑制肿瘤细胞向恶性表型转导[6]。此外,它还能作用于人体免疫细胞,产生抗体依赖性细胞毒效应(ADCC),使免疫细胞聚集并攻击杀死肿瘤细胞。曲妥珠单抗是一种新型选择性强、高效、低毒的靶向治疗药物,能够克服HER-2过表达的乳腺癌细胞对放疗、化疗、内分泌治疗的耐受,增强其他辅助治疗的疗效,曲妥珠单抗治疗HER-2阳性转移性乳腺癌患者临床疗效可观,其疗效远超过了传统的化疗药物。吉西他滨化学结构类似于阿糖胞苷,为脱氧胞嘧啶核苷类似物,为周期特异性抗代谢类药物。在细胞内经过核苷酸酶的作用转化成具有活性的二磷酸(dFdCDP)及三磷酸核苷(dFdCTP),此二者可一直DNA合成。主要作用于肿瘤细胞S期,可以组织G1期向S期的进展,对多种实体瘤有明显的细胞毒作用,是广谱的抗代谢药物[7]。吉西他滨的细胞毒作用呈时间和剂量依耐性。紫杉醇为抗微管类的抗肿瘤药,它可通过促进纺缍体向管蛋白亚单位的聚合而促进微管的装配,即使在正常微管装配所需要的介质(如三磷酸鸟苷,GSP)缺失的情况下也可产生这种作用,从而形成稳定的,无功能的微管,尽管该药明确的作用机制尚不清楚。紫杉醇干扰了微管系统中的动态平衡,使细胞停止在细胞周期的G2晚期和有丝分裂期,从而抑制了细胞的复制并使神经组织的功能受到损伤。
肿瘤标志物是指由肿瘤细胞异常产生的物质,在正常患者体内水平很低,其水平变化与病情进展及疗效有关,在临床诊断中具有极高的参考价值[8]。癌胚抗原(CEA)在结肠、胃、肺、乳腺等癌组织中可表达出现,并分泌于体液中。CA125则是卵巢癌的特异性标志物,在部分乳腺癌患者中也会发生一定程度的升高;CA153则在45%的乳腺癌患者以及一部分卵巢癌、消化道肿瘤患者体内发生升高[9]。TPS能够很好地体现肿瘤的生物学行为,在肿瘤细胞增殖活跃期间呈明显高表达[10]。本研究中,2组患者血清中CEA、CA125、CA153和TPS指标治疗前比较均统计学差异不明显(P>0.05),治疗后较治疗前均明显降低(P<0.05),且研究组较对照组下降更为显著(P<0.05),提示联合疗法对于抑制肿瘤生长,减少肿瘤标志物分泌有重要作用。此外,研究组患者的客观缓解率及临床受益率显著优于对照组(P<0.05),表明曲妥珠单抗联合吉西他滨和紫杉醇治疗乳腺癌具有较好的疗效。
乳腺癌患者普遍存在免疫抑制,患者的免疫功能较正常时普遍下降,且化疗本身对患者的免疫功能也存在一定的损伤,因此患者的免疫功能状态也是治疗过程中一直持续关注的。CD3+为辅助型T细胞(Th),可反映外周淋巴细胞总数水平,反映免疫功能状况。CD4+细胞为诱导/辅助性T细胞,是人体免疫系统最重要的枢纽细胞。CD8+细胞可以直接识别并杀伤致病细胞。而CD4+/CD8+被称为免疫调节指数,可迅速判断人体免疫功能发生紊乱。研究结果显示,对照组和研究组CD3+、CD4+、CD4+/CD8+及NK治疗前比较无统计学差异(P>0.05),治疗后上述指标组内比较均显著下降(P<0.05),且研究组CD3+、CD4+/CD8+及NK较对照组降低更明显,差异有统计学意义(P<0.05),表明联合疗法对于增加患者免疫功能,抑制肿瘤细胞生长具有积极意义。
综上所述,曲妥珠单抗联合吉西他滨和紫杉醇治疗乳腺癌可有效减少肿瘤标志物分泌,抑制肿瘤生长,提高机体免疫功能,疗效显著。

