适用于蛋白质组分析的粉红单端 孢菌蛋白提取方法的建立
王 鹏,王军节,李贞彪
(北方民族大学 生物科学与工程学院,植物性农产品贮藏与加工重点实验室,宁夏 银川 750021)
粉红单端孢(Trichotheciumroseum)属于半知菌门聚单孢属的一种世界性且危害严重的植物病原真菌[1]。该菌分生孢子在顶端侧生,单孢倒梨形且无色,顶部有偏乳头状突起,常聚生,成熟孢子中间有隔膜,分隔处稍缢缩;其产孢量大,分生孢子梗直立、无分枝、无色、无隔,菌落近似圆形,初为白色绒毛状或粉状,后变为粉红色,背面呈浅橙红色[2]。该菌不仅能侵染玉米[3]、向日葵[4]、银杏树干[5]、中国槭树干[6]、无患子树干[7]、中国玉竹[8]等植物,还可造成苹果[9-11]、石果[12]、甜瓜[13-15]、梨[16]、葡萄[17-18]、番茄[19-21]、黄瓜[21]、菜豆[22]和辣椒[23]等果蔬发生严重真菌病害及生物污染。粉红单端孢侵染过程还可产生粉红单端孢毒素给人类带来安全隐患[24]。因此,研究控制粉红单端孢的病害具有重要意义,而全面解释病菌的分子致病机理是有效控制其病害的前提。目前,已有研究人员从毒素[25]和其他代谢产物[26]水平对该菌致病机制开展了初步研究,但从蛋白质组水平揭示粉红单端孢分子致病机制的研究尚未见报道。
目前,蛋白质组学作为一种研究病原真菌致病机制的重要手段已被广泛应用。双向电泳(Two-dimensional gel electrophoresis,2-DE)技术是蛋白质组学研究中一种有效的蛋白质分离方法,而获得高分辨率2-DE图谱的关键步骤是蛋白质提取[27]。适用于2-DE技术的植物病原真菌总蛋白提取的常用TCA/丙酮[28]、酚抽提[29]及其衍生的改良方法。江珊等[30]采用改进的TCA/丙酮法对稻瘟病菌(Pyriculariaoryzae)菌丝体蛋白质进行双向电泳分析,获得了高分辨率电泳图谱。Fernández-Acero等[31]研究了磷酸盐缓冲液预处理对TCA-丙酮法提取灰葡萄孢(Botrytiscinerea)菌丝体总蛋白的效果,发现在TCA/丙酮沉淀蛋白质样品之前使用磷酸盐缓冲液进行预处理可显著提高灰葡萄孢菌丝体总蛋白的提取效果。González等[32]研究发现,TCA/丙酮结合苯酚提取法所提取的灰葡萄孢菌丝体蛋白含量高于磷酸-TCA-丙酮法,且该方法提高了蛋白点的分辨率,减少拖尾,有更多的蛋白点被检测出。舒灿伟等[33]对采用不同蛋白质提取方法所提取的水稻纹枯病菌(Rhizoctoniasolani)蛋白质样品质量进行比较研究,结果表明,优化的TCA/丙酮-酚/SDS联合抽提法适用于水稻纹枯病菌蛋白质双向电泳的提取。然而,有关粉红单端孢蛋白质的有效提取方法研究鲜有报道。
本研究采用超声-TCA-丙酮、超声-磷酸-TCA-丙酮、超声-SDS、超声-TCA/丙酮-酚/SDS联合抽提和TCA/丙酮-酚/SDS联合抽提等方法提取粉红单端孢总蛋白,从蛋白质含量、浓度和电泳分辨率三方面比较了不同提取方法的提取效果,对较理想的2种方法进行双向电泳对比分析,旨在探索出一套适合于双向电泳分析的粉红单端孢总蛋白的提取方法,以期为粉红单端孢的蛋白质组学研究提供技术支撑,进而为该菌致病机制的揭示以及病害控制等奠定基础。
1 材料和方法
1.1 材料
供试菌株分离自发病甜瓜果实,通过分子生物学鉴定为粉红单端孢,由北方民族大学植物性农产品贮藏与加工重点实验室保存。
1.2 主要试剂及仪器
甲叉双丙烯酰胺、硫酸铵、丙烯酰胺、溴酚蓝、考马斯亮蓝G-250、考马斯亮蓝R-250、TRIS、低熔点琼脂糖、甘油、矿物油、尿素、硫脲、碘代乙酰胺和β-巯基乙醇均购自Amresco;十二烷基硫酸钠、DTT和SDS购自Biotopped;甘氨酸购自Sigma;Tris饱和酚购自Solarbio;氯乙酸、磷酸、丙酮、甲醇和冰乙酸均购自天津市大茂化学试剂厂。
BMJ-800C霉菌培养箱(上海博讯实业有限公司医疗设备厂)、SW-CJ-1FD双垂直无菌工作台(苏净集团苏州安泰空气技术有限公司)、H2100R冷冻离心机(湘仪离心机仪器有限公司)、UV-9000S紫外可见分光光度计(上海元析仪器有限公司)、YXQ-LS-50A高压灭菌锅(上海博讯实业有限公司医疗设备厂)、DYCZ-24DN迷你电泳仪(北京市六一仪器厂)、PROTEAN IEFSytem(BIO RAD)、PROTEAN Ⅱ XL Cell(BIO RAD)、721BRO3006 UV凝胶成像系统(BIO RAD)和GS-800彩色扫描仪(BIO RAD)。
1.3 方法
1.3.1 病原菌培养与收集 将粉红单端孢接种于PDA平板上,置于28 ℃霉菌培养箱中培养7 d后。无菌条件下,每包用钥匙刮取菌体2 g,液氮速冻后置于-80 ℃冰箱保存,备用。
1.3.2 菌体总蛋白的提取 超声-TCA-丙酮法[34]。取2 g冻干的菌体与4 g石英砂混合,加液氮研磨成粉末后转入50 mL离心管,立即加入30 mL预冷的10% TCA-丙酮溶液(含0.07%V/Vβ-巯基乙醇),涡旋混匀,除去石英砂;4 ℃、53 kHz超声波3~5 min,-20 ℃过夜。将混合物在4 ℃、12 000 r/min离心20 min后弃上清,加入30 mL丙酮溶液(含0.07%V/Vβ-巯基乙醇)重悬沉淀后在-20 ℃静置1 h。重复洗涤4次;最后一次弃上清,将沉淀敞口置于通风橱内,使沉淀中残留的丙酮挥发干净,获得蛋白质干粉-20 ℃保存。
超声-磷酸-TCA-丙酮法[35]。取2 g冻干的菌体与4 g石英砂混合,加液氮研磨成粉末后转入50 mL离心管,立即加入30 mL预冷的10 mmol/L磷酸钾-磷酸缓冲液(含0.07%V/Vβ-巯基乙醇,pH值7.4),涡旋混匀,除去石英砂;4 ℃、53 kHz超声波3~5 min,4 ℃静置2 h。将混合物在4 ℃、12 000 r/min离心20 min,弃上清,加入30 mL预冷的10% TCA-丙酮溶液(含0.07%V/Vβ-巯基乙醇),涡旋混匀,-20 ℃静置过夜。4 ℃、12 000 r/min离心20 min后弃上清,加入30 mL丙酮溶液(含0.07%V/Vβ-巯基乙醇)重悬沉淀后在-20 ℃静置1 h。重复洗涤4次;最后一次弃上清,将沉淀敞口置于通风橱内,使沉淀中残留的丙酮挥发干净,获得蛋白质干粉-20 ℃保存。
超声-SDS法[36]。取2 g冻干的菌体与4 g石英砂混合,液氮充分研磨至粉末后转入50 mL离心管,立即加入30 mL SDS缓冲溶液(30%甘油、4%SDS、5% β-巯基乙醇、Tris-HCl(0.1 mol/L,pH值6.8),V/V),充分混匀,除去石英砂;4 ℃、53 kHz超声波3~5 min,80 ℃下水浴加热5 min后在4 ℃、12 000 r/min离心20 min,弃沉淀;在上清液中加入4倍体积预冷丙酮溶液(含0.07%V/Vβ-巯基乙醇),涡旋混匀后-20 ℃过夜。将混合物在4 ℃、12 000 r/min离心20 min获得沉淀,用预冷的丙酮溶液(含0.07%V/Vβ-巯基乙醇)洗涤沉淀1次,4 ℃、12 000 r/min离心20 min。将沉淀敞口置于通风橱内,使沉淀中残留的丙酮挥发干净,获得蛋白质干粉-20 ℃保存。
超声-TCA/丙酮-酚/SDS联合抽提法[37]。取2 g冻干的菌体与4 g石英砂混合,液氮充分研磨至粉末后转入50 mL离心管,立即加入30 mL预冷的10% TCA-丙酮溶液(含0.07%V/Vβ-巯基乙醇),涡旋混匀,除去石英砂。4 ℃、53 kHz超声波3~5 min,-20 ℃过夜。将混合物在4 ℃、12 000 r/min离心20 min后弃上清,用80%甲醇溶液(含100 mmol/L的醋酸铵)和80%丙酮溶液(含0.07%V/Vβ-巯基乙醇)各洗涤沉淀1次,在通风橱内干燥10 min。再加入10 mL SDS/酚抽提液(Tris饱和酚(pH值7.8):30% 甘油、4% SDS、5% 巯基还原剂、Tris-HCl(0.1 mol/L,pH值6.8),V/V),振荡混匀温育5 min。4 ℃、12 000 r/min离心20 min,转移上层酚相至新离心管中,加入5倍体积预冷的80%甲醇溶液(含100 mmol/L的醋酸铵),-20 ℃过夜。将混合物在4 ℃、12 000 r/min离心20 min获得蛋白质沉淀,用80%甲醇溶液(含100 mmol/L的醋酸铵)和80%丙酮溶液(含0.07%V/Vβ-巯基乙醇)各洗涤沉淀1次,4 ℃、12 000 r/min、20 min离心,将沉淀敞口置于通风橱内,使沉淀中残留的丙酮挥发干净,获得蛋白质干粉-20 ℃保存。
TCA/丙酮-酚/SDS联合抽提法[37]。取2 g冻干的菌体与4 g石英砂混合,液氮充分研磨至粉末后转入50 mL离心管,立即加入30 mL预冷的10% TCA-丙酮溶液(含0.07%V/Vβ-巯基乙醇),涡旋混匀,除去石英砂,-20 ℃过夜。将混合物在4 ℃、12 000 r/min离心20 min后弃上清,用80%甲醇溶液(含100 mmol/L的醋酸铵)和80%丙酮溶液(含0.07%V/Vβ-巯基乙醇)各洗涤沉淀1次,在通风橱内干燥10 min。再加入10 mL SDS/酚抽提液(Tris饱和酚(pH值7.8):30% 甘油、4% SDS、5% 巯基还原剂、Tris-HCl(0.1 mol/L,pH值 6.8),V/V),振荡混匀温育5 min。4 ℃、12 000 r/min离心20 min,转移上层酚相至新离心管中,加入5倍体积预冷的80%甲醇溶液(含100 mmol/L的醋酸铵),-20 ℃过夜。将混合物在4 ℃、12 000 r/min离心20 min获得蛋白质沉淀,用80%甲醇溶液(含100 mmol/L的醋酸铵)和80%丙酮溶液(含0.07%V/Vβ-巯基乙醇)各洗涤沉淀1次,4 ℃、12 000 r/min、20 min离心,将沉淀敞口置于通风橱内,使沉淀中残留的丙酮挥发干净,获得蛋白质干粉-20 ℃保存。
1.3.3 蛋白质溶解及定量分析 蛋白质溶解参考Choi和Shim[38]方法,分别取上述5种方法获得的蛋白质样品,称取0.1 g蛋白质干粉加入1 mL裂解液(8.0 mol/L尿素、2.0 mol/L硫脲、4%m/VCHAPS、1%m/VDTT、0.5%V/VBio-lyte 4-7和Bio-lyte 3-10)中室温进行裂解3~4 h,每隔30 min轻轻摇匀1次,4 ℃、12 000 r/min离心20 min取上清液。样品可在-80 ℃下保存或直接电泳。蛋白质定量采用Bradford法[39],牛血清蛋白(BSA)为标准蛋白,考马斯亮蓝G-250染色,标准曲线方程为Y=7.948 6X+0.015 9,R2=0.997 8,结果分别用mg/mL和mg/g表示。
1.3.4 SDS-PAGE分析 取5种方法提取的蛋白质溶液各100 μL分别与100 μL的2×SDS-PAGE上样缓冲液混合,100 ℃水浴加热3~5 min,冷却后4 ℃、12 000 r/min、1 min离心备用。先任选一种方法,参考赵玲玲等[40]方法,采用30 μg等体积上样,设计9%,12%,15%的分离胶和5%的浓缩胶进行SDS-PAGE电泳分析,选择适合于粉红单端孢菌电泳的聚丙烯酰胺凝胶浓度,其不同浓度的聚丙烯酰胺凝胶配制如表1所示。电泳结束,用考马斯亮蓝染液(甲醇45 mL、超纯水45 mL、冰乙酸10 mL、溶解0.25 g的考马斯亮蓝R-250)在水平摇床上慢速水平摇动染色0.5~1 h,再用脱色液(250 mL甲醇、80 mL冰乙酸、超纯水定容至1 000 mL)脱色4~8 h,期间更换脱色液3~4次,脱色至胶体的蓝色背景褪去,能看到明显的条带,用UV凝胶成像系统拍照后分析结果。

表1 不同浓度聚丙烯酰胺凝胶的配制Tab.1 Preparation of different concentrations of polyacrylamide gels
1.3.5 双向电泳分析[41-42]从5种粉红单端孢菌体蛋白质提取方法中选取2种提取方法较好的蛋白质,第一向等电聚焦使用长度为17 cm、pH值3~10非线型胶条,根据测定的蛋白质浓度上样量400 μg,上样总体积350 μL的水化上样方式进行等电聚焦。第二向用SDS-聚丙烯酰胺凝胶电泳进行分离,获得蛋白质双向电泳图谱并分析结果。
1.3.6 凝胶染色及图像处理 用考马斯亮蓝染液(甲醇45 mL、超纯水45 mL、冰乙酸10 mL、溶解0.25 g、考马斯亮蓝R-250)染色4 h以上或过夜后,先用脱色液Ⅰ(V甲醇∶V超纯水∶V冰乙酸=9∶9∶2)脱色30 min,再脱色液Ⅱ(V乙醇∶V超纯水∶V冰乙酸=9∶9∶2)脱色4~8 h,期间更换脱色液Ⅱ 3~4次,直到凝胶背景干净。用GS-800 Calibrated Imaging Densitometer(BIO-RAD)型凝胶扫描仪扫描,并用PDQuantity One软件进行图片分析。
1.3.7 数据处理与分析 所有试验数据采用GraphPad Prism 5.0、IBM SPSS 21.0软件统计分析与作图分析。
2 结果与分析
2.1 蛋白质提取效果的比较
不同提取方法对粉红单端孢菌蛋白质浓度和含量的影响如图1所示。由图1可知,不同提取方法均能获得菌体蛋白,但获得蛋白质的浓度和含量差异显著;如图1,浓度从高到低依次为超声-TCA/丙酮-酚/SDS联合抽提法、TCA/丙酮-酚/SDS联合抽提法、超声-SDS法、超声-TCA-丙酮法和超声-磷酸-TCA-丙酮法,分别为6.650,6.221,2.777,2.676,1.219 mg/mL,超声-TCA/丙酮-酚/SDS联合抽提法获得的蛋白质浓度显著高于其他方法,为6.650 mg/mL;超声-SDS法获得的蛋白质含量最低,为1.111 mg/g,而超声-磷酸-TCA-丙酮法、TCA/丙酮-酚/SDS联合抽提法、超声-TCA/丙酮-酚/SDS联合抽提法、超声-TCA-丙酮法分别比超声-SDS法获得的蛋白含量高1.8,2.5,2.7,4.1倍,超声-TCA-丙酮法获得的蛋白质含量显著高于其他方法,为2.993 mg/g(图1)。

Ⅰ.超声-TCA-丙酮法; Ⅱ.超声-磷酸-TCA-丙酮法;Ⅲ.超声-SDS法;Ⅳ.超声-TCA/丙酮-酚/SDS联合抽提法; Ⅴ.TCA/丙酮-酚/SDS联合抽提法。图3同。
Ⅰ.Ultrasound-TCA-acetone method; Ⅱ.Ultrasound-phosphoric acid-TCA-acetone method; Ⅲ.Ultrasound-SDS method; Ⅳ.Ultrasonic-TCA/acetone-phenol/SDS combined extraction; Ⅴ.TCA/acetone-phenol/SDS combined extraction.The same as Fig.3.
图1 不同菌体蛋白提取方法对质量浓度及含量的影响
Fig.1 Effect of different methods of bacterial proteinextraction on concentration and content
2.2 聚丙烯酰胺凝胶浓度的比较
不同浓度的聚丙烯酰胺凝胶对蛋白质电泳图谱的影响如图2所示,不同浓度的聚丙烯酰胺均在不同程度上影响电泳图谱的分辨率,获得的电泳图谱存在差异;9%的聚丙烯酰胺凝胶电泳图谱分离得到的蛋白质Marker和超声-TCA-丙酮法获得的蛋白质样品分别有9,15条带,条带清晰,但不能分离出小分子蛋白,使电泳尾部有大量的蛋白分子堆积现象;12%的聚丙烯酰胺凝胶获得的电泳图谱背景色较浅、条带清晰可见、条带分布均匀,分离得到的蛋白质Marker和超声-TCA-丙酮法获得的蛋白质样品分别有10,21条带;15%的聚丙烯酰胺凝胶获得的电泳图谱背景色较深、条带不清晰,分离得到的蛋白质Marker和超声-TCA-丙酮法获得的蛋白质样品分别有10,16条带,并且不能将大分子蛋白分离开。因此,浓度为9%和15%的聚丙烯酰胺凝胶电泳图谱分辨率较低,不适合于粉红单端孢菌的蛋白质电泳,而浓度为12%的聚丙烯酰胺凝胶电泳图谱分辨率较高,适合于该菌的蛋白质电泳。

M.蛋白质Marker;Ⅰ.超声-TCA-丙酮法。M.Protein Marker; I.Ultrasound-TCA-acetone method.
2.3 SDS-PAGE分离效果的比较
不同提取方法获得的粉红单端孢菌电泳图谱如图3所示。不同提取方法均能获得菌体蛋白,且蛋白质的分子质量多集中在40~170 ku,但不同方法所获得的蛋白在凝胶电泳中的条带数目及清晰度均存在差异;超声-TCA-丙酮法、超声-TCA/丙酮-酚/SDS联合抽提法和TCA/丙酮-酚/SDS联合抽提法所得样品电泳条带数目最多、最清晰、分离效果较好,说明这3种方法提取的蛋白质纯度高、污染少;超声-磷酸-TCA-丙酮法条带也多,但清晰度低,背景模糊,说明含有较多杂质;超声-SDS法几乎无条带,其蛋白质分子都聚集于末端,说明获得的蛋白质被降解为小分子肽链。因此,从单向SDS-PAGE的比较结果可以看出,超声-TCA-丙酮法、超声-TCA/丙酮-酚/SDS联合抽提法和TCA/丙酮-酚/SDS联合抽提法效果较好。
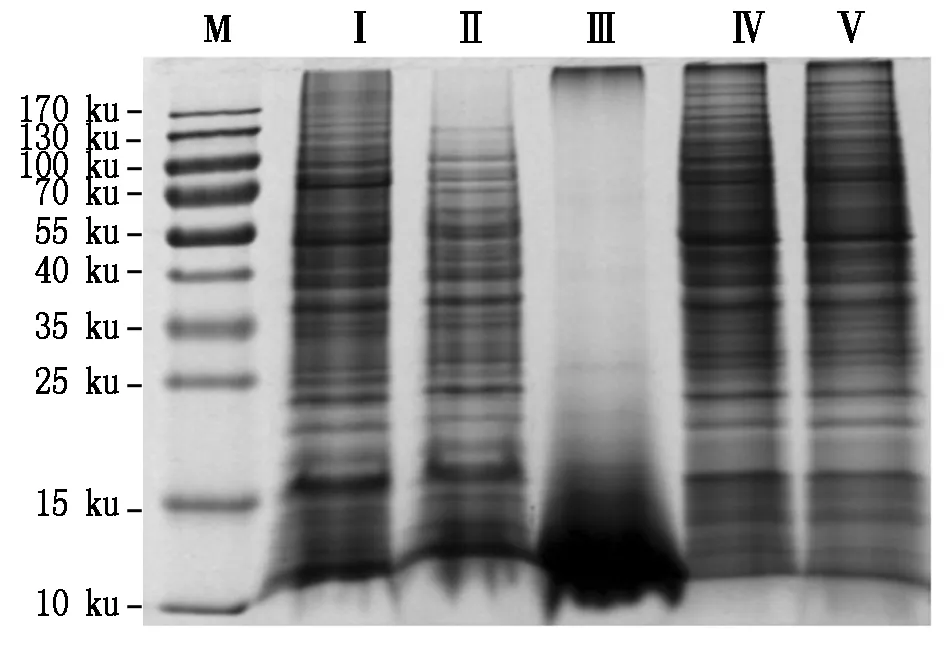
图3 不同方法提取菌总蛋白质的SDS-PAGE图谱Fig.3 SDS-PAGE profiles of total proteins extracted by different methods
2.4 双向电泳分析
超声-TCA-丙酮法和超声-TCA/丙酮-酚/SDS联合抽提获取的粉红单端孢菌蛋白质,分别进行双向电泳得到的电泳图谱如图4所示。本次试验除了提取方法不同,其他试验条件完全一致。由图4可知,超声-TCA-丙酮法和超声-TCA/丙酮-酚/SDS联合抽提法均获得道了适合于双向电泳的蛋白质,但不同提取方法获得的蛋白质存在差异;超声-TCA-丙酮法得到的电泳图谱有642个蛋白质点,并且凝胶背景颜色较深、背景模糊、有许多纵条纹和横条纹,蛋白质点也有严重的拖尾现象;超声-TCA/丙酮-酚/SDS联合抽提法得到的电泳图谱有1 238个蛋白质点,凝胶背景干净、清晰、横条纹和纵条纹较少,也无严重的拖尾现象。根据超声-TCA-丙酮法和超声-TCA/丙酮-酚/SDS联合抽提法提取的2种蛋白质粉末的颜色可知,超声-TCA-丙酮法获得的蛋白质粉末较多,带有淡淡的粉红色,而超声-TCA/丙酮-酚/SDS联合抽提法得到的蛋白质粉末虽然少,但是粉末为纯白色干粉。通过双向电泳图谱分析可知,超声-TCA-丙酮法获得的图谱背景颜色含糊不清,有拖尾现象,说明蛋白质中可能有大量的色素等杂质是造成此现象的主要原因。因此,超声-TCA/丙酮-酚/SDS联合抽提法提取的粉红单端孢菌体蛋白质适合于该菌双向电泳体系,后续有关粉红单端孢菌蛋白质组学的研究将采用超声-TCA/丙酮-酚/SDS联合抽提法进行。
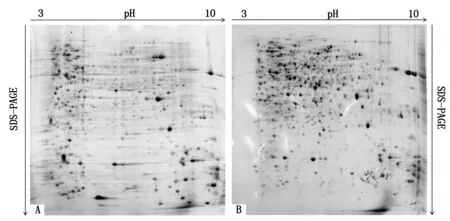
A.超声-TCA-丙酮法;B.超声-TCA/丙酮-酚/SDS联合抽提法。A.Ultrasonic-TCA-acetone method; B.Ultrasonic-TCA/acetone-phenol/SDS combined extraction method.
3 结论与讨论
不同蛋白质的提取方法直接影响蛋白质的提取效果,且不同材料的蛋白质提取存在较大差异[43]。研究结果表明,超声-TCA/丙酮-酚/SDS联合抽提法获得的粉红单端孢菌的蛋白质量显著高于TCA/丙酮-酚/SDS联合抽提法。与液氮研磨的TCA/丙酮-酚/SDS联合抽提方法相比,超声-TCA/丙酮-酚/SDS联合抽提方法增加了超声破碎过程,超声能给予液氮研磨后的二次破碎,增加了材料的破碎力度,能较好获得真菌菌丝和孢子体细胞壁上与多糖、几丁质等物质紧密结合的蛋白质。因此,超声破碎结合液氮研磨的双重物理破碎是一种理想的病原真菌蛋白质提取途径。研究结果还表明,在超声-TCA-丙酮、超声-磷酸-TCA-丙酮、超声-SDS和超声-TCA/丙酮-酚/SDS联合抽提等4种双重物理破碎方法中,超声-TCA-丙酮和超声-TCA/丙酮-酚/SDS联合抽提效果较好。超声-TCA-丙酮为经典的蛋白质提取方法,其操作简单并能降低次生代谢物干扰、减少蛋白降解、消除蛋白质水解和其他蛋白酶修饰[44-45]。与超声-TCA-丙酮不同,超声-磷酸-TCA-丙酮法中磷酸处理可适当去除一些杂质,但该处理也会导致高分子质量蛋白的缺失。该研究结果与Elakhal等[34]和张小泉[35]的研究不相符,可能由于研究材料的不同所致。超声-SDS提取中加热过程可使蛋白降解为小分子物质而影响提取效果,该结果与舒灿伟等[33]研究结果不一致,可能是因为不同样品的蛋白质对温度的承受度不同所致。
进一步采用双向电泳分析表明,超声-TCA/丙酮-酚/SDS联合抽提获得的蛋白质质量明显高于超声-TCA-丙酮法,且能分离出更多的酸性蛋白。本研究结果与舒灿伟等[33]和冯浩等[37]的研究结果一致。这可能是在超声-TCA-丙酮法基础上,增加酚/SDS抽提步骤能溶解更多蛋白以及高效去除核酸、小分子物质等杂质。SDS是一种表面活性剂,能有效溶解蛋白质;酚抽提可大大增加蛋白的溶解性,同时能很好去除样品中盐离子、多糖、脂类、色素等杂质,被广泛应用于含较多干扰物材料的蛋白质提取[29]。Wang等[46]将TCA/丙酮沉淀和苯酚提取联合使用,综合了TCA-丙酮沉淀法和酚法的优点,其结果表明,酚/SDS联合抽提法比酚、SDS缓冲液单独提取的效果更好。Fernández-Acero等[36]的试验结果也表明,TCA/丙酮沉淀法和苯酚提取法的联合使用可以更好地提高蛋白质纯度。
由此可见,超声-TCA/丙酮-酚/SDS联合抽提是一种适用于粉红单端孢菌的蛋白质双向电泳提取方法。此外,iTRAQ技术作为一种新的、功能强大的比较质白质组学技术,具有高通量、重复性好、能够处理复杂样本等优点,其在真菌研究的应用价值中已得到初步验证[47]。但iTRAQ试剂几乎可以与样本中的所有蛋白结合,容易受样本中的杂质蛋白及样本处理过程中缓冲液的污染等缺点也制约了该技术的应用,需要对样本进行预处理并尽量减少操作过程中的污染[48]。由此表明,超声-TCA/丙酮法-酚/SDS抽提法可以高效的去除蛋白样品中的杂质,得到较高纯度及丰度的蛋白质,有望在iTRAQ技术中得到广泛的应用。

