白藜芦醇对高脂所致心肌细胞氧化应激损伤的保护作用及其与AMPK/mTORC1/p70S6K信号通路的相关性
张景怡,鲍翠玉,李 晶
(湖北科技学院 1. 药学院、2. 糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100)
糖尿病是一种在医疗保健系统中造成严重经济影响,且发病率越来越高的代谢性疾病[1],其心血管并发症的发病率和死亡率在逐年增加[2]。而糖尿病性心肌病是一种特殊的心脏并发症,近年来,诸多文献报道表明,糖尿病心肌病的发病过程与脂毒性密切相关[3],经常伴有相关的脂肪酸代谢失调。在糖尿病啮齿动物模型和肥胖患者中,尽管出现了高胰岛素血症和高血糖症,但心肌的损害几乎完全依赖于脂肪酸的利用,饱和脂肪酸的过量供应抑制葡萄糖氧化速率,并加剧心肌耗氧,增加了活性氧的产生和脂质体堆积,导致心肌氧化损伤[4-5]。
白藜芦醇是一种存在于虎杖、何首乌等天然植物中的非黄酮类多酚化合物,具有抗炎、抗血小板聚集、抗癌和抗衰老、保护血管和抗糖尿病及其并发症的作用[6]。研究发现,白藜芦醇可以降低血糖、改善血脂、抗氧化、抑制炎症因子表达等[7],据报道,白藜芦醇的这些作用可能与调控内质网应激、线粒体凋亡通路相关[8-9]。但AMPK/mTORC1/p70S6K信号通路与白藜芦醇抗脂毒性心肌细胞损伤的相关性,目前尚无文献报道。基于此,本研究以AMPK/mTORC1/p70S6K信号通路为切入点,采用棕榈酸(palmitic acid,PA)诱导的心肌细胞脂毒性损伤模型,探讨白藜芦醇对高脂所致心肌细胞损伤的保护作用及其机制。
1 材料与方法
1.1 材料
1.1.1细胞株 H9c2大鼠心肌细胞,购自上海通派生物有限公司。
1.1.2试剂 AMPKα、p-AMPKα(Thr172)、mTORC1、p-mTORC1(Ser2448)、p70S6K、p-p70S6K(Thr398)、Bcl-2、cleaved caspase-3、β-actin(8H10D10)抗体,购自美国CST公司;Bax抗体,购自Proteintech公司;PA、白藜芦醇,购自美国Sigma公司;DMEM培养基,购自美国HyClone公司;胎牛血清,购自浙江天杭生物科技股份有限公司;BCA蛋白定量试剂盒,购自VazymE公司;丙二醛(malondialdehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒,购自南京建成生物工程研究所;活性氧(reactive oxygen species,ROS)检测试剂盒、MTT检测试剂盒,均购自碧云天公司。
1.1.3仪器 细胞CO2培养箱(Thermo公司);超净工作台(苏州净化公司);恒温空气浴摇床(上海福玛实验设备有限公司);CKX41倒置相差显微镜(日本OLYMPUS公司);多功能酶标仪(美国宝特公司);流式细胞仪(美国BD Biosciences公司);电泳槽、电转膜仪(Bio-Rad公司);化学发光凝胶成像系统(英国SYNGENE公司)。
1.2 方法
1.2.1PA及白藜芦醇的配制 用0.1 mol·L-1的NaOH溶液,在70 ℃水浴中溶解一定量的PA,振荡混匀10 min,过滤,配成100 mmol·L-1的PA储存液。在55 ℃水浴中,用去离子水配制50 g·L-1的牛血清白蛋白(bovine serum albumin,BSA)溶液,过滤。将上述PA溶液和BSA溶液按1 ∶19的体积比混合,配成PA/BSA复合液,在水浴中振荡10 s,继续水浴10 min,取出后冷却至室温,过滤。然后,将上述复合液分别用DMEM培养基稀释。白藜芦醇则溶解于DMSO,使母液浓度达到100 mmol·L-1,使用前将其融于DMEM(含血清、双抗)达到工作液浓度,涡旋混匀后使用。
1.2.2细胞培养 从液氮中取出H9c2心肌细胞,接种于含25 mmol·L-1的葡萄糖、10%胎牛血清、双抗的DMEM培养基中,37 ℃、5% CO2培养箱培养24~48 h后更换培养液,直至细胞生长密度达到70%~80%时,用含有0.25% EDTA的胰酶轻轻吹打消化、传代至所需培养皿中进行实验。
1.2.3实验分组 ① PA浓度梯度: control组(空白对照组加入同等体积的PBS)、PA(0.1、0.2、0.4、0.8 mmol·L-1)刺激24 h组,进行MTT检测。② PA时间梯度: control组(空白对照组加入同等体积的PBS)、PA(0.4 mmol·L-1)刺激0、12、24、48 h组,进行MTT检测。③ 白藜芦醇作用实验:control组(空白对照组加入同等体积的PBS);PA(0.4 mmol·L-1)组;白藜芦醇(0、25、50、100 μmol·L-1)组,用含白藜芦醇培养基预处理1 h后吸出培养基,再加入含PA+白藜芦醇的培养基;白藜芦醇100 μmol·L-1组,用含白藜芦醇培养基预处理1 h后吸出培养基,再加入含PBS+白藜芦醇的培养基,进行MTT检测。④白藜芦醇作用机制实验: control组、PA 0.4 mmol·L-1组、PA 0.4 mmol·L-1+白藜芦醇100 μmol·L-1组(含白藜芦醇培养基预处理1 h后吸出培养基,再加入含PA+白藜芦醇的培养基),进行其他检测。
1.2.4MTT检测细胞增殖 以每孔含1×106个细胞为标准,接种于96孔板中(设立6个复孔),培养24 h后给药,进行孵育,每孔加入20 μL MTT(5 g·L-1,美国Sigma公司),将96孔板放置CO2培养箱培养4 h后,弃去上清液,并每孔加入DMSO 150 μL,用酶标仪检测570 nm处的各孔OD值。细胞活力=OD处理孔/OD阴性对照孔×100%。
1.2.5免疫荧光及流式检测ROS H9c2细胞接种6孔板,当细胞贴壁生长至70%~80%融合度,分组给药后,培养箱内孵育24 h,PBS反复冲洗后,一部分细胞培养板内加入10 mmol·L-1DHE,培养箱内孵育30 min,PBS反复冲洗后,采用荧光显微镜进行拍照,并用ImageJ 1.41软件分析红色荧光强度。另一部分细胞培养板,用胰酶消化制备成单细胞悬液,直接收集细胞。用0.5~1 mL冰冷PBS重悬细胞,用流式细胞检测仪检测ROS阳性细胞所占的比率。免疫荧光检测和流式细胞检测均采用480~535 nm波长激发,测定590~610 nm以上的发射,细胞应可分成两个亚群:ROS阴性细胞仅有很低的荧光强度,ROS阳性细胞有较强的红色荧光。
1.2.6氧化应激相关生化指标的检测 H9c2细胞接种6孔板,当细胞贴壁生长至70%~80%融合度,分组给药后,培养箱内孵育24 h,PBS反复冲洗后,收集H9c2细胞,经超声破碎处理后,分别按照试剂盒说明测定MDA含量和SOD活性。
1.2.7免疫印迹法检测蛋白表达 H9c2细胞放入5% CO2培养箱培养24 h后,PBS洗去细胞杂质,每个皿加入裂解液充分裂解细胞,细胞刮刀收集于离心管,离心后收集上清,用BCA试剂盒测定蛋白含量。蛋白定量后,取20 μL的蛋白样品上样于5%~15%的SDS-PAGE凝胶,电泳分离,冰浴下湿法转移至PVDF膜2 h,用5%的脱脂奶粉室温摇床封闭1 h,加入对应一抗4 ℃摇床孵育过夜。次日换为HRP标记的二抗室温孵育1 h,用ECL化学发光显影,然后凝胶成像系统检测AMPKα、p-AMPKα、mTORC1、p-mTORC1、p70S6K、p-p70S6K、β-actin的表达水平,以及凋亡相关蛋白Bcl-2、Bax、cleaved caspase-3的表达水平。
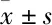
2 结果
2.1 白藜芦醇对高脂诱导的H9c2心肌细胞增殖能力低下的影响体外培养H9c2心肌细胞,用含PA(0.1、0.2、0.4、0.8 mmol·L-1)的DMEM培养基刺激24 h。如Fig 1A所示,随着PA浓度的增加,H9c2细胞存活率呈下降趋势,PA浓度在0.4 mmol·L-1时,降低明显(P<0.05)。Fig 1B结果显示,含PA 0.4 mmol·L-1的DMEM培养基刺激细胞0、12、24、48 h后,H9c2心肌细胞随着刺激时间的延长,细胞数量明显减少,在刺激细胞24 h时,细胞存活率开始明显降低(P<0.05)。因此,我们将PA浓度定为0.4 mmol·L-1,刺激时间定为24 h开展下一步实验。如Fig 1C所示,当0.4 mmol·L-1PA刺激24 h时,H9c2心肌细胞的增殖能力明显降低,随着白藜芦醇浓度的升高,PA+白藜芦醇组的细胞增殖率呈现浓度依赖性升高趋势。提示白藜芦醇对高脂诱导的心肌细胞增殖率的损伤有明显的改善作用,因此,在后续实验中选择白藜芦醇浓度为100 μmol·L-1。

Fig 1 Viability of H9c2 cells treated with PA alone or combination of PA and resveratrol n=5)
A: Concentration-dependent cell damage induced by PA at 24 h stimulation time.*P<0.05,**P<0.01vs0 mmol·L-1group. B: Time-dependent cell damage induced by PA at 0.4 mmol·L-1concentration.*P<0.05,**P<0.01vs0 h group. C: Viability of cells treated with varied drugs (culture time: 24 h).*P<0.05vscontrol group;#P<0.05,##P<0.01vsPA group.
2.2 白藜芦醇对高脂诱导的H9c2细胞内氧化应激水平的影响如Fig 2、Fig 3A所示,0.4 mmol·L-1PA刺激24 h后,细胞内ROS的红色荧光强度及用流式细胞仪检测的细胞内ROS的水平均出现高表达状态(P<0.05),而预处理白藜芦醇组可以明显降低心肌细胞内高脂诱导的ROS产生(P<0.05)。如Fig 3B、3C所示,0.4 mmol·L-1PA刺激24 h 后,细胞内MDA的水平明显升高(P<0.05),而细胞内SOD的水平明显降低(P<0.05);白藜芦醇预处理组可以明显降低心肌细胞内高脂诱导的MDA产生(P<0.05),并升高SOD水平。

Fig 2 Effect of resveratrol on PA-induced cardiomyocyte oxidative damage (scale bar: 50 μm)


Fig 3 Level of major biochemical parameters of H9c2 cells treated with PA alone or combination of PA and resveratrol for 24 h n=3)
A: The level of ROS was determined by flow cytometry; B: MDA levels in cells; C: SOD activity in cells.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsPA group.
2.3 白藜芦醇对高脂诱导的H9c2细胞AMPK/mTORC1/p70S6K信号通路蛋白及凋亡蛋白表达的影响如Fig 4A所示,用含0.4 mmol·L-1PA的DMEM培养基刺激H9c2心肌细胞24 h时,p-AMPKα表达明显下降(P<0.05),而p-mTORC1、p-p70S6K蛋白表达明显升高;预处理白藜芦醇组可以明显逆转心肌细胞内高脂诱导的p-AMPKα蛋白的降低以及p-mTORC1、p-p70S6K蛋白表达的升高(P<0.05)。如Fig 4B所示,用含0.4 mmol·L-1PA的DMEM培养基刺激H9c2心肌细胞24 h时,Bcl-2水平明显下降(P<0.05),而Bax、cleaved caspase-3表达均明显升高(P<0.05)。而预处理白藜芦醇组可以明显逆转心肌细胞内高脂诱导的Bcl-2蛋白表达的降低以及Bax、cleaved caspase-3蛋白表达的升高(P<0.05)。
3 讨论
糖尿病性心肌病的危险因素包括高糖化血红蛋白、肥胖、老年、伴发冠心病、视网膜病变、蛋白尿和白蛋白尿、肾病、长期使用胰岛素治疗以及糖尿病病程等。研究显示,糖尿病患者的心衰发病率明显高于对照组,心衰是仅次于外周血管病的第二大糖尿病心血管并发症。糖尿病心肌病的病因复杂,随着对糖尿病的深入研究,发现脂毒性是糖尿心肌病发病的重要原因之一[4]。当机体营养过剩时,脂肪细胞增大,且功能出现异常,对胰岛素抗脂解作用减弱,导致游离脂肪酸增多;其次,增大的脂肪细胞降低了储脂能力,一旦脂肪的量大于储备能力时,多余的甘油三酯就会分流到肝脏、肌肉以及胰岛细胞,从而引发外周胰岛素抵抗和胰岛素分泌功能障碍,这就是所谓的脂肪分存及脂毒性。脂毒性不仅影响肝脏、肌肉和胰岛细胞,对机体其他的重要组织也有影响,其中对心脏功能的危害性最大。近年来发现,在血糖升高的胰岛素抵抗阶段,患者的心脏功能已经受到损害。动物实验也证实,高游离脂肪酸血症和高甘油三酯血症可以导致心肌脂质沉积、心室壁增厚、心室重构、心脏收缩功能降低。本研究结果显示,不同浓度的PA刺激心肌细胞时,细胞存活率呈浓度梯度下降趋势,符合文献报道;而白藜芦醇预处理可以明显减轻高脂对心肌细胞存活率的影响。
脂毒性心肌病发病机制复杂,与多条信号通路相关,尤其是AMPK相关通路已成为近年来的研究热点[5]。机体存在氧化-抗氧化的平衡机制,SOD作为体内重要的抗氧化物酶亦释放增多,用以清除体内过度释放的自由基,减少细胞膜的损伤。因此,MDA常被用于间接反映机体的氧化损伤,而SOD反映抗氧化能力。基于此,我们检测了心肌细胞内ROS的生成和MDA、SOD的水平,发现高脂刺激心肌细胞24 h后,心肌细胞内ROS的含量及MDA含量均明显升高,SOD活性明显降低,而白藜芦醇预处理可以明显逆转高脂诱导的上述指标的变化。提示白藜芦醇可以明显抑制高脂诱发的细胞内氧化应激。
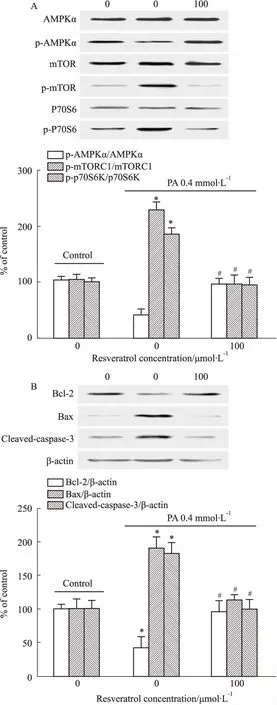
Fig 4 Effect of resveratrol on expression of AMPK/mTORC1/ p70S6K pathway-related proteins(A) and apoptosis-related proteins(B) in cardiomyocytes induced by PA n=3)
*P<0.05vscontrol group;#P<0.05vsPA group
AMPK是重要的能量传感器,有研究发现,在肥胖和2型糖尿病患者的骨骼肌组织中,AMPK活性和PGC-1α表达量明显降低,而激活AMPK后,PGC-1α的表达量随之增高,胰岛素的敏感性也随之增高[10]。因此,寻找AMPK的激活剂对慢性病的防治具有重要的意义。mTORC1是AMPK信号通路下游分子之一[11-12],AMPK磷酸化被激活后,可通过抑制mTORC1的磷酸化来抑制心脏肥大,而心脏肥大是肥胖和高脂饮食导致心机重构的重要特征之一[13]。反之,激活的mTORC1可通过S6K1激活SREBP1,从而加重心肌损伤[14-15]。p70S6K是S6K1的同源异构体,也是mTORC1信号的下游特异性蛋白。由此认为,AMPK磷酸化的抑制、mTORC1及p70S6K磷酸化的增强,可成为脂毒性心肌细胞损伤的机制之一。在本研究中,我们发现高脂刺激心肌细胞24 h后,心肌细胞内p-AMPKα的表达明显降低,p-mTORC1及p-p70S6K蛋白的表达明显升高,而白藜芦醇预处理可以明显逆转高脂所致的p-AMPKα蛋白的表达降低及p-mTORC1、p-p70S6K蛋白的表达升高。这些结果表明白藜芦醇可以调控细胞内AMPK/mTORC1/p70S6K信号通路,保护心肌细胞出现脂毒性损伤。
脂毒性造成的心肌损害增加心肌细胞凋亡,使细胞活性降低,数量减少,最终导致心肌功能障碍。本研究数据显示,PA刺激H9c2心肌细胞,抗凋亡蛋白Bcl-2的表达降低明显,而促凋亡蛋白Bax和cleaved caspase-3的表达明显升高。提示PA可以导致心肌细胞出现明显的凋亡现象,而白藜芦醇预处理可以明显逆转高脂所致抗凋亡蛋白表达的降低和促凋亡蛋白表达的升高。
综上所述,心肌细胞给予高脂刺激能够抑制细胞的增殖,并且会导致细胞内氧化应激水平的增加,调控心肌细胞内AMPK通路,从而促进细胞凋亡。白藜芦醇可以有效恢复细胞增殖率,降低氧化损伤,最终减少细胞凋亡,起到保护心肌细胞的作用,其分子机制与AMPK/mTORC1/p70S6K信号通路的调控密切相关。