Urocortin对糖尿病心肌病的保护作用与Akt/GSK-3β信号通路的关系
刘新宇,刘春娜,李思璇,郑 晨,刘婉珠
(锦州医科大学1. 附属第一医院内分泌科、2. 基础医学院药理学教研室,辽宁 锦州 121001)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病(diabetes mellitus,DM)最为常见和严重的慢性并发症之一,其发病率与DM的病程高度相关。大量的研究发现,病史5年的DM患者,其DCM的发生率约为44.4%,8年升高至56%。并且DCM目前已经成为DM患者的主要致死原因之一[1]。研究发现,在长期处于高糖状态下,DM患者的心肌细胞内的糖、脂及蛋白质代谢发生紊乱,进而引起心肌细胞、血管内皮等组织的损伤,最终导致心肌细胞肥大、坏死、心肌间质纤维化等病理学改变[2]。DCM的发病机制目前仍尚不明确,但新近的研究发现,炎性细胞因子转化生长因子β1(transforming growth factor β1,TGF-β1)和结缔组织生长因子(connective tissue growth factor,CTGF)可能在DCM发生及发展中起着重要作用[3]。因此,寻求DCM的治疗药物,已经成为目前研究的热点。然而,国内外尚无安全有效的治疗药物。
研究发现,内分泌-血管活性肽Urocortin(UCN)在多种心血管疾病中发挥治疗和保护作用。UCN是广泛分布于下丘脑、垂体及多种外周器官的神经内分泌活性肽[4]。UCN通过自分泌或旁分泌作用,具有多种生理及药理作用。业已证明,UCN能降低自发性高血压大鼠的血压,具有类似钙通道阻断剂的扩张冠脉血管的作用,并在动脉粥样硬化和心肌缺血/再灌注损伤中发挥重要作用。新近研究也提示,UCN可能在DCM中同样发挥保护作用,能降血压,并且能预防或逆转心肌的病理性重构[5],但具体作用及机制未见报道。因此,本研究采用DCM大鼠,探讨UCN对DCM大鼠心肌细胞内炎性细胞因子,如TGF-β1和CTGF水平的影响,进一步探讨UCN对DCM保护作用与蛋白激酶B/糖原合成酶激酶3β(Akt/GSK-3β)信号通路的关系,为UCN成为DCM有效治疗药物提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物 ♂健康Wistar大鼠,50只,体质量(250~300) g,18~20周龄,由上海实验动物中心提供,动物合格证号:SCXK(辽) 2007-0009。饲养条件:温度(20~24) ℃,湿度45%±5%,有充分光照及通风条件,大鼠每笼10只。
1.1.2药物与试剂 Urocortin、Astressin、Triciribine,均购自美国Sigma公司;链脲佐菌素,购自北京博爱港商贸中心;TGF-β1单克隆抗体、p-Akt(Ser473)、Akt、p-GSK-3β(Ser9)、GSK-3β抗体,均购自武汉博士得生物工程有限公司;兔抗鼠CTGF单克隆抗体,购自碧云天生物试剂公司。
1.1.3仪器 AccuCheck血糖检测仪(德国罗氏公司);IX70型倒置显微镜(日本Olympus公司);LEICA-RM2135石蜡切片机(德国莱卡公司)。
1.2 动物造模及实验分组选取40只Wistar大鼠,尾静脉注射链脲佐菌素(streptozotocin,STZ)55 mg·kg-1(溶于新鲜配制的0.1 mol·L-1,pH 4.3的柠檬酸钠缓冲液中),连续给药3 d,诱导DM模型建立。以空腹血糖≥16.7 mmol·L-1,尿糖++++,有多饮、多食、多尿症状的大鼠视为DM大鼠造模成功,每周监测尿糖、血糖以及体质量变化。将实验动物随机分为5组,每组10只大鼠,包括:①空白对照组(Control),Wistar大鼠给予生理盐水1 mL·kg-1·d-1;②DCM组,DM大鼠给予生理盐水1 mL·kg-1·d-1;③UCN组,DM大鼠给予UCN 10 μg·kg-1·d-1;④UCN与Astressin(CRH-R2阻断剂)组(UCN+AST),DM大鼠给予UCN 10 μg·kg-1·d-1和Astressin 30 μg·kg-1·d-1;⑤UCN与Triciribine(Akt阻断剂)组(UCN+TRI),DM大鼠给予UCN 7 μg·kg-1·d-1和Triciribine 0.5 mg·kg-1·d-1。上述各组实验动物均饲养12周后给药,给药途径为腹腔注射,持续给药4周。
1.3 大鼠一般状态、体质量及血糖、尿糖的观察实验期间均不禁食,自由活动,予以充足水及食物。各组实验动物在16周后,用代谢笼收集各组大鼠当日尿量,测定尿糖。每2周测定各组大鼠体质量变化和尾静脉采血监测血糖。
1.4 ELISA法测定血清中TGF-β1和CTGF的水平16周后,20%乌拉坦(1 g·kg-1)麻醉大鼠,成功后每只颈动脉取血2 mL,分别置于EP管中,3 500 r·min-1离心5 min,取上清。ELISA法测血清TGF-β1和CTGF水平。
1.5 大鼠心肌细胞形态学观察血清TGF-β1和CTGF水平测定结束后,将各组实验动物手术打开胸腔,取出心脏,制备心肌组织石蜡切片,苏木素-伊红(HE)染色,在光镜下观察大鼠心肌病理学改变,以确定DCM模型成功。
1.6 Western blot法测定心肌组织TGF-β1、CTGF、Akt、p-Akt、GSK-3β和p-GSK-3β的蛋白表达将每组心肌组织(保存于-80 ℃)各取100 mg,置于5个EP管中,每个EP管各加入裂解液200 μL。剪碎心肌组织后超声粉碎,12 000 r·min-1离心30 min后取上清。应用牛血清白蛋白作为对照,计算各组蛋白含量。上样后,SDS-聚丙烯酰胺凝胶电泳,半干法将蛋白质转移至PVDF膜,封闭2 h后,置于一抗中4 ℃孵育过夜。次日TBS冲洗3次(每次4 min),置于辣根过氧化物酶标记的二抗中,室温孵育1 h,TBS洗膜3次(每次4 min),将膜置于显色剂中,避光显色3~5 min后拍片,自动分析凝胶图像的软件计算蛋白量。
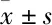
2 结果
2.1 血糖、尿糖及体质量的改变Tab 1结果显示,Control组大鼠血糖(blood glucose,BG)波动在3~6 mmol·L-1之间,尿糖(urinary glucose,UG)阴性(-)。DM大鼠成模后,血糖均超过16.5 mmol·L-1,24 h尿量(urine volume,UV)增多,尿糖均+以上。各组DM大鼠体质量(body weight,BW)均明显下降(P<0.01)。与DCM组相比,UCN组大鼠体质量增加,差异具有显著性(P<0.01)。UCN组大鼠血糖和尿糖虽高于Control组,但与DCM组相比,尿糖有所降低(P<0.05)。UCN组及各实验组血糖与DCM组相比,没有明显下降。

Tab 1 Influences of UCN on blood glucose, urine glucose, urine volume, body weight in DCM
**P<0.01vscontrol;#P<0.05,##P<0.01vsDCM
2.2 UCN对血清TGF-β1和CTGF的影响如Fig 1所示,与Control组相比,其它各组大鼠血清TGF-β1和CTGF水平均明显升高(P<0.05);与DCM组相比,UCN组大鼠血清TGF-β1和CTGF水平明显下降(P<0.05)。UCN+AST组大鼠血清TGF-β1、CTGF水平与DCM组相比,差异无显著性(P>0.05)。
2.3 UCN对大鼠心肌组织病理形态的影响如Fig 2所示,Control组大鼠心肌细胞形态正常,间质未见明显改变;DCM组大鼠心肌细胞肥大、变性、心肌胶原纤维排列紊乱、炎性细胞浸润,出现坏死,符合DCM病理改变;与DCM组相比,UCN组大鼠心肌病理损伤明显减轻,细胞排列较整齐,有少量炎性细胞浸润;与UCN组相比,UCN+AST和UCN+TRI组大鼠心肌细胞损伤较为明显,心肌细胞肥大,胶原增生、细胞排列紊乱。
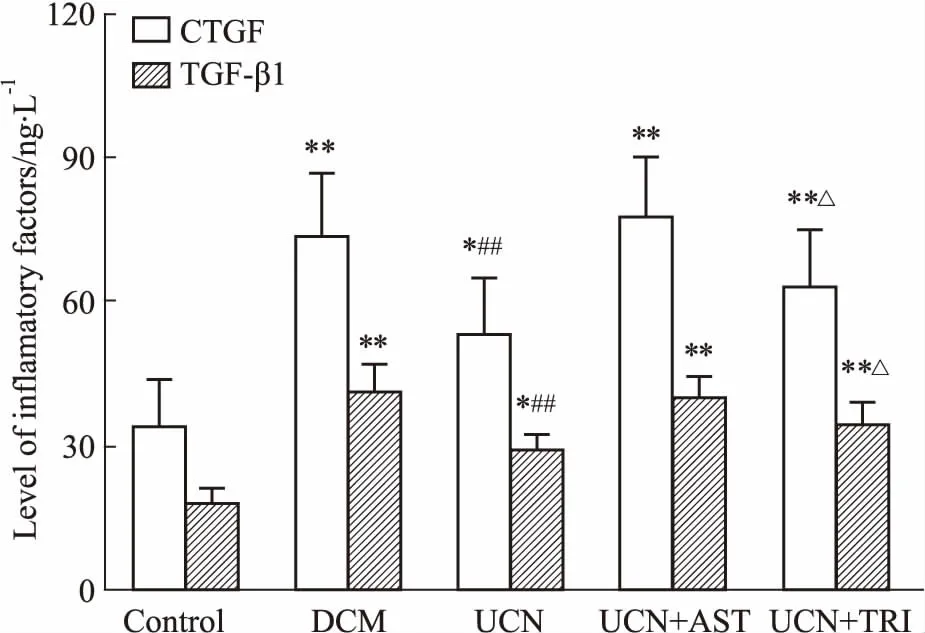
Fig 1 Effects of UCN on TGF-β1 and CTGF in plasma

*P<0.05, **P<0.01vscontrol;##P<0.01vsDCM;△P<0.05vsUCN

Fig 2 Effects of UCN on pathological morphology of myocardial tissue in rats(HE staining×100)
A: Control group; B: DCM group; C: UCN group; D: UCN+Astressin group; E: UCN+Triciribine group.
2.4 UCN对心肌组织TGF-β1和CTGF表达的影响如Fig 3所示,与Control组相比,DCM组大鼠心肌组织TGF-β1和CTGF表达水平明显升高(P<0.01);与DCM组相比,UCN组大鼠心肌组织TGF-β1和CTGF的表达水平明显下降(P<0.05);与DCM组相比,UCN+AST组大鼠心肌组织TGF-β1和CTGF表达水平差异无显著性(P>0.05)。

Fig 3 Effects of UCN on TGF-β1 and CTGF expression

*P<0.05,**P<0.01vscontrol;##P<0.01vsDCM;△P<0.05vsUCN
2.5 UCN对心肌组织Akt、p-Akt、GSK-3β和p-GSK-3β蛋白表达的影响如Fig 4所示,与Control组相比,DCM组大鼠心肌组织p-Akt和p-GSK-3β表达水平明显降低(P<0.01);与DCM组相比,UCN组大鼠心肌组织p-Akt和p-GSK-3β的表达水平明显升高(P<0.05)。UCN+AST组大鼠心肌组织p-Akt和p-GSK-3β表达水平与DCM组相比,差异无显著性(P>0.05)。
3 讨论
本实验中,DM大鼠饲养16周后,三多一少症状明显,死亡鼠增加,出现白内障、失明等情况,表明DM大鼠出现微血管并发症,提示DM大鼠可能发生DCM病变。HE染色显示:DM大鼠心肌细胞肥大坏死,心肌肌原纤维不规则排列,出现炎性细胞浸润,成功制备DCM模型。DCM是独立的心脏病变,其发病机制可能包括物质能量代谢障碍、心肌间质纤维化、心脏副交感神经调节受损及心脏微小血管病变等。DCM尚无有效的防治方法,控制血糖、血压、血脂及改善心脏功能是目前主要的治疗原则。
在实验中,我们发现DCM组大鼠血清及心肌组织中TGF-β1和CTGF水平明显升高,UCN能明显降低DCM组大鼠血清及心肌组织中的TGF-β1和CTGF水平。CTGF是一种由349个氨基酸组成的富含半胱氨酸的肝素结合肽,目前已证明,心脏、肺脏、肝脏、肾脏和结缔组织中广泛地存在CTGF的表达[6]。多种脏器的纤维化与CTGF在该脏器的高表达密切相关,并能触发与纤维化有关的,如细胞增殖、黏附、迁移和细胞外基质合成等细胞变化,长期过度表达能明显促进纤维化的发生和发展[7]。多种细胞因子可以调控CTGF的表达,其中TGF-β1是诱导CTGF表达的最为重要的因素之一[8]。TGF-β1对细胞生长分化、细胞外基质沉积具有潜在作用,是体内最有力的促纤维化生长因子之一,是促进肺脏、肝脏、肾脏等多种脏器纤维化的关键因子之一[9]。TGF-β1反应元件存在于CTGF基因启动子序列中,调控成纤维细胞中CTGF的表达[10]。在DCM发生、发展中,TGF-β1和CTGF起着非常重要的作用[11]。活化的TGF-β1促进纤维细胞合成胶原纤维、纤维黏连蛋白和蛋白多糖,加剧组织纤维化;活化的TGF-β1还能诱导蛋白水解酶抑制物的合成,抑制蛋白水解酶的表达,并且抑制纤溶酶原、胶原酶、基质酶酶原激活物的产生。DM大鼠心室肌细胞CTGF表达明显增加,并随病程持续升高,细胞外基质蛋白合成加速,成纤维细胞合成胶原蛋白增加,心肌细胞肥大[12]。肥厚和纤维化的心肌组织中TGF-β1表达明显增多,其可促进心肌细胞肥大,刺激成纤维细胞分泌胶原增多,促进细胞外基质的合成,抑制其降解[3]。本实验发现,与DCM组相比,UCN组大鼠血清及心肌组织中的TGF-β1和CTGF水平明显下降,提示UCN可通过降低DCM大鼠TGF-β1和CTGF水平,抑制致心肌纤维化的重要炎症因子的生成,最终对DCM起治疗作用。
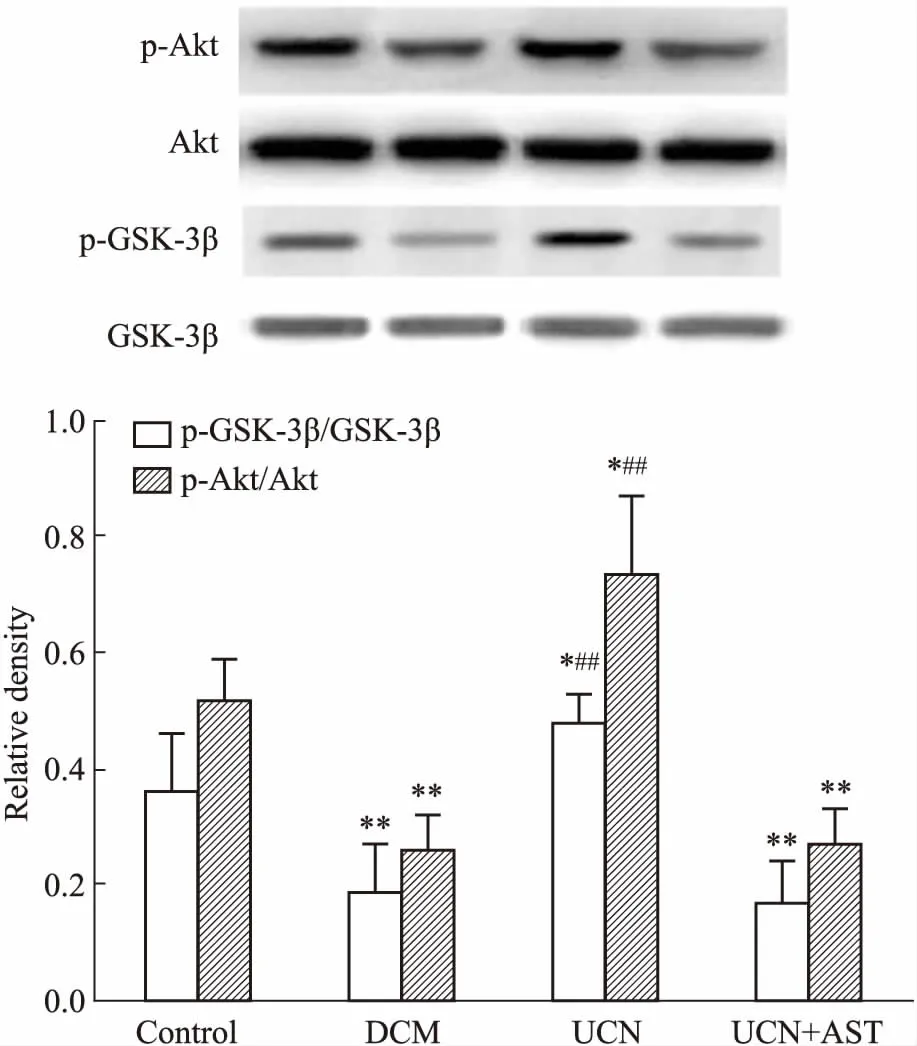
Fig 4 Effects of UCN on p-Akt/Akt and p-GSK-3β/GSK-3β

*P<0.05,**P<0.01vscontrol;##P<0.01vsDCM
实验中发现,DCM组大鼠心肌组织p-Akt和p-GSK-3β表达水平明显降低,给予UCN后,p-Akt和p-GSK-3β的表达水平明显升高。Akt是磷脂酸肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)下游的重要信号分子,参与调节细胞的分裂、分化、生长、代谢以及凋亡等一系列生理及病理过程[13]。GSK-3β是Akt重要的下游底物之一,活化的Akt能与GSK-3β结合,诱导GSK-3β向细胞膜转位,磷酸化其N端的Ser9活性位点,并使之失活[14]。Akt/GSK-3β通路受损与胰岛素抵抗相关性疾病,如2型DM、糖尿病肾病、心血管疾病等密切相关[15]。在本实验中,DCM大鼠心肌细胞p-Akt和p-GSK-3β表达明显降低,表明Akt/GSK-3β信号通路参与了DCM的发生、发展,UCN能明显增强DCM大鼠心肌组织p-Akt和p-GSK-3β的表达,提示UCN对DCM的保护及治疗作用与Akt/GSK-3β信号通路关系密切。
在实验中,我们发现UCN能明显抑制DM大鼠心肌细胞TGF-β1和CTGF的表达,激活Akt/GSK-3β信号途径。此外,UCN对高血糖导致的心肌损害的保护作用能被CRH-R2阻断剂(Astressin)所抑制,Akt阻断剂(Triciribine)也部分抑制UCN对DCM的作用,UCN促Akt和GSK-3β磷酸化的作用也被Astressin抑制。UCN主要与CRH-R结合后发挥生物学作用[16]。UCN具有强大的心血管保护作用,能抑制心肌缺血/再灌注所导致的心肌细胞凋亡;扩张冠状动脉,保证心肌自身的血液供应,逆转心肌缺血导致的心肌坏死[17]。以上结果提示,UCN对DCM心肌的保护作用可能通过CRH-R2介导激活Akt/GSK-3β信号通路实现的。
综上所述,UCN对DCM具有保护作用,其机制可能与UCN磷酸化Akt和GSK-3β,激活Akt/GSK-3β信号通路,抑制TGF-β1和CTGF的表达有关,但具体机制仍有待进一步的探究。