巨自噬与分子伴侣介导的自噬在饥饿诱导的Raji细胞中相继顺序被激活
李彩丽,辛 英,魏虎来,陈 静,王 蓓,李 敏
(1.西北民族大学医学院,甘肃 兰州 730030;2.兰州大学基础医学院,甘肃省新药临床前研究重点实验室,甘肃 兰州 730030)
自噬是进化上高度保守的溶酶体降解途径,当细胞在营养缺乏、缺氧、药物等环境因素的影响下,细胞溶酶体对其内部的细胞器、大分子物质等内容物进行“自我消化”的过程。细胞自噬所产生的物质可以被细胞重新利用,以维持其生命活动[1]。自噬根据其发生的过程和降解底物的不同,分为巨自噬、分子伴侣介导的自噬和微自噬3种类型。巨自噬广泛存在于真核细胞中,它的产生需要多种自噬相关基因参与,形成双层膜结构的吞噬泡,吞噬泡包裹细胞内的可溶性蛋白和细胞器形成自噬体,继而与溶酶体融合,将其内容物进行降解加工[2-3]。分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)是细胞自噬的一种特殊形式,也是哺乳动物所特有的自噬途径。CMA的发生需要胞质内热休克蛋白Hsc70与底物分子的特异氨基酸序列(如KFERQ-样模体)识别结合,结合形成的复合物能被溶酶体相关膜蛋白(LAMP-2a)所识别,在溶酶体腔内Hsc70的介导下,使底物去折叠并转位至溶酶体内进行降解[4-5]。Cuervo等[6-7]的研究表明,动物禁食3 d后,细胞内CMA活性会明显提高,胞质内含有KFERQ信号肽序列的蛋白质明显减少。这说明细胞在饥饿的不同阶段所选择的自噬途径不同,它们顺序被激活后,在功能上相互协调补充,共同参与细胞内容物的降解,从而维持细胞的生命活动。然而,这种现象在肿瘤细胞中是否依然存在,目前尚无相关报道。本研究以Burkitt淋巴瘤Raji细胞为研究对象,旨在观察体外培养的肿瘤细胞在饥饿诱导的不同阶段,细胞巨自噬与CMA活性的变化情况,阐明巨自噬与CMA之间的关系,从而探索它们各自在肿瘤细胞应对压力刺激时的作用。
1 材料与方法
1.1 细胞株Burkitt淋巴瘤Raji细胞,购自中国科学院上海细胞生物学研究所。
1.2 试剂D-Hanks液(索莱宝公司);蛋白提取及定量试剂盒(碧云天公司);单丹黄酰尸胺(monodansylcadaverine,MDC)(Sigma公司);Hsc70一抗,Apitomics公司;LC3-Ⅰ/Ⅱ、Beclin-1、β-actin一抗,均购自CST公司; 溶酶体相关膜蛋白-2a(lysosome-associated membrane protein-2a,Lamp-2a)一抗,购自Abcam公司;红外荧光标记的二抗,购自美国LI-COR公司。
1.3 仪器CO2细胞培养箱(日本三洋公司);荧光显微镜(日本OLYMPUS公司);红外荧光扫描成像系统(美国LI-COR公司);激光共聚焦显微镜(德国Leica公司)。
1.4 方法
1.4.1细胞培养与处理 采用D-Hanks缓冲液代替细胞培养液,饥饿诱导对数生长期的Raji细胞,分别收集饥饿诱导0、3、6、9、12 h的细胞进行检测。
1.4.2MDC荧光染色观察自噬体 在饥饿诱导不同时间的Raji细胞中,加入MDC贮存液,使其终浓度达到0.05 mmol·L-1,37 ℃避光孵育30 min,PBS洗涤2次,滴片,用激光共聚焦显微镜和荧光显微镜分别观察细胞内自噬体的形成。
1.4.3Western blot法检测Beclin-1、LC3-Ⅰ/Ⅱ、Hsc70和Lamp-2a蛋白的表达 分别收集对照组以及饥饿诱导不同时间的Raji细胞,PBS洗涤,RIPA裂解液抽提细胞总蛋白,BCA试剂盒定量测定蛋白质浓度,加入5×上样缓冲液并混匀,每个样品取50 μg蛋白质上样,SDS-PAGE电泳分离,转膜、封闭,加入一抗室温孵育1~2 h,洗涤后,加入二抗室温孵育2 h,洗涤,用Odyssey红外荧光扫描仪扫描并分析结果,每个实验重复3次。
1.4.4统计学分析 实验数据采用SPSS 13.0软件进行分析处理,组间比较采用t检验。
2 结果
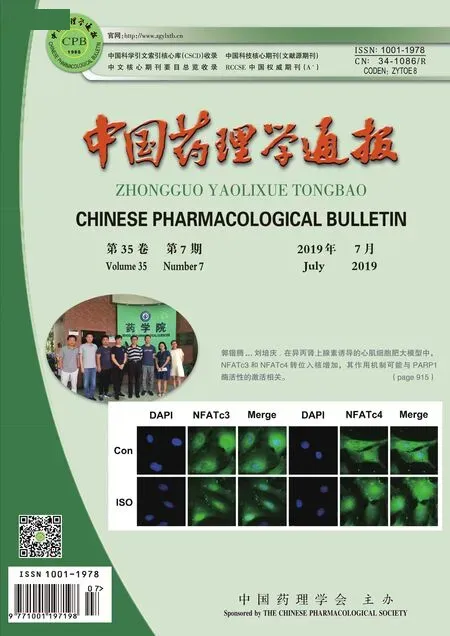
2.1 饥饿诱导不同时间Raji细胞巨自噬活性的改变采用D-Hanks缓冲液代替培养液饥饿诱导Raji细胞0~12 h,MDC染色后,分别用激光共聚焦显微镜和荧光显微镜观察Raji细胞内自噬体的形成情况。如Fig 1所示,在饥饿诱导的最初几小时,MDC荧光强度逐渐增加,在6 h达到峰值,随后逐渐下降到基础水平。
2.2 饥饿诱导不同时间巨自噬相关蛋白的表达水平Western blot检测饥饿诱导不同阶段,Raji细胞内巨自噬标志性蛋白LC3-Ⅰ/Ⅱ和Beclin-1的表达水平。如Fig 2所示,LC3-Ⅱ和Beclin-1的表达水平在饥饿诱导的最初几小时均逐渐升高,6 h时达到峰值,随后又逐渐下降。
2.3 饥饿诱导不同时间细胞内CMA相关蛋白的表达水平Hsc-70和Lamp-2a是参与CMA的两种重要物质,分子伴侣Hsc70能特异性识别带有KFERQ序列的底物蛋白,促进底物去折叠并与LAMP-2a结合,继而进入溶酶体腔被降解[8-9]。因此,Hsc70和LAMP-2a是检测CMA活性的重要标志物。Western blot检测饥饿诱导0~12 h细胞内CMA的水平,发现Hsc-70和Lamp-2a的表达并未像巨自噬那样在饥饿诱导的早期(3~6 h)明显升高,而是在饥饿诱导6 h之后才明显增高,12 h时达到峰值(Fig 3)。
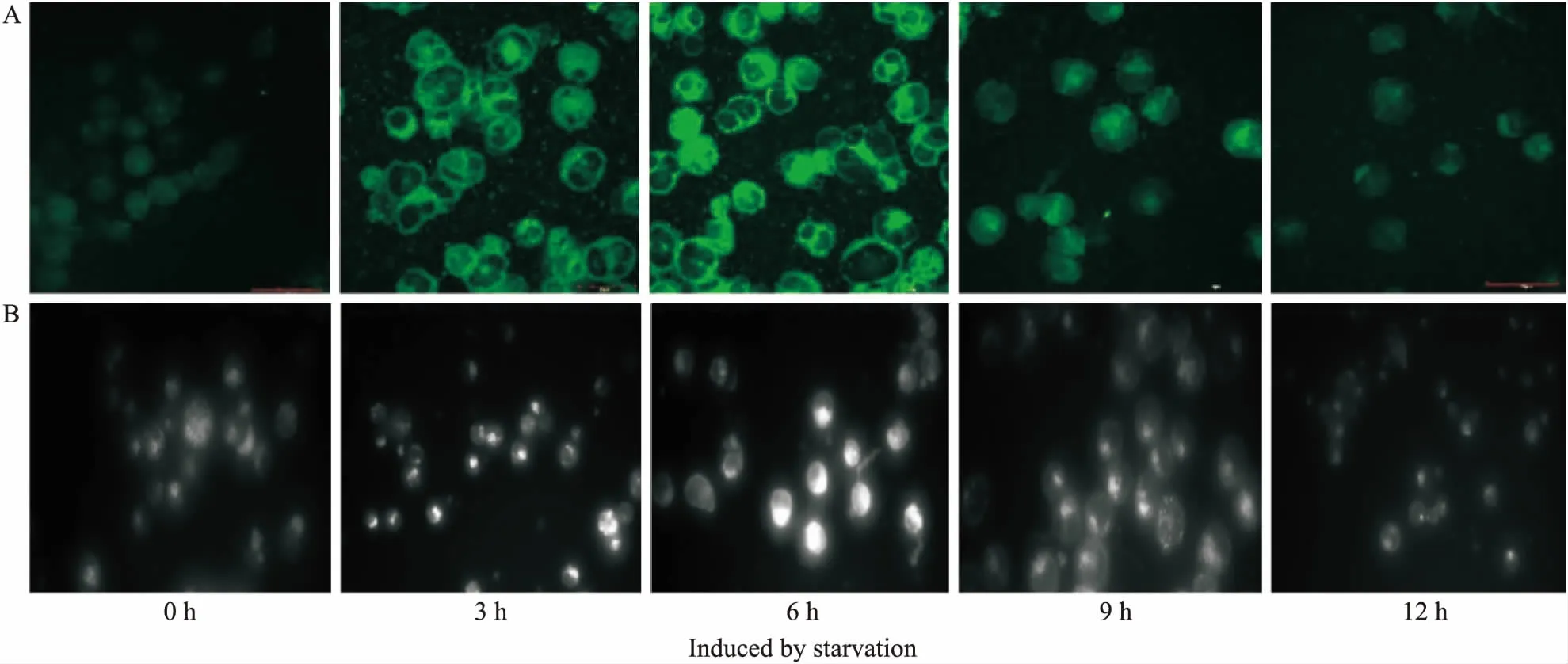
Fig 1 The fluorescence intensity of MDC in Raji cells induced by starvation(×100)
A:Detection results of confocal laser-scanning microscopy;B: The fluorescence intensity of MDC was analysed by fluorescence microscopy.
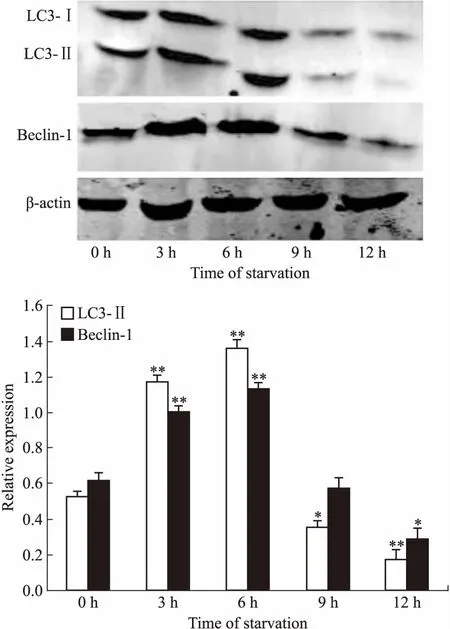
Fig 2 Macroautophagy-related protein expression in starvation-induced Raji cells
*P<0.05,**P<0.01vscontrol group(0 h)
3 讨论
CMA与巨自噬作为细胞自噬的两种不同类型,其在肿瘤治疗中的作用越来越受到人们的关注。尽管它们在发生的先后顺序、对底物的选择性以及调控机制等很多方面不同,然而它们在维持机体内环境稳定方面却有着紧密的联系。有研究发现,巨自噬与CMA在正常细胞中存在相互协调补充的关系,即当巨自噬活性下降或被抑制时,CMA就会被活化,从而补偿巨自噬的部分功能[10-13],这说明它们并非独立存在的两条途径,而是存在着必然的联系。然而,这种现象是否在肿瘤细胞中依然存在,目前尚无相关报道。
本研究通过饥饿诱导Burkitt淋巴瘤Raji细胞,观察细胞内巨自噬和CMA活性的变化,探究肿瘤细胞受到压力刺激时,巨自噬与CMA之间的关系。本研究发现,Raji细胞在D-Hanks缓冲液中分别培养0、3、6、9、12 h,细胞巨自噬活性在饥饿初期(3~6 h)迅速增加并达到峰值,与对照组(0 h)相比较,胞质内MDC染色阳性的自噬体数量,以及LC3-Ⅱ和Beclin-1表达水平在饥饿6 h时均达到高峰,与此相反,CMA相关分子Hsc70和LAMP-2a的表达水平在此时并未见明显上调。然而,随着饥饿时间的延长,细胞巨自噬活性逐渐降低,并伴随出现CMA活性的逐渐增加,当饥饿12 h时,巨自噬活性基本达到对照组细胞水平,而CMA活性此时却达到了峰值。由此证明,巨自噬是细胞应对饥饿这种压力刺激时的一种快速而短暂的反应,细胞首先通过巨自噬降解胞质内生物大分子,实现物质的循环再利用,为处于饥饿状态的细胞提供首批氨基酸和能量等,以维持生存的需要。随之巨自噬水平的降低可有效避免一些重要蛋白质的非选择性和无序性降解,与此同时,CMA的活化通过选择性降解一些非必需的蛋白质,进一步为细胞生存提供能源物质。
Fig 3 CMA-related protein expression in starvation-induced Raji cells
*P<0.05,**P<0.01vscontrol group(0 h)
本研究证实,Burkitt淋巴瘤Raji细胞在接受饥饿刺激时,巨自噬与CMA之间存在相互协调和补充的关系,它们并非同步而是相继被激活,巨自噬的发生先于CMA,高巨自噬水平会抑制CMA的活化,只有当巨自噬水平下降时,才会出现CMA活性的增加。这一发现将有助于更好地理解肿瘤细胞中不同自噬途径的特点、相互之间的关系,以及在应对压力刺激时的应答机制。