天然二萜衍生物Jar-TTA双重抑制糖酵解及氧化磷酸化诱导食管癌细胞凋亡
范霞霞,苏 楠,黄晓婧,李亚飞,贾 奥,樊济配,王爱凤,,赵宁民,马永成,
(1. 郑州大学人民医院药学部临床药理室,河南 郑州 450003;2. 阜外华中心血管病医院药学部临床药理室,河南 郑州 451464;3. 河南牧业经济学院食品与生物工程学院,河南 郑州 450011)
食管癌恶性程度高,临床中多进行手术、放化疗等综合治疗手段,但由于其复发及转移特性,目前死亡率仍然较高。据《2017中国肿瘤登记年报》,全国范围内食管癌发病率及死亡率均居前五位。由此可见,研发新的高效、低毒的抗食管癌药物仍然十分迫切。天然对映贝壳杉烷型二萜具有广泛的生物活性,例如抗炎、抗菌、抗病毒、抗肿瘤等,是很有潜力的先导化合物[1]。以往的报道已表明该类化合物具有广谱的体外抗肿瘤活性,但体内活性研究多采用联合用药,以增加现有化疗药物的敏感性,缺乏直接的效果。因此,研究人员对该类天然二萜结构做了大量的改造工作[2],以期获得活性更高、毒性更低、性质更为稳定的抗肿瘤候选药物。本课题组以天然贝壳杉烷型二萜Jaridonin[3]为先导,利用“药物拼合原理”引入了三氮唑活性结构单元,得到了活性更好的衍生物Jar-TTA(结构见Fig 1A),其结构新颖、性质稳定,且具有双重抑制糖酵解/氧化磷酸化(oxidative phosphorylation,OXPHOS)的独特功能,国内外尚无任何相关报道,具有开发自主知识产权抗癌药物的重要价值。

Fig 1 Effect of Jar-TTA on EC109 and
A: The molecular structural formula of Jar-TTA; B: Effect of Jar-TTA on cell proliferation. 5-Fuorouracil(5-FU) was used as positive control.**P<0.01vscontrol.1:0.00;2:0.75;3:1.50;4:3.00;5:6.00;6:12.00;7:24.00;8:5-FU 24.00
有氧糖酵解(Warburg效应)被认为是肿瘤代谢的特征,该特征也为肿瘤药物的开发提供了理想靶点,为肿瘤治疗带来希望[4]。然而,现代肿瘤研究已经证明,肿瘤细胞的代谢呈现出明显的异质性及代谢灵活性,糖酵解并不是肿瘤细胞获取能量的唯一方式[5]。当糖酵解受到抑制时,肿瘤细胞可能会切换为氧化磷酸化的代谢模式为其供能,并且在高侵袭性肿瘤中以及肿瘤干细胞中,OXPHOS甚至发挥着主要作用[5-6]。因此,研发具有糖酵解/OXPHOS双重抑制功能的药物是更具潜力的抗肿瘤策略。本实验则以食管癌细胞为模型,深入研究了Jar-TTA双重抑制糖酵解/OXPHOS的作用及可能的分子机制,为新型抗肿瘤药物的开发提供实验依据。
1 材料
1.1 试剂四氮唑蓝(MTT,美国Sigma公司);糖酵解压力检测试剂盒、线粒体压力检测试剂盒,均购自美国Seahorse Bioscience公司;FITC-AnnexinⅤ/PI细胞凋亡检测试剂盒(美国Biovision公司);线粒体荧光染料JC-1和Hoechst 33258,购自江苏碧云天生物技术研究所;荧光葡萄糖类似物2-NBDG为Invitrogen品牌产品;GAPDH抗体(杭州贤至生物科技公司);葡萄糖转运蛋白4(glucose transporter type 4,GLUT4)、乳酸脱氢酶A(lactate dehydrogenase A ,LDHA)抗体,购自美国SAB公司;化学发光检测试剂盒(美国Pierce公司);胎牛血清(FBS,杭州四季青公司);RPMI 1640培养基(美国Gibco公司)。
1.2 化合物二萜衍生物Jar-TTA由郑州大学新药研发中心研制,结构经NMR、MS及IR光谱确证,纯度不小于99%。使用DMSO溶解Jar-TTA,配制成24 mmol·L-1的储备液,-20 ℃分装保存。使用前,储备液至少稀释1 000倍,从而确保培养基中DMSO终含量不超过0.1%,以排除DMSO对细胞生长的影响。
1.3 仪器三气细胞培养箱(美国Thermo Fisher Scientific公司);全波长多功能酶标仪(美国Perkinelmer公司);高速冷冻离心机(德国Eppendorf公司);正置荧光显微镜(日本Nikon公司);生物能量分析仪Seahorse XFp(美国Seahorse Bioscience公司);流式细胞仪(美国BD公司)。
2 方法
2.1 细胞培养人食管癌细胞株EC109和KYSE-150,购自中国科学院典型培养物保藏委员会细胞库,由本实验室传代液氮保存。在37 ℃、5% CO2的培养条件下,使用含有10%胎牛血清、100 g·L-1链霉素和1×105kU·L-1青霉素的RPMI 1640培养液培养上述细胞。
2.2 细胞生存率测定根据文献所述方法[7],接种EC109、KYSE-150细胞,培养贴壁后,加入终浓度为0.75、1.5、3、6、12、24 μmol·L-1的Jar-TTA,作用48 h,每孔加入20 μL MTT溶液(质量终浓度为0.5 g·L-1),培养箱内继续孵育4 h后终止培养,DMSO充分溶解紫色结晶物,使用酶标仪于490 nm处测定吸光度,计算细胞生存率(survival rate)及IC50值。
2.3 线粒体膜电位观察及定量分析细胞接种于6孔板,贴壁培养后,使用0、4、8 μmol·L-1的Jar-TTA分别作用细胞24 h,胰酶消化,EP管离心收集细胞。每管样品加入100 μL JC-1 溶液(质量浓度为10 mg·L-1),于细胞培养箱中孵育20 min,预冷PBS洗涤2次,调整细胞浓度,吸取50~100 μL的待检样品滴至载玻片,加上盖玻片后,荧光显微镜观察并拍照。同时,相同培养条件下,Jar-TTA作用EC109细胞24 h后,离心收集细胞,每管样品加入500 μL上述JC-1溶液,进行同样的染色处理后,通过流式细胞仪每个样品收集10 000个有效细胞,使用Flow Jo软件对线粒体膜电位变化进行定量分析。
2.4 细胞凋亡检测将EC109细胞接种于6孔板,贴壁培养后,0、2、4、8 μmol·L-1的Jar-TTA作用于细胞24 h,离心收集每孔中包括悬浮细胞在内的所有细胞,按照凋亡检测试剂盒说明书进行细胞双染,利用流式细胞仪每个样品收集20 000个有效细胞,使用Flow Jo软件分析凋亡情况。
2.5 能量代谢分析仪检测Jar-TTA对细胞能量代谢的调控作用以每孔7 000个细胞的密度将EC109细胞接种到Seahorse XFp专用板,过夜培养,待细胞进入对数生长期,分别以0、4、8 μmol·L-1Jar-TTA预孵育EC109细胞2 h后,更换能量分析专用培养液,按照糖酵解/线粒体压力试剂盒说明书配制试剂,并实时检测线粒体耗氧率(oxygen consumption rate,OCR)和代表糖酵解的胞外酸化率(extracellular acidification rate,ECAR)。并根据OCR和ECAR值,分别考察Jar-TTA对EC109细胞的基础有氧呼吸(basal respiration)、最大有氧呼吸能力(maximal respiration)、ATP生成(ATP production),以及糖酵解水平(glycolysis)、最大糖酵解能力(glycolytic capacity)的影响。其中,象征线粒体OXPHOS有关参数的计算公式如下:Basal respiration=(第1次注射药物前的最后一个检测值)-(非线粒体呼吸耗氧率);Maximal Respiration=(FCCP注射后最大检测值)-(非线粒体呼吸耗氧率);ATP Pro-duction= (寡霉素注射前最后一个检测值)-(寡霉素注射后最小检测值),具体示意图参见Fig 3B。细胞糖酵解水平有关参数公式:Glycolysis=(寡霉素注射前最大检测值)-(葡萄糖注射前最后一个检测值);Glycolytic Capacity=(寡霉素注射后最大的检测值)-(葡萄糖注射前最后一个检测值),具体示意图参见Fig 4B。检测结束后,收集各孔细胞,利用细胞计数仪进行绝对计数,以每孔10 000细胞标准化OCR和EACAR的测量值。

Fig 2 EC109 cell apoptosis induced by
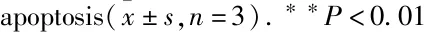
2.6 2-NBDG法检测葡萄糖摄取通过检测2-NBDG荧光强度,评价Jar-TTA对食管癌细胞葡萄糖摄取的抑制作用。EC109细胞接种于6孔板,使用含10% FBS的常规培养基培养过夜,待细胞贴壁后,移除常规培养基,PBS漂洗1次后,使用含0.5% FBS及0、4、8 μmol·L-1Jar-TTA的培养基孵育EC109细胞6 h。小心移除上述培养基,加入100 μmol·L-12-NBDG(使用含0.5% FBS培养基稀释所得),继续培养30 min。胰酶消化,离心收集细胞,置于冰上,使用预冷的PBS洗涤细胞2次,以去除未被细胞摄取的2-NBDG,将收集的细胞悬浮在冷PBS中,通过流式细胞术(488 nm激发,FL1)定量分析各组平均荧光强度。
2.7 Western blot不同浓度的Jar-TTA处理EC109细胞24 h后,将细胞全部离心收集,使用RIPA裂解液裂解细胞,低温离心,吸取上清则为总蛋白,蛋白浓度由BCA法测定。取60~100 μg总蛋白上样,经SDS-PAGE电泳分离后,湿法电转蛋白至硝酸纤维素膜(NC)上,利用5%脱脂奶粉室温封闭2 h,然后一抗室温孵育2 h或4 ℃孵育过夜后,辣根过氧化酶标记的二抗室温下孵育2 h,ECL试剂进行化学发光。胶片于暗室曝光后,扫描并保存结果。
3 结果
3.1 Jar-TTA抑制EC109及KYSE-150细胞的生存不同浓度的Jar-TTA处理食管癌细胞EC109及KYSE-150 48 h后,MTT实验结果显示,Jar-TTA明显抑制了2种食管癌细胞的生长,且具有浓度依赖性(Fig 1B),IC50值分别为(2.61±0.32) μmol·L-1和(4.65±0.55) μmol·L-1。由于EC109对Jar-TTA相对较为敏感,下述实验皆以EC109为细胞模型做进一步研究。
3.2 Jar-TTA诱导EC109凋亡不同浓度Jar-TTA作用EC109细胞24 h后,流式细胞术检测发现,Jar-TTA可明显诱导细胞凋亡的发生(Fig 2A)。Jar-TTA(2、4、8 μmol·L-1)诱导EC109早期凋亡率分别为(27.9±6.1)%、(71.1±9.3)%和(65.0±9.5)%,与正常对照组(5.6±3.2)%相比差异有显著性(P<0.01);另外,晚期凋亡率分别为(6.9±2.5)%、(8.4±3.4)%和(29.8±4.5)%,与对照组晚期凋亡率(0.6±0.3)%相比,差异亦具有显著性(Fig 2B)。使用Jar-TTA在同样的处理条件下,可见细胞凋亡形态上的变化,染色质浓缩、碎裂,凋亡小体形成等典型凋亡状态(Fig 2C),表明Jar-TTA具有诱导细胞凋亡作用。
3.3 Jar-TTA双重抑制EC109细胞糖酵解及线粒体氧化磷酸化ECAR和OCR分别代表了细胞的糖酵解水平和氧化磷酸化活性[8]。如Fig 3A所示,4、8 μmol·L-1Jar-TTA预处理EC109 2 h,明显抑制线粒体的氧化磷酸化功能,并且相对于正常细胞,Jar-TTA预处理细胞基础氧耗率、最大呼吸和ATP产生量均明显降低(P<0.01,Fig 3C、3D)。另外,4、8 μmol·L-1Jar-TTA预孵育EC109细胞2 h,亦可明显抑制细胞糖酵解过程(Fig 4A);如Fig 4C、4D所示,相较于对细胞基础糖酵解水平的抑制,Jar-TTA更为强烈地抑制了EC109细胞的最大糖酵解能力,差异均具有显著性(P<0.01)。上述结果表明,Jar-TTA具有细胞糖酵解及线粒体氧化磷酸化的双重抑制作用。

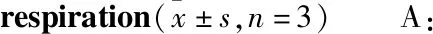

Fig 4 Effect of Jar-AAT in regulating glycolysis of EC109
A: EC109 cells were treated with Jar-AAT at indicated concentrations for 2 h and the dynamics of ECAR were measured; B: Schematic diagram of indexes in overall ECAR curve; C: Basal glycolytic rate of control and Jar-AAT pre-treated cells; D: Cellular glycolytic capacity in EC109 cells with or without Jar-AAT treatment. Glu: glucose; OM: oligomycin; 2-DG: 2-deoxy-D-glucose.*P<0.05,**P<0.01vscontrol
3.4 Jar-TTA降低EC109线粒体膜电位荧光探针JC-1在较高线粒体电位下呈现强的橙色荧光;在线粒体膜电位较低情况下,JC-1则呈现绿色荧光[7]。如Fig 5A所示,相对于正常细胞,4 μmol·L-1的Jar-TTA作用EC109细胞24 h后,橙色荧光相对减弱,并显示了一定量的绿色荧光,提示线粒体膜电位有所下降;8 μmol·L-1Jar-TTA作用EC109细胞24 h后,橙色荧光几乎完全消失,线粒体呈现强的绿色荧光,证明此时线粒体膜电位已崩溃丧失。另外,流式细胞术定量分析发现,4、8 μmol·L-1的Jar-TTA作用下,低线粒体膜电位的细胞比例分别为32.9%和59.1%,与对照组5.0%相比,线粒体膜电位下降的细胞数明显增多(Fig 5B)。这些结果表明Jar-TTA可以致使线粒体膜电位下降,从而诱导细胞线粒体功能损伤,Jar-TTA抑制线粒体氧化磷酸化的作用可能与此有关。
3.5 Jar-TTA抑制EC109细胞的葡萄糖摄取如Fig 6A所示,与正常对照组相比,4、8 μmol·L-1Jar-TTA作用细胞6 h,荧光强度明显左偏,表明Jar-TTA可抑制EC109葡萄糖摄取,且其作用与浓度有关。与空白对照组相比,4、8 μmol·L-1Jar-TTA使EC109细胞的葡萄糖摄取能力分别下降约(45.4±12.8)%和(60.5±9.32)%(P<0.01),见Fig 6B。上述结果提示,Jar-TTA的糖酵解抑制作用和其阻止葡萄糖摄取有关。
3.6 Jar-TTA下调糖酵解相关蛋白Fig 7的Western blot检测显示,与对照组相比,不同浓度的Jar-TTA作用EC109 24 h后,GLUT4及LDHA蛋白表达明显下调,且呈浓度依赖性。该结果表明,Jar-TTA通过下调GLUT4和LDHA蛋白,阻滞了EC109细胞的葡萄糖摄取水平以及抑制了糖酵解进程。

Fig 5 Mitochondriotoxic effects of Jar-AAT in EC109
A: JC-1 fluorescent staining, the drop of MMP in EC109 treated with Jar-AAT at indicated concentrations for 24 h was observed by fluorescence microscopy(×200); B: Representative flow cytometry pictures of EC109 cells treated by 0, 4 and 8 μmol·L-1Jar-TTA for 24 h and the percentages of cells with low MMP were given.
4 讨论
哺乳动物细胞可通过线粒体OXPHOS和糖酵解两种糖代谢方式供应能量ATP。常氧情况下,正常细胞糖代谢主要由线粒体OXPHOS产生ATP以提供代谢活动所需要的能量,但与正常细胞不同,即使在有氧情况下,肿瘤细胞依旧异常活跃地摄取葡萄糖,进行有氧糖酵解(Warburg效应)[9]。长期以来,人们基于肿瘤细胞特有的Warburg效应不仅开发了系列抗肿瘤新化合物,也摸索了多套肿瘤化疗方案,但所得结果不尽相同,喜忧参半[10]。究其原因是因为肿瘤代谢呈异质性,不同肿瘤之间存在明显的代谢差异;即使同一肿瘤的不同细胞之间,也存在明显代谢差异。虽然Warburg效应在肿瘤细胞中表现明显,但线粒体的OXPHOS仍对肿瘤细胞生存起着重要的调节作用,甚至在某些肿瘤中,OXPHOS是主要的供能方式,该类肿瘤细胞则对有氧糖酵解抑制剂并不敏感[11-12]。
近几年,由多个科研团队将糖酵解抑制剂(如2-deoxy-D-glucose)和OXPHOS抑制剂(如线粒体靶向药物Mito-Q或小檗碱)联用,进行肿瘤化疗取得了满意的效果[13-14]。就单个药物同时抑制肿瘤细胞糖酵解和OXPHOS的研究也有报道,Marín-Hernández等[15]研究发现,5 μmol·L-1铜配位化合物(Casiopeina Ⅱ-gly)作用HeLa细胞24 h后,同时抑制了糖酵解(抑制率为40%)和OXPHOS(抑制率为80%),展现了良好的抗肿瘤活性,并具有较好的肿瘤选择性。Zhao等[16]研究也发现,维生素E衍生物ESeroS-GS可通过下调HK2及具有电子传递功能的complex Ⅱ/Ⅲ/Ⅳ等的表达,以及降低线粒体膜电位(mitochondrial membrane potential,MMP),同时抑制了乳腺癌细胞糖酵解和OXPHOS,从而抑制肿瘤细胞的增殖、迁移和侵袭,而对人正常乳腺上皮细胞不产生相应毒性。本研究也证实,Jar-TTA可通过双重抑制糖酵解和OXPHOS,诱导食管癌细胞凋亡。并且Jar-TTA抑制EC109基础呼吸、最大呼吸以及ATP的生成,可能与Jar-TTA降低MMP有关。除诱导MMP下降之外,Jar-TTA是否对线粒体中具有电子传递功能的complex Ⅱ/Ⅲ/Ⅳ也有调控作用则需要进一步研究。
此外,很多研究已经证实,葡萄糖转运体(glucose transporters,GLUTs)在肿瘤细胞中高表达,有效阻止其表达可以从源头阻断原料供应,从而可作为研发糖酵解抑制剂的切入点[17]。另外,在糖酵解过程中,乳酸脱氢酶A(lactic dehydrogenase A,LDHA)是催化丙酮酸和乳酸相互转化的同工酶,在癌细胞中亦高表达,这使得肿瘤细胞能够不受氧气限制,将大多数的葡萄糖转变为乳酸,加速细胞生长和增殖。目前通过抑制LDH-A活性来治疗肿瘤已成为最具吸引力的研究方向[18]。本研究证明,Jar-TTA可明显下调GLUT4和LDHA蛋白的表达,其很可能是Jar-TTA抑制EC109糖摄取、基础糖酵解水平及最大糖酵解能力的根本原因。
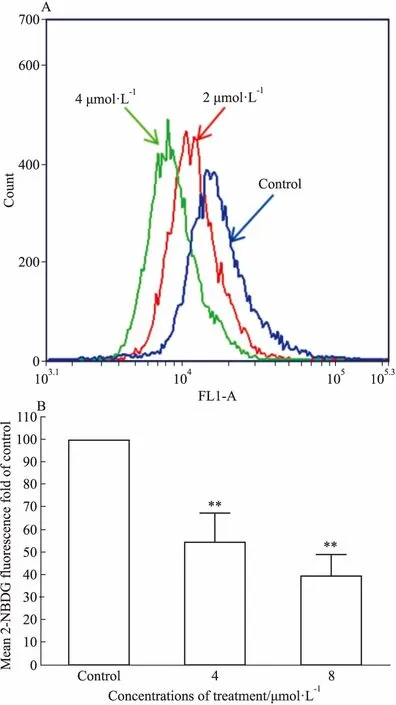
Fig 6 Glucose uptake inhibited by
A: Representative flow cytometry pictures of the 2-NBDG uptake in EC109 cells treated by Jar-TTA at indicated concentrations for 6 h; B: Alteration of mean 2-NBDG fluorescence in EC109.**P<0.01vscontrol.
总之,Jar-TTA已然是一个具有糖酵解/OXPHOS双重抑制功能的新的抗肿瘤候选化合物。本文的系统研究有望为设计合成活性更高、毒性更低、作用机制更为独特的新型二萜衍生物提供实验依据和理论支持。

Fig 7 GLUT4 and LDHA levels in
**P<0.01vscontrol
(致谢:本实验主要在阜外华中心血管病医院药学部药学研究实验室完成,在此感谢郑州大学药学院可钰教授给予的无私帮助,感谢郑州中谱仪器设备有限公司提供生物能量分析仪Seahorse XFp及相关技术支持。)