机械力诱导牙周膜细胞成骨向分化中内质网应激的作用机制研究*
任庆源, 何武林, 王庆, 林海燕
南方医科大学口腔医院、广东省口腔医院正畸科(广东广州 510280)
随着错颌畸形的设计和矫治理念的改进以及高性能矫治系统的发展,正畸学者的研究热点逐渐转向牙周膜细胞对正畸力的生物反应。从牙周骨改建过程中的关键细胞因子进行深入研究,不仅能为探明牙周病患者被施加正畸矫治力后牙周改建的分子生物学机制,以便科学有效地针对性矫治、提高矫治效果、促进牙齿健康可控的移动提供线索和理论依据,从而实现小范围牙移动,它是当代正畸治疗生物学概念创新所需的理论基础[1]。有学者[2-6]发现在心血管、肾脏等组织器官内以及软骨细胞增殖分化过程中,转录激活因子4(transcription activation factor 4,ATF4)表达的机械上调涉及蛋白激酶受体样内质网激酶(protein kinase receptorlike ER kinase,PERK),有研究表明[7-8],内质网应激(ERS)出现在成骨细胞分化过程中,表明 PERK-eIF2α-ATF4通路可能与 ERS介导的骨形成或成骨分化有关,由此推测正畸力作用于牙周膜刺激 ATF4高表达的过程中也可能有 PERK参与,然而,国内外很少报道内质网应激介导的 PERK-eIF2α-ATF4信号通路对正畸牙移动过程中牙周膜细胞成骨分化的影响。2017年6月至2018年6月本实验拟通过深入研究明确人牙周膜细胞(HPDLCs)受到正畸机械力刺激后 ATF4表达的相关具体机制,以及 PERK与 ATF4间的关系。
1 材料与方法
1.1 细胞培养 采用酶消化组织块法提取 HPDLCs,培养标本来自于南方医科大学口腔医院由于需要正畸而拔除的第一或第二前磨牙的患者。患者及家属均已知情同意。所有牙齿都在无菌条件下拔除,没有龋坏、根尖周炎和牙周炎,患者年龄13~18岁。在拔牙前患者用漱口水漱口,然后用1%碘酊和酒精进行局部消毒。拔除后的牙齿立即在无菌条件下装入含高浓度双抗的PBS的15 mL离心管中,并于30 min内对标本进行处理培养。在超净工作台(ESCO,Canada)内用含有高浓度抗生素(青霉素100 μg/mL,链霉素100 μg/mL, Hyclone,USA)的PBS漂洗样品牙齿2~3次,然后使用锋利的刀片完全刮除干净牙根中1/3的牙周韧带组织。之后将牙周韧带组织浸入含有终浓度为3 mg/mL 的Ⅰ型胶原酶(Sigma,USA)的α-MEM(Gibco,USA)培养基中。置于37℃水浴箱中消化,每15 min震荡1次,消化1 h后,加入完全培养基[含10%胎牛血清,1%青霉素100 μ/mL,链霉素100 μg/mL]终止消化,800 r/min,5 min离心,弃上清,重悬于完全培养基中,在饱和湿度、5% CO2、950 mL/L空气的37℃细胞培养箱中孵育。直到细胞在组织块周围游动,细胞传代达80%汇合。3~5代细胞用于加力实验。
1.2 HPDLCs组织来源鉴定 取第3代HPDLCs经0.25%胰蛋白酶消化后,将细胞以2×104个/mL的密度接种于底面有细胞爬片的6孔板内,在培养箱中培养至细胞密度达到85%以上,取出细胞爬片,PBS冲洗3次,4%多聚甲酸固定30 min,PBS冲洗3次后凉干,采用细胞免疫组化SABC法检测角蛋白和波形蛋白,封片后观察。
1.3 HPDLCs加载流体切应力 将细胞密度高于85%的HPDLCs用0.25%胰蛋白酶(Trypsin含0.02%EDTA,Gibco,USA)消化后,以3×105个/片的细胞密度接种于载玻片,将其置于培养皿中,接种2 h后加入完全培养液,完全浸没载玻片,继续于细胞培养箱培养3天,细胞密度达到85%以上准备进行加力。将接种HPDLCs的载玻片随机分成4组,使用蠕动泵(Coleparmer,USA)向每个实验组提供12达因/cm2的流体切应力,分别加力0、2、4、6 h,加力0 h为对照组。
1.4 碱性磷酸酶染色检测成骨分化情况 加载流体切应力后的各组载玻片取出,用PBS冲洗2次后,加入10%多聚甲醛固定30 min后,根据BCIP/NBT碱性磷酸酶显色试剂盒说明书对每组细胞进行染色,显微镜下观察染色情况。
1.5 实时定量PCR法检测基因表达 加载流体切应力后的各组HPDLCs立即使用Trizol试剂(Invitrogen Corp, Carlsbad, CA, USA)分别提取细胞总RNA,测定RNA样品浓度(A260/A280≥1.8);反转录合成cDNA,观察不同时间 PERK、真核翻译起始因子2A(Eukaryotic translation initiation factor 2A,eIF2A)、ATF4各基因的表达情况,PCR引物序列见表1。本研究所使用的引物序列由Primer Premier 5.0设计,由广州思晋生物工程技术有限公司合成。取1.0 μL反转录合成的cDNA在10 μL反应体系中进行实时PCR扩增。以细胞骨架蛋白β-actin作为内参,通过2-ΔΔC(ΔCt=Ct目的基因-Ctβ-肌动蛋白,ΔΔCt=ΔCt目的基因-ΔCt对照,Ct为循环次数)法检测每种基因mRNA相对表达水平。每例样品及阴性对照均设置3个平行复孔,取平均值。PCR条件:95℃预变性10 min,95℃变性15 s,60℃退火60 s,循环40次。

表1 PCR使用的引物序列

2 结果
2.1 人牙周膜细胞培养及表型鉴定 培养10 d后,原代HPDLCs从组织块中爬出(图1),3代HPDLCs(图2)进行免疫组化染色,光镜下可见细胞波形丝蛋白(Vimentin)染色阳性,细胞胞浆呈现棕黄色,阳性颗粒均匀分布,细胞核清晰无染色(图3),符合中胚层来源的成纤维细胞特征;细胞角蛋白(Cytokeratill)染色阴性(图4),表明无外胚层来源的细胞。
2.2 碱性磷酸酶染色 人牙周膜细胞经流体切应力处理后,其ALP染色呈蓝紫色,颜色较对照组有显著加深。见图5。
图1 原代HPDLCs从组织块中爬出(×200)

图23代HPDLCs(×200)
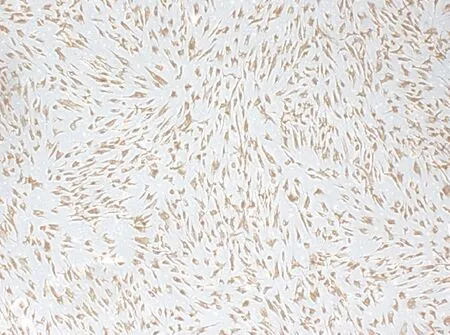
图3波形丝蛋白(Vimentin)染色阳性,细胞胞浆呈现棕黄色,阳性颗粒分布均匀,胞核清晰无染色(×200)

图4细胞角蛋白(Cytokeratill)染色阴性(×200)
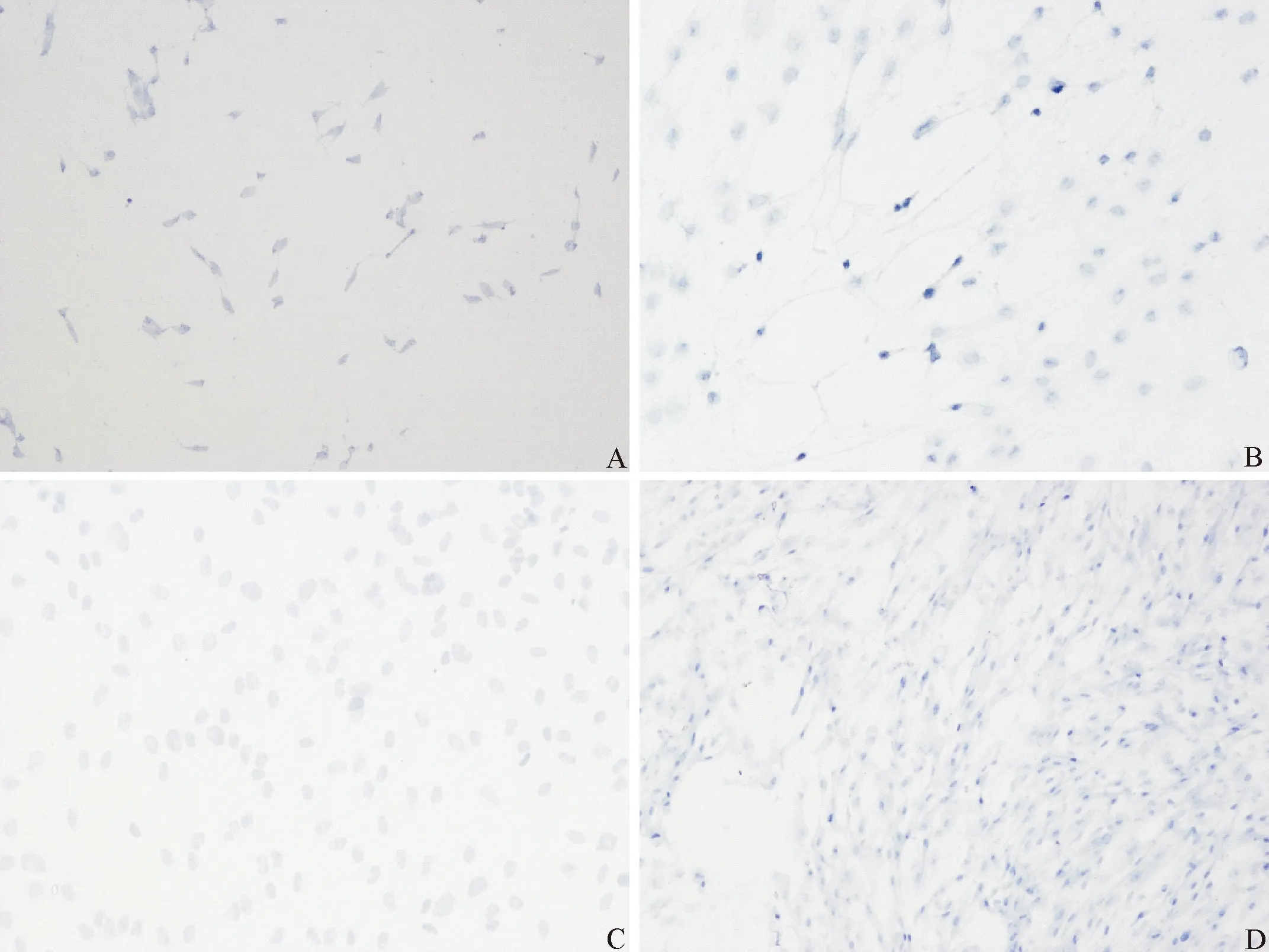
A:对照组; B:加力2 h组; C:加力4 h组; D:加力6 h组
2.3 实时定量PCR 经流体切应力处理后的各组牙周膜细胞,PERK和ATF4基因的表达量均高于对照组,在4 h达到峰值,6 h有所降低(P<0.05),见表1~2、图6~7。eIF2α基因表达量均低于对照组,且在4 h时达到最低值,6 h有所回升(P<0.05),见表4、图8。
表2PERK实时定量PCR

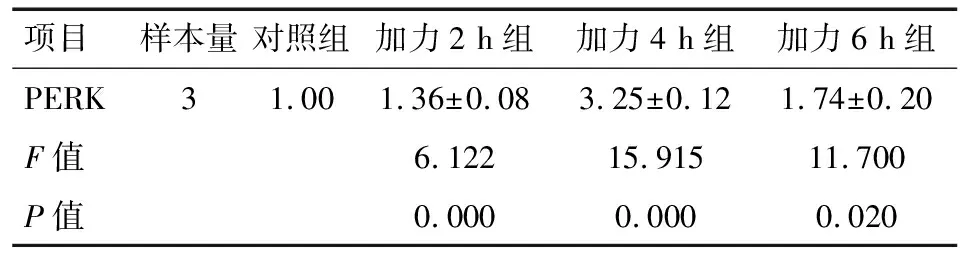
项目样本量对照组加力2 h组加力4 h组加力6 h组PERK31.001.36±0.083.25±0.121.74±0.20F值6.12215.91511.700P值0.0000.0000.020
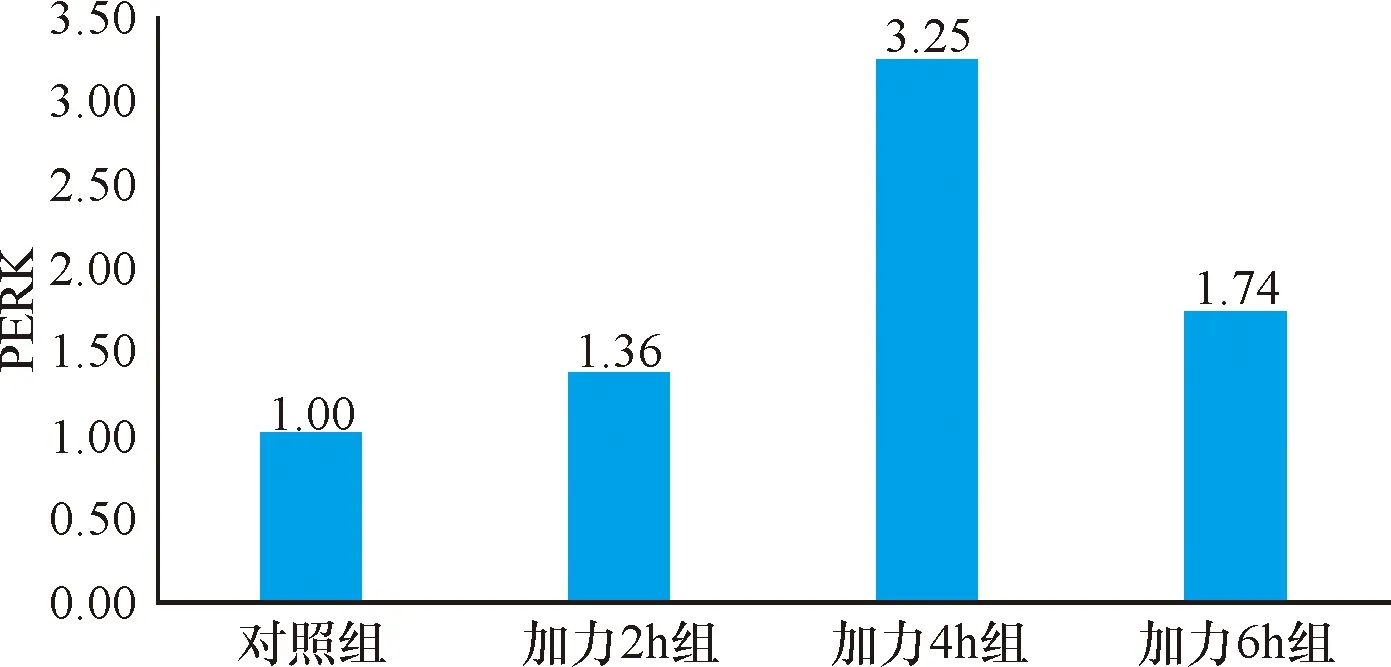
图6 PERK实时定量PCR


项目样本量对照组加力2 h组加力4 h组加力6 h组ATF431.0013.89±2.013 424.23±18.46 2 402.22±99.91F值11.56414.44216.00P值0.0000.0000.000
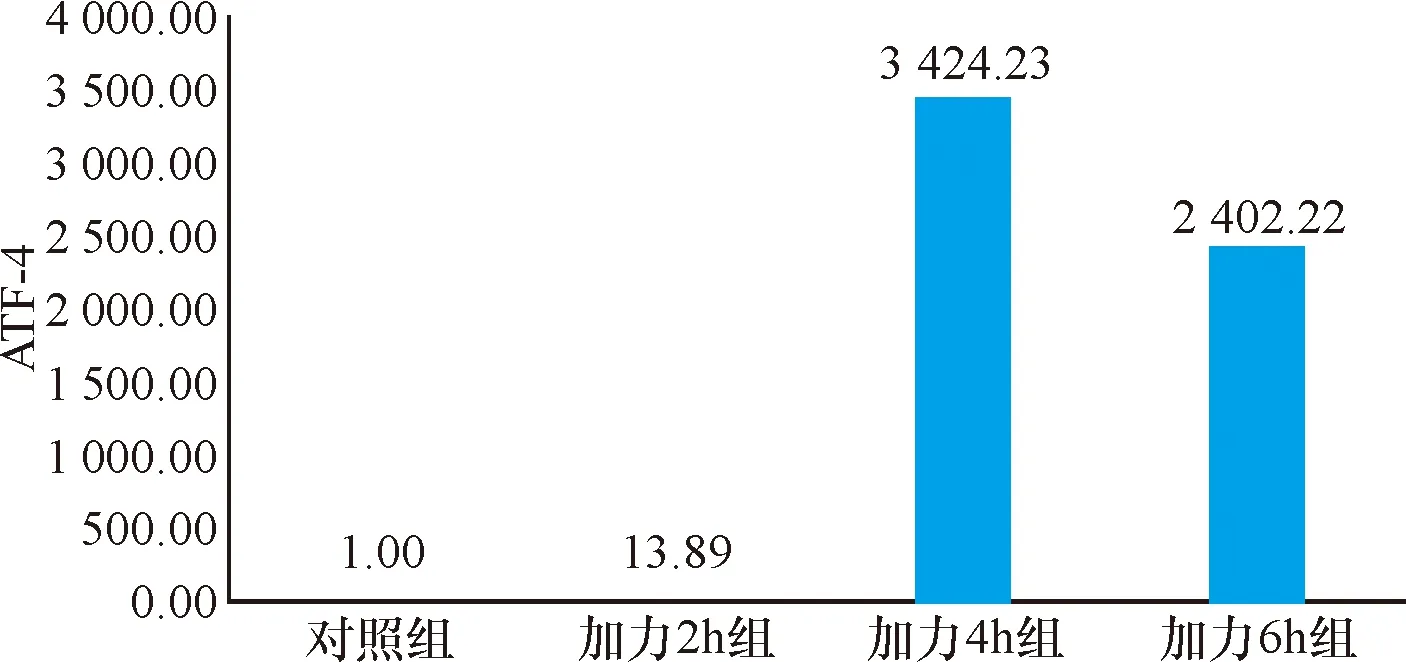
图7 ATF4实时定量PCR

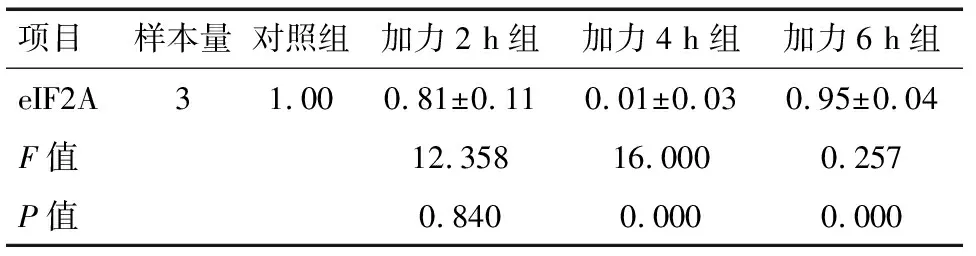
项目样本量对照组加力2 h组加力4 h组加力6 h组eIF2A31.000.81±0.110.01±0.030.95±0.04F值12.35816.0000.257P值0.8400.0000.000
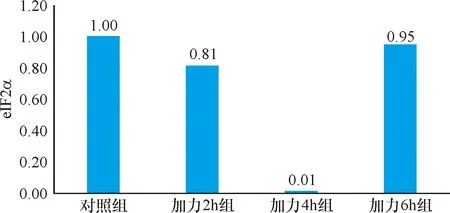
图8 eIF2A实时定量PCR
3 讨论
近些年,越来越多的学者致力于牙周组织受到机械力后,牙周膜细胞对于机械力的表现,在正常情况下,牙周组织具有一定的自我更新和修复的能力,主要通过牙周膜细胞的自我更新来实现[9]。刺激破骨分化的机制很复杂,受到多种相关因素的影响,因此,已有不同种类的机械力刺激作用于牙周膜细胞,体外培养细胞的加力方式大致可分为:压力载荷法[10-11]、机械拉伸法[12-13]、流体剪切法[14-15]。Schwarz等[16]认为牙周膜组织是一种连续的液态环境,组织液既是细胞物质交换的媒体又是传递和缓冲应力的介质,当牙齿受力发生位移时,必然会挤压牙周膜引起组织液的液压迅速改变。有学者认为,细胞对外力的反应是因为外力导致组织间液流动改变,从而被细胞感知,因此细胞对FSS的反应比对压力及牵张力的反应敏感得多[17]。就牙周应力环境而言,体外施加FSS更能模拟整个牙移动时牙周膜所受到的机械力。用于研究HPDLCs在正畸牙移动的整个骨改建过程中的作用,为正畸力作用下骨组织改建的研究提供实验依据。
PERK是一种位于内质网膜上的Ⅰ型跨膜蛋白,而内质网是细胞内最重要的细胞器之一,参与各种细胞信号的处理,其功能的紊乱对于细胞而言是致死性的。近些年,有关学者发现在心血管、肾脏等组织器官内以及软骨细胞增殖分化过程中,机械力上调ATF4表达涉及PERK,当细胞受到缺氧、钙离子平衡失调等刺激时,未折叠或错误折叠的蛋白质在内质网中积聚,内环境的Ca2+浓度改变,进而导致内质网结构和功能的失衡。此时相应的信号通路将激活,引发ERS。大量研究证实,ERS主要由内质网膜上的3种蛋白——PERK、ATF6、肌醇酶1(inositol requiring enzyme1,Ire1)介导,其中PERK的作用涉及PERK-eIF2α-ATF4信号通路。ERS发生时,大量未折叠蛋白或错误折叠蛋白与Bip(binding immunoglobulin protein)结合,导致PERK从复合物中解离出来而被激活,通过跨膜磷酸化而转导ERS反应信号,磷酸化的eIF2α不能启动蛋白质的翻译过程,从而减少蛋白质合成,降低内质网中错误折叠蛋白质浓度并降低能耗,维持内环境稳定[18-20]。本实验结果发现,经过流体切应力作用后的人牙周膜细胞PERK、ATF4表达均发生上调,eIF2α下调,且趋势有相关性,且与PERK通路各因子相互调节关系相符,提示PERK-eIF2α-ATF4信号通路介导的ERS参与正畸加力时牙周膜改建过程,并发挥重要的调节作用。
正畸牙移动有赖于力刺激下牙周组织和骨组织的改建,其中成骨细胞在骨形成和破骨细胞附着分化方面[21]有重要作用。有研究表明,PERK-eIF2α-ATF4信号通路介导的ERS参与成骨细胞的成骨向分化[20],本研究中,ALP染色结果显示经过流体切应力作用后的牙周膜细胞成骨作用增强,提示ERS促进牙周膜细胞的成骨向分化。
综上所述,机械力能够激活ERS进而激活PERK-eIF2α-ATF4信号通路,并诱导牙周膜细胞成骨向分化。因此,PERK-eIF2α-ATF4信号通路的激活可能对正畸牙移动过程、牙周的改建以及牙周膜细胞的成骨分化有重要影响。
——疾病防治的新靶标

