多中心临床试验中心伦理审查模式探讨*
粟志英,阳国平,2,王晓敏,2,黄志军,2**
(1 中南大学湘雅三医院临床药理中心,湖南 长沙 410013,xy3irb@163.com; 2 中南大学医学伦理学研究中心,湖南 长沙 410013)
原国家食药总局药品审评中心发布的2017年度药品审评报告显示,2017年共批准创新药临床试验申请399件,较2016年翻了一番[1]。国内外创新药物研发的力度持续加大,同时随着我国临床试验申请从批件制改为60天默认制,多中心临床试验数量也将显著增加。2017年10月国家发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和《药品注册管理办法(修订稿)》中均明确表明对于多中心临床试验,各研究机构应认可并接受组长单位伦理委员会或区域伦理委员会的审查结论,不再重复审查。同时提出应整合资源建立统一的伦理审查平台,逐步推进伦理审查互认[2-3]。因此,多中心临床试验的伦理审查采取中心伦理审查模式已经是大势所趋。本文总结了国内伦理审查现状及海外主要的中心伦理审查模式,为我国的伦理审查提供参考和指导。
1 中国伦理审查现状
我国目前已有超过700家药物临床试验机构和260多家器械临床试验机构,每家机构都设立了伦理委员会,部分高校也成立了伦理委员会。而每个研究机构根据自身的特点及要求又设立了不同类型的伦理委员会,如药物临床试验伦理委员会、器械临床试验伦理委员会、临床研究伦理委员会、器官移植与临床应用伦理委员会、生殖医学伦理委员会、实验动物伦理委员会等。各个伦理委员会的运作模式、审查程序和审查流程各不相同,审查水平参差不齐。每个伦理委员会都带有明显的自身特色,尤其是在多中心临床试验的伦理审查中表现得尤为突出。
尽管各个伦理委员会在组成和运行流程上存在差异,但药物临床试验的伦理审查基本上都遵循了《药物临床试验伦理审查工作指导原则》。该指导原则和原国家卫计委发布的《涉及人的生物医学研究伦理审查办法》均提出了伦理委员会可采用协作审查模式审查多中心临床试验项目。但由于各个伦理委员会的伦理审查水平参差不齐,且协作审查模式中各个单位的职责划分未明确,故实际操作过程中并未完全按此文件执行。目前国内针对多中心临床试验主要有如下几种伦理审查模式[4]:①无论组长单位有无审查,参加单位一律全部审查。该审查模式弥补了专业的局限性,有利于受试者利益及权益的维护。但缺点也很明显,重复审查大大增加了项目的审查时间,且不同机构伦理委员会的审查意见若有相冲突的地方,则会极大延迟项目的启动时间,且绝大多数情况下无益于加强对受试者的保护[5];②申办者监查员待组长单位审查通过后,再报参加单位,参加单位对组长单位的审查质量进行评估后,进行快速审查;③申办者监查员待组长单位审查通过后,再报参加单位,参加单位对组长单位的审查质量进行评估认可后不再进行审查,直接进行备案;④多中心同时送审,集中修订后报备案。后三种审查模式能明显缩短伦理审查的总耗时间[6]。此四种伦理审查模式往往会同时出现在同一个多中心临床试验中。由此可见,多中心临床试验的伦理审查模式多样,增加了申办者准备资料的难度,也影响了创新药物临床试验的整体推进。
2 海外中心伦理审查模式
通过查阅中国大陆以外国家和地区临床试验和伦理相关法律法规及文献,采用中心伦理审查模式的主要有美国、欧盟(以瑞典为例)、英国、加拿大、澳大利亚、中国台湾地区。总体来说,中心伦理审查可分为三大类:独立审查模式、责任分担模式、联合审查模式。各国和地区对于多中心临床试验的中心伦理审查模式不尽相同。美国、加拿大三种审查模式均有,英国、瑞典、澳大利亚审查模式相对统一(详见表1)。造成这种多模式审查的原因主要是各中心伦理委员会的组成性质不一样以及各地区和机构有无相应的伦理委员会。如美国国家中心伦理委员会的独立审查模式,通常是适用于地区机构中无伦理委员会的情况,或是适用于该地区机构伦理委员会不具备待审查试验项目能力的情况。而联合审查模式是由各个机构的伦理委员会组成联盟,其中一个或几个有主审资质的伦理委员会负责进行主审或轮流进行主审,审查完后直接将审查结论交由其他成员伦理委员会承认;或是主审完后再由有副审资质的伦理委员会进行副审,审查完后再向各个机构伦理委员会传达审查结论。
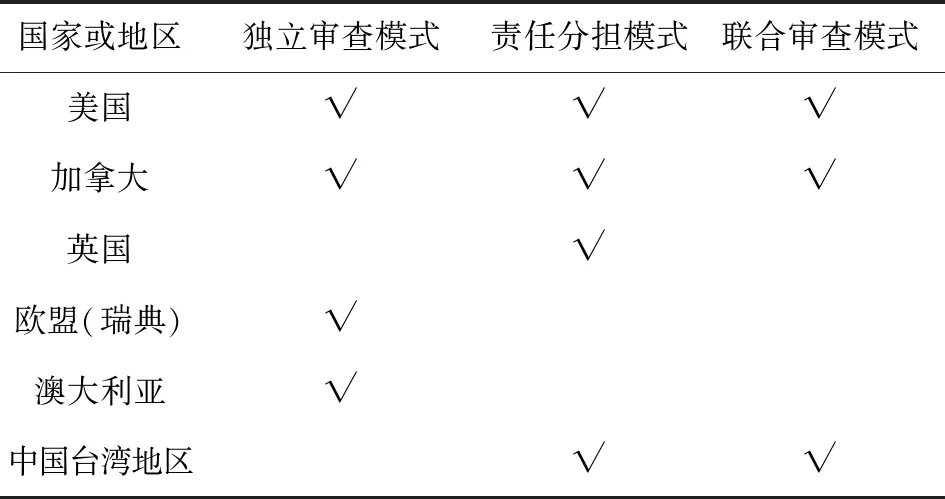
表1 中心伦理审查模式对比
2.1 独立审查模式
独立审查模式以美国国家中心伦理委员会、美国纽约生物医学研究联盟的中心伦理委员会、瑞典地方伦理审查机构、澳大利亚伦理委员会为例。
2.1.1 美国独立审查模式
美国采用独立审查模式的伦理委员会有:美国国家癌症研究院的中心伦理委员会、纽约生物医学研究联盟的中心伦理委员会以及商业性伦理委员会。美国国家癌症研究院的中心伦理委员会也是国家中心伦理委员会,伦理审查模式除独立审查模式外,还有责任分担模式。此中心伦理委员会于2016年建立了SMART IRB系统平台,旨在协调、简化和加速多中心临床试验的伦理审查流程,同时确保为研究参与者提供高水平的保护。目前已有超过470家机构加入了该SMART IRB系统,包括所有的临床和转化科学基金(Clinical and Translational Science Awards,CTSA)中心和部分大学。纽约生物医学研究联盟的中心伦理委员会是区域中心伦理委员会。商业性伦理委员会主要有西部伦理委员会、法定伦理委员会(Quorum IRB)等,其中西部伦理委员会是美国最大的商业性伦理委员会。Quorum IRB在美国和加拿大均设有办事处,可服务于美国和加拿大的多中心伦理审查。独立审查模式是指国家中心伦理委员会、区域中心伦理委员会或商业性伦理委员会负责多中心临床试验项目所有资料的审查,包括方案的初始审查和跟踪审查,同时包括地方要求方面的审查[7-10]。
2.1.2 瑞典独立审查模式
瑞典伦理委员会分为1个独立的中央伦理审查委员会和6个区域伦理审查委员会。中央伦理审查委员会设立于瑞典斯德哥尔摩研究委员会中,由司法监察员和书记官长监督。6个区域伦理审查委员会是按照瑞典的地理位置分布,均设立在各个地区的大学内,如哥德堡大学、林雪平大学、瑞典隆德大学、斯德哥尔摩的卡罗林斯卡学院、瑞典于默奥大学和乌普萨拉大学。多中心临床试验的伦理审查,由申请人向主要研究者所在地区的区域伦理审查委员会和政府监督管理部门同时递交审查申请材料,二者均审核通过后则在全国各地都有效。若申请人对审查结果有异议,则可向中央伦理审查委员会提出申诉[11]。中央伦理审查委员会除审查有异议的申诉的临床试验项目外,还审查由于区域伦理审查委员会内部出现意见分歧,不能达成意见一致的临床试验项目。由此可见,瑞典的多中心临床试验伦理审查由一个区域伦理审查委员会审查即可,其他伦理委员会不再进行重复审查,这种审查模式类似美国的独立审查模式。
2.1.3 澳大利亚独立审查模式
澳大利亚国家卫生与医学研究委员会(NHMRC)对于多中心临床试验伦理审查采取了NHMRC国家认证计划,支持对多中心研究采取独立伦理审查模式。2013年,维多利亚、南澳大利亚、昆士兰卫生部门以及新南方威尔士卫生部签署了一份谅解备忘录,用于参与临床试验的公共卫生机构对伦理和科学审查结果的全国互认(NMA)。2015年12月,NMA的范围扩大到临床试验以外,包括所有人类研究在内的临床试验。2016年8月和2017年8月,堪培拉和西澳大利亚州也分别先后加入了NMA。为了人类研究的伦理审查在NMA下能被接受,进行审查的人类研究伦理委员会(HREC)必须是NHMRC国家认证计划中的权威机构,同时也要是NMA计划中认证审核的伦理委员会。在澳大利亚申请多中心临床试验伦理审查时,申请人应先与相应的研究机构联系,告知他们关于准备对多中心临床试验进行单一伦理审查的机构和需要遵循的过程。然后再向通过认证的伦理委员会提交伦理审查申请,伦理审查通过后各个研究机构可进行临床研究[12]。昆士兰卫生部有一个中央分配服务器,负责分配多中心临床试验伦理审查,由其中一个认证的伦理委员会操作。在维多利亚的所有公共卫生服务中,申请人必须通过电话与中央分配系统联系,完成对多中心临床试验伦理审查的分配。
2.2 责任分担模式
责任分担模式常见于美国、英国、中国台湾地区的多中心伦理审查中。
2.2.1 美国责任分担模式
美国责任分担模式是指国家中心伦理委员会、区域中心伦理委员、机构伦理委员会进行责任划分,分别承担相应的伦理审查任务。国家中心伦理委员会主要审查多中心临床试验的初始方案、变更方案、试验过程中的不良事件以及追踪审查。区域中心伦理委员会、机构伦理委员会负责审查试验的可行性及地方有关问题。责任分担模式多适用于研究机构内设有伦理委员会的情况。
2.2.2 英国责任分担模式
英国1997年发布的指导性文件HSG(97)25规定成立多中心研究伦理委员会。对于多中心临床试验的伦理审查采取MREC/LREC审查模式,MREC是指多中心研究伦理委员会(Multicentre Research Ethics Committees,MREC),LREC是指区域研究伦理委员会(Local Research Ethics Committees,LREC)。凡涉及4个以上的试验机构的多中心临床试验,需将项目审查资料递交至MREC进行伦理审查。MREC主要审查试验方案的科学性及伦理性,审查通过后告知主要研究者审查决定,再由主要研究者向各个LREC提出审查申请,LREC主要审查与当地有关的问题。目前英国的国家健康服务(NHS)研究伦理委员会(REC)有超过80个。对于多中心临床试验项目,项目总负责人在获得主审伦理委员会的伦理审查结论后,应通过全国伦理研究服务体系(NRES)系统递交总的伦理审查申请。待申请受理后,各机构主要研究者向其所在地方的LREC提出申请,LREC根据项目和本机构情况给出具体评估意见。主审伦理委员会综合各方意见确定参加研究的机构,并告知项目总负责人,由总负责人再通知各个机构研究者。对于涉及英格兰的NHS组织,还需获得英国卫生研究机构(HRA)的批准,并使用综合研究应用系统(IRAS)上传项目资料[13-14]。英国的该审查模式与美国的责任分担模式相似。
2.2.3 中国台湾地区责任分担模式
中国台湾地区的伦理委员会分三种类型:联合人体试验伦理委员会、中心伦理委员会、医疗机构伦理委员会。中国台湾地区的责任分担模式主要体现在联合人体试验伦理委员会和医疗机构伦理委员会中。联合人体试验伦理委员会审查的方案多为多中心临床试验项目方案,申请人将临床试验方案(包括方案变更的情况)同时递交给联合人体试验伦理委员会、卫生福利主管部门审查,二者均审核通过后再进行医疗机构伦理委员会审查,其中对取得联合人体试验伦理委员会批准函的试验方案,许多研究机构不再做实质性的审查。
2.3 联合审查模式
联合审查模式常见于美国和中国台湾地区的伦理审查中。
2.3.1 美国联合审查模式
美国联合审查模式包括两种类型:主审IRB模式、主审/副审IRB模式。主审IRB模式主要是威斯康辛 IRB 联盟的中心伦理委员会审查模式。该区域中心伦理委员会中的成员轮流作为主审伦理委员会,审查多中心临床试验项目方案相关的所有资料,并将审查结论交由其他成员伦理委员会承认。主审/副审IRB模式主要是俄亥俄临床试验转化科学基金试验联盟和美国中西部健康研究联盟在使用。这些区域中心伦理委员会中具有主审资质的伦理委员会负责进行主审,主审完后再由有副审资质的伦理委员会进行副审,审查完后再向各个伦理委员会传达审查结论。
2.3.2 中国台湾地区联合审查模式
中国台湾地区的中心伦理审查是以一个中心伦理审查系统审查多中心临床试验项目。中心伦理委员会的联合审查机制包括两种类型:一种是由卫生福利部拟定的联合伦理审查机制(C-IRB);另一种是由生技医药国家型科技计划(NRPB)办公室设计和推动的联合伦理审查机制(NRPB-IRB)。目前NRPB-IRB已有二十几家医院参与使用,如台中荣民总医院、亚东纪念医院等。NRPB-IRB采取的是主审/副审的联合审查模式[15],且由参与的二十几家医院轮流进行主审。在递交多中心临床试验伦理审查时,申请人应先申请NPRP-IRB入口账号,待NPRP计划办公室审核通过后,可登入NPRP-IRB网站填写联合审查申请书,由NPRP计划办公室分配主审医院,NPRP-IRB系统自动将主审医院名单发送给计划主持人及联络人。申请人可前往主审医院递交审查申请并等待审查通知,主审医院审查通过后,主持人将主审医院的初(复)审意见及回复表、会审意见及回复表、许可证明等文件平行向副审医院递交申请书及等待审查通知,同时将主审医院审核通过的文件上传至NRPB-IRB的PTMS系统中。待所有副审医院审查皆通过后,申请人需在NPRP-IRB入口网通知NPRP计划办公室,该项目已完成所有医院的审查程序。NPRP计划办公室将检查文件齐全后,将该项目更改为“结案”状态。此时各个参与单位可进行临床研究。
3 国内开展中心伦理审查的思考
综上所述,上述几个国家和地区中选择较多的审查模式是独立审查模式和责任分担模式。但是哪种审查模式更适合我国国情和临床试验的发展趋势,这就取决中心伦理委员会的建设。如认证一批有资质的伦理委员会作为中心伦理委员会或建立独立的区域伦理委员会,则可选择独立审查模式、责任分担模式;若建立区域机构伦理委员会联盟,且认证一批有主审和副审资质的机构伦理委员会,则可选择独立审查模式、联合审查模式。目前我国各地区相继建立起了区域伦理委员会,如上海区域伦理委员会、山东省区域医药伦理审查委员会、广东省药学会区域伦理委员会等。同时各个医学专业领域也开始建立相应领域内的伦理委员会,如2018年1月29日成立的中国心血管研究协作组伦理委员会,该伦理委员会作为中国首家专业伦理委员会旨在提高心血管专业领域的伦理审查效率和审查质量,保护我国心血管领域的临床试验的受试者的安全和权益。这些区域伦理委员会和专业伦理委员会都是独立伦理委员会,可接收该区域或专业领域内的多中心临床试验项目的伦理审查。
中国临床研究能力提升与受试者保护高峰论坛(CCHRPP)率先提出了对于多中心临床试验的伦理审查采取主审/副审IRB审查模式。承担主审IRB审查的伦理委员会应来自国家临床医学研究中心、或已经承担了国家科技重大专项的临床试验机构;副审IRB是除主审IRB以外的其他伦理委员会。CCHRPP也制作了单一伦理审查协作平台“Sharing IRB”,但目前尚处于研发和推广阶段。
有专家认为针对多中心临床试验可以选择责任分担模式进行伦理审查,如选择有资质的中心伦理委员会、区域伦理委员会或共同约定的组长单位伦理委员会作为中心伦理委员会进行中心伦理审查,其他机构伦理委员会负责审查与本机构相关的内容。由此可见,责任分担模式、主审/副审IRB模式可能是目前在国内同行支持率比较高的办法。不管选择哪种审查模式,其目标都是一致的,都是为了提高审查效率,确保审查质量、降低审查成本,加快多中心临床试验进展,推动我国临床研究事业的发展。但就国内目前伦理委员会现状及审查水平,中心伦理审查模式的选择只能循序渐进,想完全实现真正意义上的中心伦理审查即独立审查模式,还未具备相应的条件。作为向真正意义上的中心伦理审查即独立审查模式过渡,目前国内可选择责任分担模式、联合审查模式中的主审/副审IRB模式。
简单地参照其他国家和地区的伦理审查模式仍然是不合适的,只有加强伦理审查人员的意识,提高伦理审查能力,培养专业的伦理从业人员,按照学科建设临床研究的伦理委员会,才能真正使受试者的保护进入一个新的阶段[16]。同时应鼓励更多研究机构参与伦理领域的相关认证,提高受试者保护意识和临床研究质量[17]。与此同时,还需完善和细化我国多中心临床试验的法律法规和指南,建立中心伦理审查网站等一系列有助于推动中心伦理审查实施的举措[18]。

