原花青素对磷酸三钙磨损颗粒所致小鼠颅骨溶解的干预作用及其机制*
林 琨, 陈佳濠, 方泽浩, 叶铖龙, 韩超杰, 严 明, 方 剑, 张 云△
(1. 绍兴文理学院医学院基础医学部, 浙江 绍兴 312000; 2. 杭州电子科技大学生命信息与仪器工程学院, 浙江 杭州 310018)
人工关节置换术是指用人工关节置换和代替损伤或病损关节,是临床治疗晚期髋、膝关节等严重关节疾病的重要手段,它可有效减轻患者关节疼痛、恢复关节功能,提高患者生活质量。但是长期使用关节假体容易发生无菌性松动[1],导致人工关节置换失败和关节翻修。新近假体翻修术回顾性研究发现关节假体植入体内后,经过长期磨损、碰撞会产生大量的聚乙烯(polyethylene,PE)、金属钛(titanium,Ti)和陶瓷磷酸三钙(tricalcium phosphate,TCP)等磨损颗粒,这些颗粒可激活假体周围组织细胞释放肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白介素-1β( interleukin-1 β,IL-1β)和白介素-6(interleukin-6,IL-6)等因子,诱导破骨细胞分化和活化,造成假体周围骨溶解及关节假体松动[2-4]。Steinbeck等和我们前期研究表明磨损颗粒可诱导假体周围发生氧化应激,产生过多的活性氧(reactive oxygen species,ROS),破坏假体周围骨组织氧化/抗氧化平衡,引起氧化应激反应,促进假体周围破骨细胞生成和骨溶解[5, 6]。因此,氧化应激在磨损颗粒诱导假体周围骨溶解中发挥重要的作用。
原花青素(procyanidin)是从葡萄籽中提取分离出的天然多酚类化合物,具有较强的抗氧化和清除自由基及抗炎作用[7-9]。但是,原花青素是否可通过影响氧化应激反应而调控假体周围骨溶解目前还尚不明确。本研究拟应用前期成功构建的TCP磨损颗粒诱导小鼠颅骨溶解模型,模拟体内关节假体释放的磨损颗粒诱导假体周围骨溶解病理过程[3, 6],给予原花青素干预并分析其对假体周围骨溶解、破骨细胞生成、炎症因子释放、氧化应激水平及自噬的影响,探讨原花青素对TCP磨损颗粒诱导的假体周围骨溶解的保护作用及其分子机制,为研究防治假体周围骨溶解候选药物提供实验依据。
1 材料与方法
1.1 材料
TCP颗粒由浙江大学化学系馈赠;原花青素(HPLC≥95%)购自上海源叶生物技术有限公司);水合氯醛、多聚甲醛和EDTA购自上海阿拉丁生化科技股份有限公司;T-AOC、MDA和SOD试剂盒购自南京建成生物工程研究所;超敏ECL化学发光检测试剂盒购自杭州联科生物技术有限公司;Applied BiosystemTMSYBRTM试剂购自美国ThermoFisher Scientific公司;TRIzol、BCA蛋白浓度检测试剂盒、RIPA裂解液和SDS-PAGE凝胶配制试剂盒购自上海碧云天生物技术研究所;兔抗Beclin-1抗体、兔抗LC-3抗体和小鼠抗β-actin抗体购自美国Cell Signaling公司;PVDF膜购自美国Millipore公司。
1.2 动物分组与模型构建[3, 6]
SPF级6~8周龄ICR雄性小鼠,体量18~22 g,购于浙江省医学科学院实验动物中心提供(许可证号:SCXK(浙)2014-0001)。取48只雄性ICR小鼠随机分为假手术(Sham)组、TCP磨损颗粒(TCP)组和原花青素(0.2 mg/kg,1 mg/kg,5 mg/kg)组,每组12只。腹腔注射水合氯醛(400 mg/kg)麻醉小鼠后,无菌条件下取颅顶正中矢状切口,长约0.8 cm,分离皮下组织,显露出1 cm×1 cm颅骨区域。假手术组进行原位缝合,其余组取TCP颗粒30 mg置于颅顶后缝合皮肤。原花青素组小鼠于术后第2日颅顶骨膜部位注射原花青素,隔日1次,持续2周。实验结束后处死小鼠取血和颅骨。
1.3 血清制备
实验结束后,各组小鼠分别于眼眶后静脉丛采血1.0 ml置于EP管中,待血液凝固后于4℃、3 000 r/min离心10 min,分离血清。
1.4 化学比色法检测
取96孔培养板,每孔加入20 μl血清,分别采用T-AOC、MDA和SOD试剂盒检测小鼠血清中T-AOC、MDA含量及SOD活性。
1.5 TRAP染色
各组颅骨经4%多聚甲醛固定10 min,0.25 mol/L氢氧化铵超声清洗5 min。然后置于系列乙醇(50%,80%,90%,100%)中梯度脱水,自然晾干后加入TRAP染色液中室温避光染色60 min。蒸馏水清洗后,置于IX70显微镜下观察颅骨表面侵蚀程度并利用Image Pro Plus 6.0图像处理软件分析正中矢状线区域骨溶解面积。
1.6 HE染色
各组颅骨经4%多聚甲醛固定24 h和10% EDTA(pH 7.4)脱钙2周后,石蜡包埋后,颅骨切片厚度为7 μm。HE染色后置于IX70显微镜观察TCP颗粒周围破骨细胞生成情况。利用Image Pro-Plus 5.0(美国Media Cybernetics公司)计算正中矢状缝区域三核及以上破骨细胞数。
1.7 骨组织RNA的提取与荧光定量PCR检测
每组等重量假体周围颅骨组织,置于研钵内在液氮环境下研磨成粉末后转移至EP管中,利用TRIzol法提取总RNA,反转录后应用Applied BiosystemTMSYBRTM试剂盒行荧光定量PCR。设置程序:95℃ 5 min预变性,后以95℃ 30 s变性、56℃ 30 s退火、72℃ 40 s延伸等45个循环进行扩增,最后37℃ 30 s。导出扩增曲线,记录Ct值,以mRNA水平以相对定量(β-actin)表示,应用2-△△Ct测定,引物序列见表1。

Tab. 1 Sequences of PCR primers
1.8 骨组织蛋白的提取与Western blot[10]检测
各组取等重量假体周围颅骨组织置于研钵内,在液氮环境下研磨成粉末,然后转移至EP管中。加入RIPA裂解液800 μl裂解30 min,于4℃ 12 000 r/min离心15 min,收集上清液。采用BCA法检测各组总蛋白质浓度。骨组织蛋白提取液中加上样缓冲液后煮沸 10 min,冷却后每孔上样30 μg蛋白,行12%SDS-PAGE分离蛋白,电泳完成后将蛋白转移到PVDF膜上,经5%脱脂牛奶常温封闭2 h后,分别加入兔抗Beclin-1抗体(1∶1 000稀释)、兔抗LC-3抗体(1∶1 000稀释)和小鼠抗β-actin抗体(1∶1 000稀释)置于4℃ 孵育过夜。次日用TBST洗涤3次后加入 HRP 标记的二抗(1∶2 000稀释)室温孵育2 h,TBST清洗3次加入ECL显色液;通过凝胶成像系统扫描分析各蛋白表达的变化。
1.9 统计学处理
2 结果
2.1 原花青素对TCP磨损颗粒诱导的假体周围骨溶解的干预作用
与Sham组比较,TCP组小鼠颅骨假体周围(正中矢状缝)发生明显骨溶解,骨溶解面积显著增加(图1,P<0.05);与TCP组比较,原花青素组小鼠颅骨表面骨溶解程度显著减轻,其中高剂量原花青素组(5 mg/kg)骨溶解面积减少更为明显,仅为TCP组的骨溶解面积的44.83%(P<0.05,图1)。

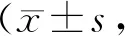
A: Representative photographs ofosteolysis in the mouse calvaria (TRAP ×200); B: Osteolysis area measured by NIH image; TRAP: Tartrate resistant acidphosphatase; TCP: Tricalcium phosphate
*P<0.05vsSham group;#P<0.05vsTCP group;△P<0.05vsprocyadinin (0.2 mg/kg) group;▲P<0.05vsprocyadinin (1 mg/kg) group
2.2 原花青素对TCP磨损颗粒诱导假体周围破骨细胞生成的影响
HE染色结果显示:与Sham组比较,TCP组假体周围破骨细胞生成显著增加,其数目明显增加(P<0.05,图2);与TCP组比较,原花青素组假体周围破骨细胞生成明显减少,其数量分别减少为TCP组的95.32%(0.2 mg/kg)、83.37%(1 mg/kg)和30.29%(5 mg/kg,P<0.05,图2)。
2.3 原花青素对TCP磨损颗粒诱导假体周围破骨细胞生成相关基因mRNA水平的影响
Real-time PCR结果显示:与Sham组比较,TCP组假体周围骨组织中破骨细胞生成相关基因TRAP、capthesin K、c-Fos和NFATc1表达显著上调,其mRNA水平明显升高(P<0.05,表2);与TCP组比较,原花青素组假体周围骨组织中TRAP、capthesin K、c-Fos和NFATc1表达明显下调,其mRNA水平显著减少(P<0.05,表2)。


A: Representative photographs of osteoclastogenesis in the mouse calvaria (HE ×200); B: Osteoclasts number measured by NIH image; HE: Hematoxylin eosin; TCP: Tricalcium phosphate
*P<0.05vssham group;#P<0.05vsTCP group;△P<0.05vsprocyadinin (0.2 mg/kg) group;▲P<0.05vsprocyadinin (1 mg/kg) group
2.4 原花青素对TCP磨损颗粒诱导氧化应激的影响
与Sham组比较,TCP组小鼠血清中MDA含量明显增加、T-AOC含量和SOD活性显著降低,分别为Sham组的7.55倍、45.53%和57.82%(P<0.05,表3);与TCP组比较,原花青素组小鼠血清中MDA含量明显降低,T-AOC含量和SOD活性显著升高,其中原花青素组(5 mg/kg)小鼠血清中MDA和T-AOC含量及SOD活性分别是TCP组的 53.67%、1.42倍和1.32倍(P<0.05,表3)。
2.5 原花青素对TCP磨损颗粒诱导假体周围骨组织自噬的影响
由于上述实验结果显示低剂量组(0,2 mg/kg)对TCP磨损颗粒所致小鼠颅骨溶解及其相关指标的影响不明显,且与TCP(模型组)比较,差异不明显(P>0.05),故在此处仅设1 mg/kg和5 mg/kg两组。Western blot结果显示:与Sham组比较,TCP组小鼠假体周围骨组织中自噬相关蛋白Beclin-1和LC-3蛋白表达明显上调,LC-3I向LC-3II转换明显增加,造成LC-3II/LC-3I比值升高(P<0.05,图3);与TCP组比较,原花青素组小鼠假体周围骨组织Beclin-1和LC-3表达及LC-3II/LC-3I明显降低(P<0.05,图3)。
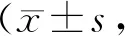
Tab. 2 Effects of procyanidin on mRNA levels of osteoclastic genes such as TRAP, capthesin K, c-Fos and NFATc1 in the mouse calvaria n=6)
TRAP: Tartrate resistant acid phosphatase; NFATc1: Nuclear factor of activated T-cells, cytoplasmic 1; TCP: Tricalcium phosphate.
*P<0.05vssham group;#P<0.05vsTCP group;△P<0.05vsprocyadinin (0.2 mg/kg) group;▲P<0.05vsprocyadinin (1 mg/kg) group
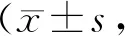
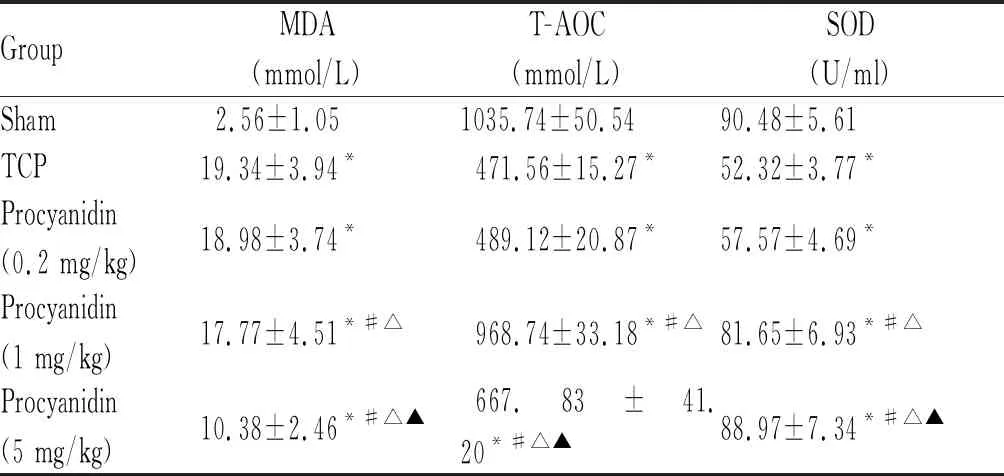
GroupMDA(mmol/L)T-AOC(mmol/L)SOD(U/ml)Sham2.56±1.051035.74±50.5490.48±5.61TCP19.34±3.94*471.56±15.27*52.32±3.77*Procyanidin (0.2 mg/kg)18.98±3.74*489.12±20.87*57.57±4.69*Procyanidin (1 mg/kg)17.77±4.51*#△968.74±33.18*#△81.65±6.93*#△Procyanidin (5 mg/kg)10.38±2.46*#△▲667.83±41.20*#△▲88.97±7.34*#△▲
MDA: Malondialdehyde; T-AOC: Total antioxidation capacity; SOD: Superoxide dismutase; TCP: Tricalcium phosphate
*P<0.05vssham group;#P<0.05vsTCP group;△P< 0.05vsprocyadinin (0.2 mg/kg) group;▲P<0.05vsprocyadinin (1 mg/kg) group
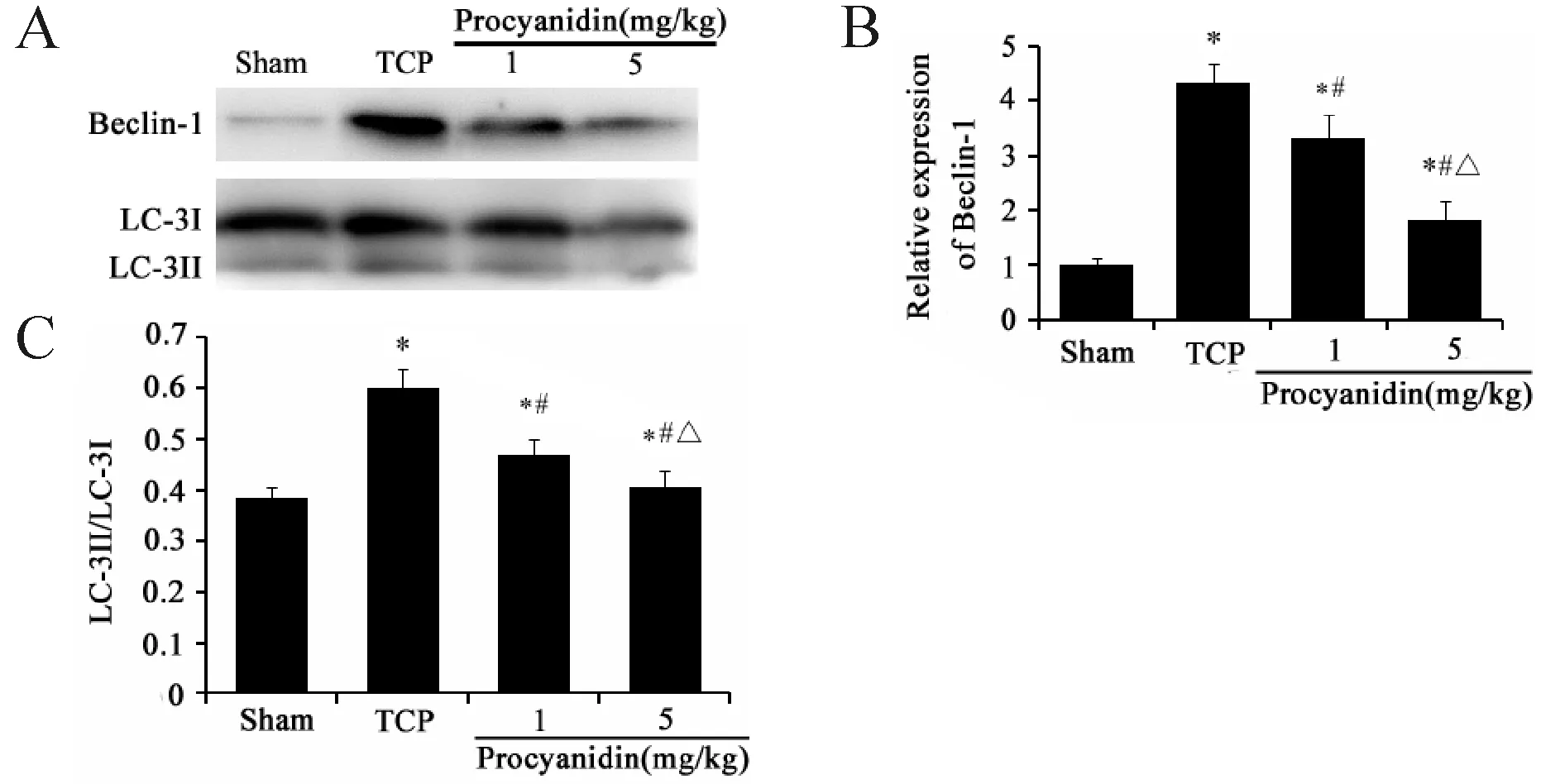
A: Activation of autophagy examined by Western blot; B, C: Densitometric analysis data in Fig. 3A
LC-3: Microtubule-associated protein I/II-light chain 3; TCP: Tricalcium phosphate.
*P<0.05vssham group;#P<0.05vsTCP group;△P< 0.05vsprocyadinin (1 mg/kg) group
3 讨论
人工关节置换常用于治疗严重关节疾病,重建关节功能的重要手段。但是关节假体经过长期磨损、碰撞会产生大量的磨损颗粒包埋于假体周围组织中,这些颗粒可诱导大量炎症因子释放,促进假体周围破骨细胞分化和骨溶解,最终导致关节置换失败和关节翻修[1-4]。目前由于翻修术治疗假体松动其疗效低于初次手术。手术创伤大、价格昂贵等原因,临床上多应用双膦酸盐(阿仑膦酸钠和依班膦酸钠等)抑制假体周围骨溶解,但是这类药物中远期疗效欠佳,而且容易诱发股骨头坏死及心房颤动等。此外,近年也有学者尝试通过基因疗法治疗假体周围骨溶解,并取得一定的效果,然而基因疗法在国内外均处于起步阶段,存在影响范围大、毒副作用不清楚等风险。因此,从天然药用植物中寻找高效、低毒药物抑制假体周围骨溶解和关节松动十分必要。
原花青素是从葡萄籽中分离得到的多酚类化合物,可有效清除多种ROS,具有极强的抗氧化、抗炎、抗肿瘤和降血糖等多方面活性[7-9, 11, 12]。Zhong等[13]研究表明,原花青素可抑制H2O2诱导的成骨细胞氧化损伤而发挥抗骨质疏松作用。本研究应用小鼠颅骨溶解模型进行的实验结果表明,原花青素可明显阻止TCP磨损颗粒可诱导假体周围骨溶解和破骨细胞生成,并呈一定的剂量依赖性,其中高剂量组(5 mg/kg)的抑制作用稍弱于本研究组前期所报道的抗氧化剂N-乙酰-L-半胱氨酸(NAC)对小鼠颅骨溶解的影响[6]。提示:原花青素对TCP磨损颗粒诱导的假体周围骨溶解具有干预作用,并有望成为治疗假体周围骨溶解和关节晚期松动的一种潜在候选药物。
另有报道松动假体周围组织中ROS水平较高,大量的ROS攻击假体周围组织细胞后引起GSH和MDA含量上升,T-AOC含量和SOD活性明显下降,引起氧化应激反应及假体周围骨溶解[5, 6, 14]。本实验结果显示,原花青素可减轻TCP磨损颗粒诱导的氧化应激反应,表现为:与TCP组比较,原花青素组小鼠血清中MDA含量明显减少,T-AOC含量和SOD活性显著增加。另一方面,原花青素含有的多个酚性羟基在体内可被氧化后可释放出H+,竞争性与自由基及氧化产物结合,阻断自由基链式反应[15],使脂质过氧化作用最终分解产物MDA含量明显减少。以上结果进一步证实原花青素具有较好的抗氧化能力,它可通过减轻氧化应激反应实现对TCP磨损颗粒诱导假体周围骨溶解的保护作用。
有研究显示氧化应激能通过耗竭抗氧化物质而引发自噬,促进破骨细胞分化、存活和骨吸收[16, 17],抑制自噬可阻止假体周围骨溶解[18]。2017年胡等[10]报道PC12细胞在缺氧下发生氧化损伤,促进自噬的发生。而自噬作为一种重要的细胞代谢方式,其发生受到自噬标志蛋白Beclin-1和LC-3等的严格调控[19, 20]。Beclin-1是自噬体形成过程中不可或缺的成分,而LC-3则直接参与自噬体的形成。因此,Beclin-1和LC-3蛋白表达上调及LC-3II/LC-3I比值的增加表示自噬水平增强。本研究结果显示,原花青素干预可显著减弱TCP磨损颗粒诱导的自噬,下调Beclin-1和LC-3蛋白表达、减少LC-3I向LC-3II的转换及LC-3II/LC-3I比值,其趋势与原花青素对MDA、SOD和T-AOC等氧化应激相关指标的影响基本一致,这提示原花青素可通过减轻氧化应激、调控自噬而阻止TCP磨损颗粒诱导的假体周围骨溶解。
综上,原花青素可通过减轻TCP磨损颗粒诱导的氧化应激反应和自噬而发挥对假体周围骨溶解和关节松动的干预作用,而原花青素减轻氧化应激和自噬的具体分子机制尚需深入探讨。

