天门冬组织培养研究
杨平飞,罗 鸣,刘 海,宋智琴,张金霞,赵仕娟2,赵明书3,吴明开
(1.贵州省农业科学院现代中药材研究所,贵阳 550006;2.贵州务川绿源中药种植开发有限公司,贵州 务川 564300;3.贵州麻阳河国家级自然保护区管理局,贵州 务川 564300)
天门冬[Asparaguscochinchinensis(Lour.) Merr.]为百合科天门冬属多年生攀援草本植物,别名天冬,以干燥块根入药,是我国传统常用中药材,具有养阴润燥、清肺生津功效,主治肺燥干咳,腰膝酸痛,骨蒸潮热,内热消渴,咽干口渴,肠燥便秘[1]。另外,研究发现,天门冬具有抗肿瘤、抑菌、镇咳祛痰等药理作用[2]。近年来,天门冬野生资源遭到过度采挖,濒临枯竭。随着人们生活水平的不断提高,对天门冬的需求不断增加。天门冬的繁殖方式主要是分株繁殖和种子繁殖,分株繁殖增殖系数较低,成活率受诸多因素影响;种子繁殖发芽率低,整齐度不高,出苗所需时间长,管理费时费工[3]。近年来,各地虽有小规模种植天门冬,但种植技术水平参差不齐,严重制约规模化发展,利用组织培养快繁技术规模化生产种苗势在必行。目前,对天门冬的组织培养快繁技术研究相关报道较少[4-6]。全秒华等研究表明,天门冬嫩芽愈伤组织诱导率最高[4];杨尧军等[5]以羊齿天门冬嫩枝为材料,筛选出了愈伤组织和生根的适宜培养基;潘丽梅等研究表明,以茎段作为外植体进行培养基优化,生根率可达76%[7]。但针对天门冬嫩芽组培研究尚不完善,为进一步完善嫩芽组培技术体系,提高天门冬嫩芽组培各阶段诱导率,本研究基于前人的研究,以天门冬嫩芽为研究材料,开展组培快繁研究,筛选较佳培养基诱导愈伤组织、丛生芽、生根等,旨在为天门冬组织培养和规模生产提供参考。
1 材料与方法
1.1 试验材料
供试材料天门冬由贵州务川绿源中药种植开发有限公司提供,品种为西南天门冬,采用天门冬嫩芽作为组织培养材料。
1.2 试验方法
1.2.1外植体消毒
先将采集的天门冬嫩芽清水冲洗6 h,用无菌滤纸吸干水分。然后于超净工作台进行外植体消毒,依次用0.1%升汞和75%乙醇分别浸泡2 min和5 min,之后用无菌水漂洗5次,最后用无菌滤纸吸干水分。
1.2.2诱导愈伤组织
以MS培养基作为基本培养基,添加不同浓度的6-BA(0.5,1.0,2.0 mg·L-1)和NAA(0.5,1.0,1.5 mg·L-1),琼脂添加量为7.2 g·L-1,蔗糖添加量为30 g·L-1,pH值为5.8。选取大小和长势一致的嫩芽接种到不同激素配比的培养基中,于光照强度1 200 lx、光照时间为12 h/d、温度为(25±2)℃、湿度为30%~50%的组培室里培养30 d,统计诱导数,计算诱导率。
1.2.3诱导丛生芽
以MS培养基作为基本培养基,添加不同浓度的6-BA(0.5,1.0,2.0 mg·L-1)和IAA(0.5,1.0,2.0 mg·L-1),琼脂添加量为7.2 g·L-1,蔗糖添加量为30 g·L-1,pH值为5.8。将培养30 d嫩芽诱导出来的生长一致的愈伤组织分成大小一致的小块,接种到不同激素配比的培养基中,于光照强度1 200 lx、光照时间为12 h/d、温度为(25±2)℃、湿度为30%~50%的组培室里培养30 d,统计分化数,计算分化率。
1.2.4诱导生根
对MS培养基、IBA、NAA 3个因素进行正交设计L9(34)(见表1),琼脂添加量为7.2 g/L,蔗糖添加量为30 g/L,pH值为5.8。将诱导出来的高约0.5 cm丛生芽接种到培养基中,于光照强度1 200 lx、光照时间为12 h/d、温度为(25±2)℃、湿度为30%~50%的组培室里培养30 d,统计生根数,计算生根率。
表1 试验因素及水平

水平因素基本培养基IBA/(mg·L-1)NAA/(mg·L-1)1MS0.50.521/2MS1.01.031/4MS2.02.0
1.3 数据分析
数据统计和分析使用Excel 2003软件和SPSS18.0软件进行。
2 结果与分析
2.1 不同培养基对天门冬愈伤组织的诱导
在植物组培初代培养中,不同浓度的细胞分裂素和生长素组合,影响愈伤组织、不定芽和生根的诱导。从表2知,当处理4中6-BA浓度为1.0 mg·L-1和NAA浓度为0.5 mg·L-1时,愈伤组织诱导数较多,达25个,诱导率达83.33%,且长势较好;以处理3中6-BA浓度为0.5 mg·L-1和NAA浓度为1.5 mg·L-1时,愈伤组织诱导数较少,为6个,诱导率为20.00%,且长势较差;当6-BA浓度不变时,诱导率随NAA浓度的上升而呈下降的趋势。结果表明,MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA为天门冬愈伤组织诱导的较佳培养基。
表2 不同培养基对天门冬愈伤组织的诱导

处理6-BANAA接种个数诱导个数诱导率/%长势10.50.5301446.67++20.51.030930.00++30.51.530620.00++41.00.5302583.33++++51.01.0301550.00+++61.01.5301240.00++72.00.5301240.00++82.01.0301343.33++92.01.5301136.67++
注:长势以“ + ”表示,“ + ”越多表示长得越好。下同。
2.2 不同培养基对天门冬丛生芽的诱导
将愈伤组织接种到丛生芽培养基中培养30 d,有不同长势和数量的丛生芽长出。从表3可知,当处理4中6-BA浓度为1.0 mg·L-1和IAA浓度为0.5mg·L-1时,丛生芽分化数较多,达24个,诱导率达80.00%,且长势较好;以处理6中6-BA浓度为1.0 mg·L-1和IAA浓度为2.0 mg·L-1和处理9中6-BA浓度为2.0 mg·L-1和IAA浓度为2.0 mg·L-1,愈伤组织诱导数较少,均为11个,诱导率均为36.67%,且长势较差;当6-BA浓度不变时,分化率随IAA浓度的上升而呈下降的趋势。结果表明,MS+1.0 mg·L-16-BA+0.5 mg·L-1IAA为天门冬丛生芽诱导的较佳培养基。
表3 不同培养基对天门冬丛生芽的诱导
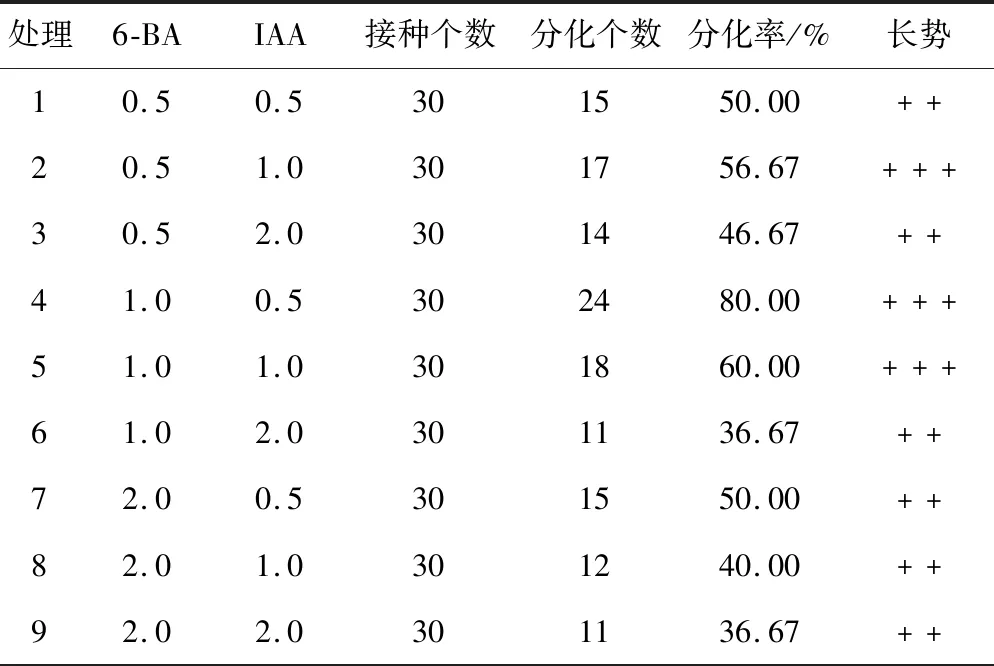
处理6-BAIAA接种个数分化个数分化率/%长势10.50.5301550.00++20.51.0301756.67+++30.52.0301446.67++41.00.5302480.00+++51.01.0301860.00+++61.02.0301136.67++72.00.5301550.00++82.01.0301240.00++92.02.0301136.67++
2.3 不同培养基对天门冬生根的诱导
将丛生芽接种到生根培养基中培养30 d,有不同数量的根长出。对不同处理的天门冬生根率进行极差分析,从表4知,3因素对天门冬生根率影响的大小顺序为:C>A>B。由K值大小可以看出,各因素3水平对生根率影响的主次顺序分别为:A3>A1>A2,B2>B1>B3,C2>C1>C3,天门冬愈伤组织诱导率的最佳组合是A3B2C2,即MS+1.0 mg·L-1IBA+0.5 mg·L-1NAA,与生根率最高(86.6%)的组合A1B2C2不一致,可能是2种生长素(IBA和NAA)相互作用所致,故需对IBA和NAA进行交互效应检验。对IBA和NAA作交互效应检验,如表5所示。IBA*NAA的Sig<0.01,说明IBA和NAA之间对天门冬生根率存在极显著的交互作用。
表4 不同培养基对天门冬生根的诱导
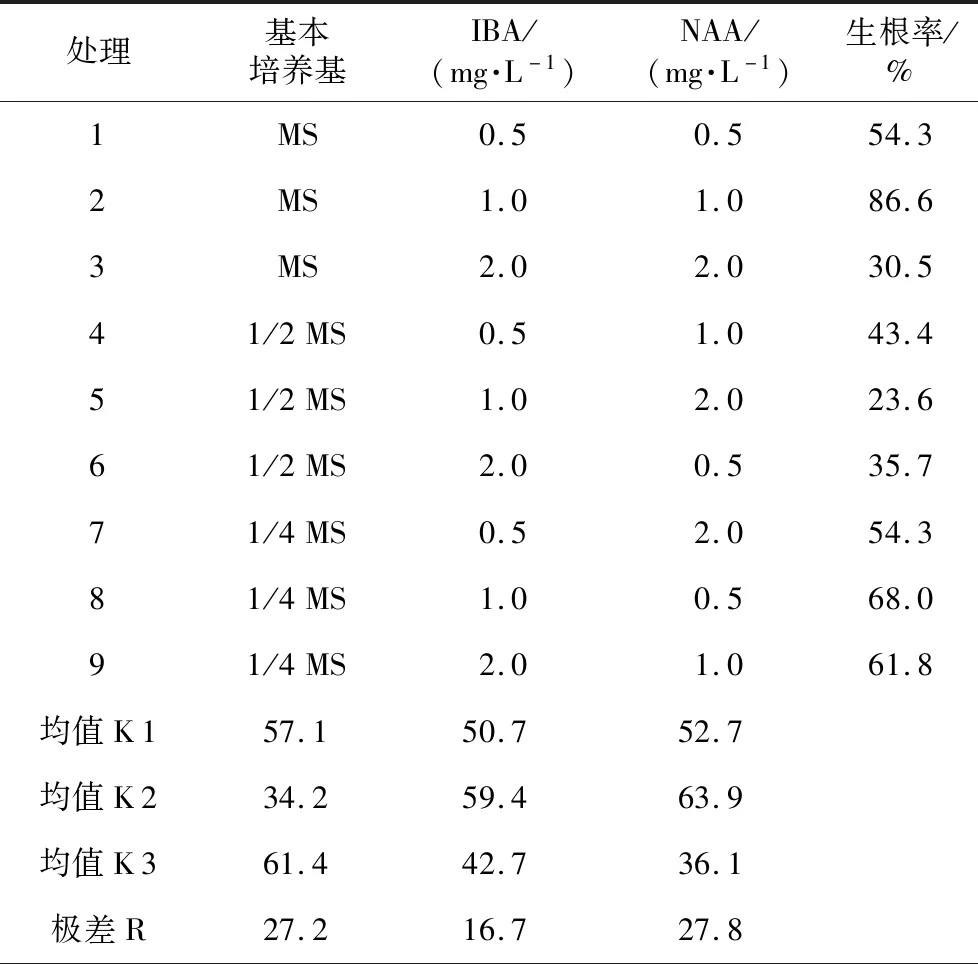
处理基本培养基IBA/(mg·L-1)NAA/(mg·L-1)生根率/%1MS0.50.554.32MS1.01.086.63MS2.02.030.541/2MS0.51.043.451/2MS1.02.023.661/2MS2.00.535.771/4MS0.52.054.381/4MS1.00.568.091/4MS2.01.061.8均值K157.150.752.7均值K234.259.463.9均值K361.442.736.1极差R27.216.727.8
表5 IBA和NAA交互效应检验
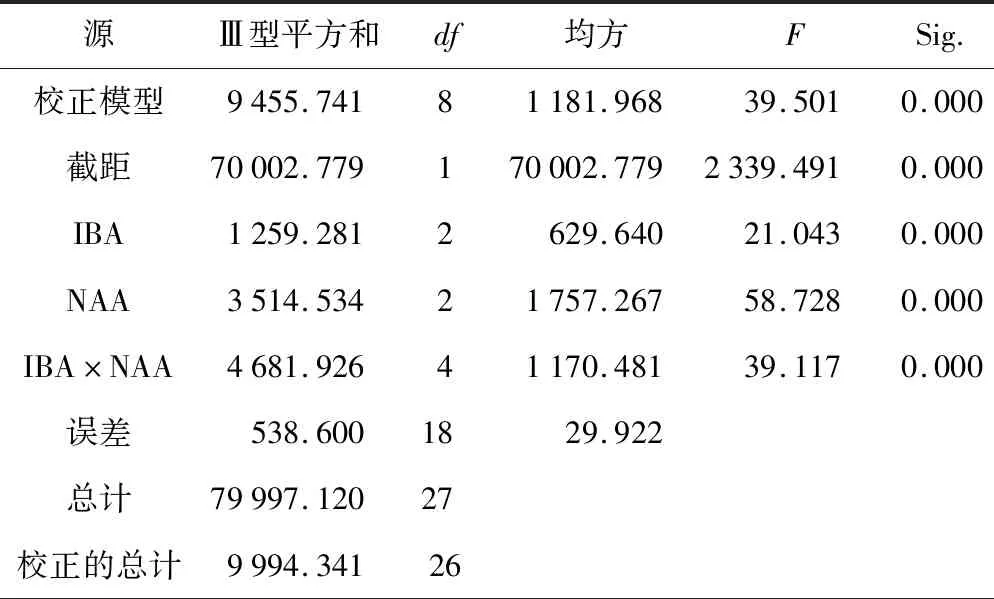
源Ⅲ型平方和df均方FSig.校正模型9455.74181181.96839.5010.000截距70002.779170002.7792339.4910.000IBA1259.2812629.64021.0430.000NAA3514.53421757.26758.7280.000IBA×NAA4681.92641170.48139.1170.000误差538.6001829.922总计79997.12027校正的总计9994.34126
3 结论与讨论
本研究主要以天门冬嫩芽为研究材料,开展天门冬组织培养研究,筛选较佳培养基诱导愈伤组织、丛生芽、生根。结果表明,天门冬愈伤组织诱导较佳培养基为MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA,丛生芽诱导较佳培养基为MS+1.0 mg·L-16-BA+0.5 mg·L-1IAA,生根诱导较佳培养基为MS+1.0 mg·L-1IBA+0.5 mg·L-1NAA,各培养基琼脂添加量均为7.2 g·L-1,蔗糖添加量均为30 g·L-1,pH值均为5.8。
在植物组织培养中起重要作用的激素主要是生长素和细胞分裂素,二者不同浓度配比影响组培各阶段诱导的结果。本研究基于前人研究基础,以天门冬嫩芽为材料开展组培研究。本研究生根诱导率较潘丽梅等[7]研究的76%要高13.95%,说明嫩芽较茎段适宜作为组培外植体;愈伤组织、丛生芽、生根诱导培养基与全妙华等[4]研究的1/2 MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA、MS+1.5 mg·L-16-BA+0.5 mg·L-1IAA、MS+0.5 mg·L-1IBA+0.5 mg·L-1IAA不一致,诱导率略低,长势不均,可能由于贵州和湖南两地天门冬品种间存在一定差异,温度、光照、湿度等培养条件存在差异,试验操作过程中难免会出现一些误差。因此,差异原因将是下一步的研究工作方向。
在药用植物中,有相当一部分种子发芽率低,依传统方式种子育苗或分株繁殖难以满足大规模种植的需求,组培快繁技术是解决这生产难题的重要手段[8-10]。针对天门冬组培研究技术尚不成熟、体系尚不健全的现状,需要更多研究来加强和完善。随着市场对天门冬的需求越来越大,人工规模化栽培势在必行,组培快繁技术的研究和技术体系的建立为解决天门冬野生资源和种苗稀缺、实现规模化生产提供重要技术支撑。

