PEG模拟干旱胁迫下外源生长调节剂对大豆生理生化指标的影响
吴政霖 章有知


摘要:研究了经外源生长调节剂(IAA)处理的大豆[Glycine max (Linn.) Merr.)]幼苗在PEG-6000模拟干旱胁迫下的生理生化的变化。结果表明,干旱胁迫可以显著降低叶绿素a、叶绿素b和总叶绿素含量,IAA处理则显著提高叶绿素a、叶绿素b和总叶绿素含量。干旱胁迫显著增加MDA含量,IAA处理则显著降低MDA含量。干旱胁迫显著降低AsA含量,增加了GSH含量;IAA处理也显著增加GSH含量。干旱胁迫时,大豆体内CAT、SOD、POD、AsA-POD活性均升高,增强了大豆的抗氧化能力。IAA处理则显著增强了SOD、POD、AsA-POD活性。IAA处理可以增强大豆幼苗对干旱胁迫的抵抗能力。
关键词:干旱胁迫;大豆[Glycine max (Linn.) Merr.)];IAA;叶绿素;MDA
中图分类号:S565.1 文献标识码:A
文章编号:0439-8114(2019)06-0016-04
DOI:10.14088/j.cnki.issn0439-8114.2019.06.004 开放科学(资源服务)标识码(OSID):
Abstract: Several physiological and biochemical indexes changes of soybean seedlings treated with exogenous auxin (IAA) under PEG-6000 simulated drought stress were studied. The results showed that drought stress could significantly reduce the contents of chlorophyll a, chlorophyll b and total chlorophyll, while IAA could significantly increase the contents of chlorophyll a, chlorophyll b and total chlorophyll. Drought stress significantly increased MDA content, while IAA significantly decreased MDA content. Drought stress significantly decreased AsA content and increased GSH content; IAA also significantly increased GSH content. Under drought stress, the activities of CAT, SOD, POD and AsA-POD of soybean were increased, and the antioxidant capacity of soybean was enhanced. IAA significantly increased SOD, POD and AsA-POD activity. It is concluded that IAA treatment could enhance the resistance of soybean seedlings to drought stress.
Key words: drought stress; soybean plants [Glycine max (Linn.) Merr.)]; IAA; chlorophyll; MDA
在植物的正常生长过程中,其体内可以利用的水分的多少严重影响植物的生理生化过程[1,2]。因此,干旱是植物生长中最为重要的影响因子之一。此外,植物在遭受干旱胁迫时,体内活性氧的产生与清除之间的平衡被破坏,活性氧的含量升高,从而对蛋白质、核酸和细胞膜等产生氧化性损伤[3,4]。
大豆[Glycine max (Linn.) Merr.)]是东北地区重要的粮食作物和经济作物之一,在生长过程中需要较多的水分。由于气候的变化,东北地区大豆的生长过程中,也经常遭遇阶段性干旱。近年来对大豆干旱胁迫的相关研究发现[5-8],叶绿素含量、丙二醛含量、抗氧化酶活性都一定程度发生改变。为了更为详细地了解干旱胁迫条件下大豆幼苗的生理和生化特征变化,本研究以8% PEG-6000進行模拟干旱胁迫,从叶绿素含量、丙二醛含量、抗氧化物含量以及抗氧化酶活性的变化等方面对大豆幼苗进行研究。此外,正常的生长条件下,生长调节剂调控植物生长和发育等诸多过程[9]。在植物遭受胁迫的环境中,生长调节剂也能改善胁迫环境对植物的损害程度[10,11]。因此,本研究采用0.5 μmol/L IAA对大豆幼苗进行处理,研究了前述指标在IAA处理下的变化情况,以期为大豆栽培提供参考。
1 材料与方法
1.1 材料
以普通黄豆种子为试验材料。选取子粒饱满、大小均一的黄豆种子,均匀种植于装有经去离子水清洗并浸湿的河沙种植盆(长30 cm,宽30 cm,深10 cm,其中河沙深度8 cm)中,6行6列(36颗/盆),塑料薄膜覆盖,种植盆置于光照培养箱内,条件为白天28 ℃、12 h,夜间20 ℃、12 h,光照度800 μmol/(m2·s),相对湿度75%,第二周开始每隔1 d向种植盆内喷洒试验设计中的营养液200 mL。
1.2 试验设计
将“1.1”中培育的黄豆幼苗分为3个处理组:①对照组(CK),以Hoagland全营养液正常培养材料;②PEG-6000处理组(PEG),前两周使用Hoagland全营养液正常培养材料,第三周使用含有8%(m/V,下同)PEG-6000的Hoagland全营养液进行干旱胁迫;③IAA处理组(IAA),第一周还是用Hoagland全营养液正常培养材料,第二周开始使用含有0.5 μmol/L IAA的Hoagland全营养液培养材料,第三周开始用8% PEG-6000的Hoagland全营养液进行干旱胁迫。每个处理设3次重复。分别于PEG处理后0、4、7 d取样测试。
1.3 方法
叶绿素(叶绿素a、叶绿素b和总叶绿素)含量的测定采用乙醇浸提法[12]。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(AsA-POD)活性等抗氧化酶的提取和活性测定以及丙二醛(MDA)含量的测定参考文献[12]。
还原型抗坏血酸(AsA)和还原型谷胱甘肽(GSH)等抗氧化物的含量测定采用Solarbio试剂盒。测定方法严格按照试剂盒说明书进行。AsA和GSH含量按样本质量计算。
1.4 仪器与试剂
仪器:UV-mini 1240型紫外可见分光光度计,Sartorius BS124S型电子分析天平,上海精宏GZP-250型光照培养箱。
试剂:所用试剂均为分析纯。
2 结果与分析
2.1 PEG模拟干旱胁迫下外源生长调节剂对大豆叶绿素含量的影响
在0 d时,3个处理组的大豆叶绿素a含量没有明显差异。4、7 d时,对照(CK)组的叶绿素a含量最高,遭受干旱胁迫的PEG组和IAA组都较低,PEG处理组的叶绿素a含量最低,IAA处理组则高于PEG处理组,处理间差异显著。在0 d时,各处理大豆叶绿素b含量的大小顺序为IAA、PEG、CK。在4、7 d时,对照(CK)组的叶绿素b含量最高,遭受干旱胁迫的PEG组和IAA组都较低,且叶绿素b含量IAA处理组高于PEG处理组,各处理间差异显著。对总叶绿素含量而言,在0 d时,3个处理组没有明显差异。在4、7 d时,对照(CK)组的总叶绿素含量最高,遭受干旱胁迫的PEG组和IAA组都较低,且总叶绿素含量IAA处理组高于PEG处理组,各处理间差异显著。
2.2 PEG模拟干旱胁迫下外源生长调节剂对大豆丙二醛含量的影响
在0 d时,IAA处理组的大豆MDA含量最低,各处理组间无显著差异。4、7 d时,遭受干旱胁迫的PEG组和IAA组都具有较高的MDA含量,且随着胁迫时间的延长,MDA含量呈明显的增加趋势。另外,IAA处理组较PEG处理组具有较低的MDA含量,各处理间差异显著。
2.3 PEG模拟干旱胁迫下外源生长调节剂对大豆抗氧化物含量的影响
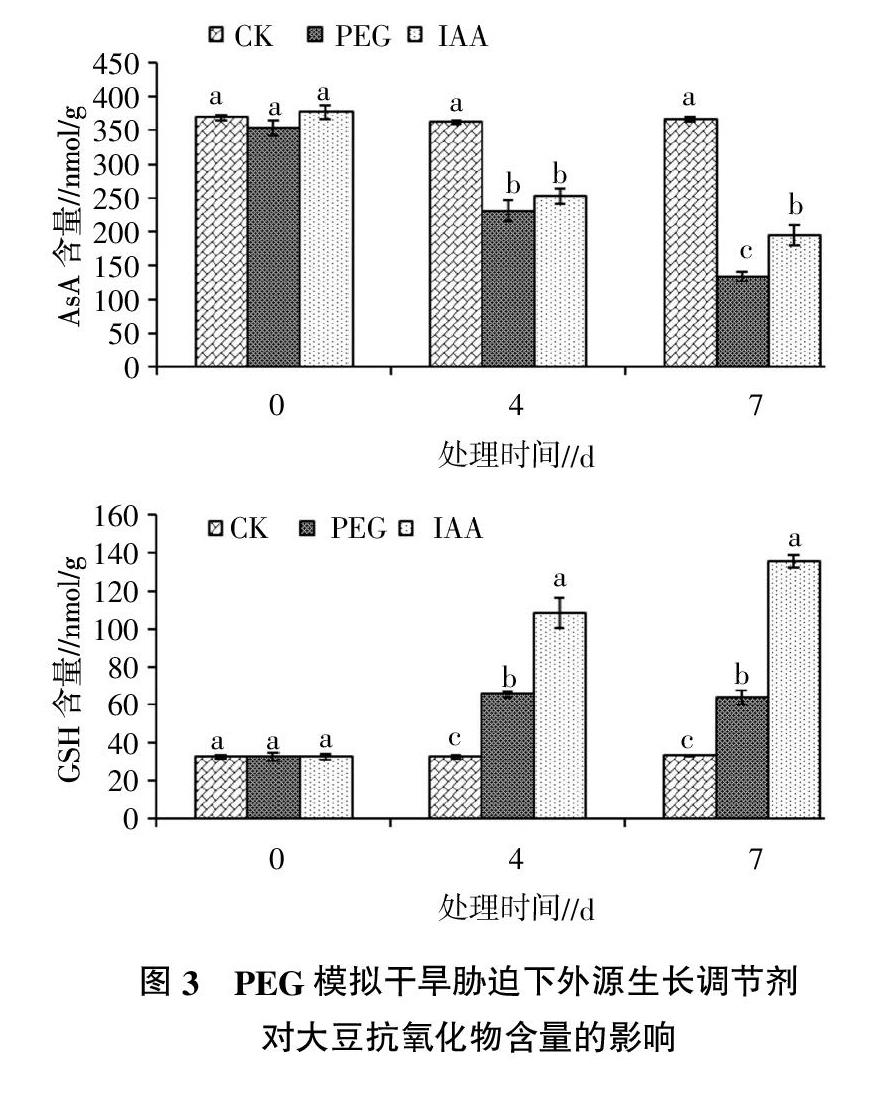
在0 d时,3个处理组的大豆AsA含量没有显著差异。4、7 d时,遭受干旱胁迫的PEG组和IAA组都具有较低的AsA含量,且随着胁迫时间的延长,AsA的含量呈明显的降低趋势。在7 d时,IAA处理组和PEG处理组间大豆AsA含量有显著差异。
在0 d时,3个处理组的大豆GSH含量没有显著差异。4、7 d时,遭受干旱胁迫的PEG组和IAA组都具有较高的GSH含量,且随着胁迫时间的延长,GSH的含量呈明显的升高趋势,IAA处理组较PEG处理组有较高的GSH含量,二者差异显著。
2.4 PEG模拟干旱胁迫下外源生长调节剂对大豆抗氧化酶活性的影响
在0 d时,3个处理组的大豆CAT活性没有显著差异。4、7 d时,遭受干旱胁迫的PEG组和IAA组都具有较高的CAT活性。随着干旱胁迫时间的延长,7 d时PEG处理组的CAT活性显著高于其他2个处理。
在3个测定时间内,IAA处理组的SOD、POD、AsA-POD活性均为最高。4、7 d时,遭受干旱胁迫的PEG组和IAA组都具有较高的SOD、POD、AsA-POD活性,且3个处理间差异显著。随着胁迫时间的延长,SOD、POD、AsA-POD活性均有增加的趋势。
3 讨论
3.1 叶绿素和丙二醛含量的变化
干旱胁迫降低了大豆幼苗中叶绿素a、叶绿素b和总叶绿素的含量。随着胁迫时间的延长,叶绿素a、叶绿素b和总叶绿素的含量都呈降低的趋势,说明干旱胁迫下,大豆幼苗的叶绿体结构受到严重破坏,叶绿素含量显著降低。经IAA处理的大豆幼苗,叶绿素a、叶绿素b和总叶绿素的含量都高于PEG处理组,表明IAA处理可以减轻干旱胁迫对大豆幼苗的损伤程度。植物体内叶绿素的含量与植物本身的光合作用作用关系密切,叶绿素含量高的植物,其光合作用速率较高[13,14]。表明干旱胁迫时,大豆幼苗的光合作用效率显著降低,IAA处理可以提高大豆幼苗的光合作用效率,增强其对干旱胁迫的抵抗能力。
MDA是膜脂被过氧化物或者超氧化物氧化的产物,当植物体内过氧化物或超氧化物的大量積累时,MDA的含量增加[15]。对照组(CK)在3个测定时间的MDA含量基本保持不变,说明在对照组(CK)中,MDA的含量处于相对平衡的状态。干旱胁迫时,MDA的含量显著升高,IAA处理一定程度上降低了植物体内MDA的含量,说明IAA处理可以减轻膜脂的过氧化程度。
3.2 抗氧化物含量和抗氧化酶活性的变化
AsA作为植物体内的还原剂,在植物体内可以与过氧化物和超氧化物等活性氧起反应,从而降低活性氧的含量,减轻活性氧对植物的损伤。此外,AsA也参与植物体内光合结构的保护[16]和衰老调控[17]。对照组在3个测定时间的AsA含量也基本维持不变,说明在大豆幼苗的生长阶段,体内AsA含量达到了平衡状态。PEG处理组中,AsA含量显著降低,且随着时间延长,降低的程度越来越大。IAA可以增加AsA的含量,表明IAA提高了大豆幼苗对活性氧的抵抗能力,增强了对光合结构的保护,这也可能是IAA处理组中叶绿素含量高的原因。
GSH也是植物体内重要的活性物质,可以清除植物体内的自由基,减轻自由基对植物体的伤害[18]。对照组在3个测定时间GSH含量变化较小,说明在大豆幼苗的生长阶段,体内GSH含量同样也维持在平衡状态。PEG和IAA处理组中,GSH含量显著升高,说明GSH受干旱胁迫和IAA进行上行调节。植物感知环境的变化,从而使GSH水平进行上行调节,保证GSH和AsA在环境胁迫下紧密的共同调节作用[19]。就抗氧化物AsA和GSH 而言,随干旱胁迫时间的延长,AsA呈降低的趋势,GSH呈增加的趋势。因此,通过对大豆幼苗AsA和GSH含量的调节,使其维持了整个植物体内抗氧化物质含量处于较为稳定的水平。
CAT、SOD和POD是植物体内主要的抗氧化酶。CAT可以催化过氧化氢的分解反应,是植物体内抗氧化防御机理之一。CAT活性的增强可能是植物对过氧化氢产生的一种适应性反应,增加了过氧化氢的清除速率,从而提高了植物的抗胁迫能力。SOD是生物体内清除自由基的首要酶类。POD具有消除过氧化氢、酚类、胺类、醛类和苯类毒性的作用。PEG处理组中,CAT,SOD和POD活性在3个测定时间基本呈升高的趋势,从而保证干旱胁迫下对大豆幼苗体内有害物质的有效清除。同时,IAA可以显著提高SOD的活性,表明IAA处理后对自由基清除的作用可能较为突出。特别地,对于AsA-POD,干旱胁迫也促进其活性的增加。IAA处理也可以显著提高AsA-POD的活性。
4 小结
IAA处理可以减轻大豆幼苗遭受的干旱胁迫,具体表现在可以显著提高叶绿素a、叶绿素b和总叶绿素的含量,减轻干旱胁迫对叶绿素的降低作用;可以显著减轻膜脂的过氧化程度,降低MDA的含量;可以显著提高抗氧化物AsA和GSH的含量,增强大豆幼苗的抗氧化能力;可以显著提高SOD、POD和AsA-POD活性。
参考文献:
[1] HENDRY G A F. Oxygen free radical process and seed longevity[J].Seed science research,1993,3:141-153.
[2] 李 伟,曹坤芳.干旱胁迫对不同光环境下的三叶漆幼苗光合特性和叶绿素荧光参数的影响[J].西北植物学报,2006,26(2):266-275.
[3] ASADA K. Production and action of active oxygen in photosynthetic tissue[M].Boca Raton:CRC press,1994.
[4] MOLLER I M,JENSEN P E,HANSSON A. Oxidative modifications to cellular components in plants[J].Annual review of plant biology,2007,58:459-481.
[5] 高 蕾,刘丽君,董守坤,等.干旱胁迫对大豆幼苗叶片生理生化特性的影响[J].东北农业大学学报,2009,40(8):1-4.
[6] 蒲伟凤,李桂兰,张 敏,等.干旱胁迫对野生和栽培大豆根系特征及生理指标的影响[J].大豆科学,2010,29(4):615-622.
[7] 董兴月,林 浩,刘丽君,等.干旱胁迫对大豆生理指标的影响[J].大豆科学,2011,30(1):83-88.
[8] 纪展波,蒲伟凤,李桂兰,等.野生大豆、半野生大豆和栽培大豆对苗期干旱胁迫的生理反应[J].大豆科学,2012,31(4):598-604.
[9] 吕 剑,喻景权.植物生长素的作用机制[J].植物生理学通讯,2004,40(5):624-628.
[10] 张会灵,吴正景,郭大龙,等.IAA和SA对盐胁迫下萝卜幼苗生理特性的影响[J].北方园艺,2017(8):32-34.
[11] 李亚萍,彭 燕.IAA改善PEG处理下白三叶幼苗叶片抗氧化保护和渗透调节能力[J].草业科学,2017,34(11):2295-2302.
[12] 孔祥生,易现峰.植物生理学实验技术[M].北京:中国农业出版社,2008.
[13] 徐惠风,刘兴土,金研铭,等.向日葵叶片叶绿素和比叶重及其产量研究田[J].农业系统科学与综合研究,2003,19(2):94-97.
[14] HUSEYNOVA I M. Photosynthetic characteristics and enzymatic antioxidant capacity of leaves from wheat cultivars exposed to drought[J].Biochim biophys acta,2012,1817:1516-1523.
[15] 杜润峰,郝文芳,王龙飞.达乌里胡枝子抗氧化保护系统及膜脂过氧化对干旱胁迫及复水的动态响应[J].草业学报,2012, 21(2):51-61.
[16] TOTH S Z,SCHANSKER G,GARAB G. The physiological roles and metabolism of ascorbate in chloroplasts[J].Physiol plant,2013,148:161-175.
[17] FOTOPOULOS V,KANELLIS A K. Altered apoplastic ascorbate redox state in tobacco plants via ascorbate oxidase overexpression results in delayed dark-induced senescence in detached leaves[J].Plant physiol biochem,2013,73:154-160.
[18] ZETTERSTROM R,EIJKMAN C,SIR HOPLINS F G. The dawn of vitamins and other essential nutritional growth factors[J].Acta paediatrica,2006,95(11):1331-1333.
[19] 杜 琳,張 荃.植物谷胱甘肽与抗氧化胁迫[J].山东科学,2008,21(2):27-32.

