“电解质”迷思概念的探查与转变方式研究
钟思敏
(吉林师范大学 136000)
迷思概念是指存在于学生头脑之中,与科学概念不符的认识.它的存在具有隐蔽、顽固性等特点,影响着学生对科学概念的理解,使学生在学习过程中不知所错,亦不知为何错.在学科教育中,越来越多的学者关注并对其进行研究,其中物理、化学、生物等理科性学科研究尤为深入,也得出了一些相应的概念转变策略,如PDODE策略、认知冲突策略等.
电解质内容是高中化学必修一第二章第二节的内容,是学习离子反应的基础,且在化学选修四《化学反应与能量》中第三章电离水解平衡的要求对强弱电解质有更进一步的理解.对电解质的理解与掌握程度会直接影响学生对后续离子反应及相应水解平衡的学习.然而,初中所学酸碱盐溶液能导电对高中阶段电解质知识的学习仅仅是一个简单的铺垫过渡,基础一般的同学对于溶液导电的认识几乎处于空白状态,并且电解质内容较细,学习时也不能靠死记硬背.
电解质的学习内容主要包括三大类:定义(即判断),强弱电解质,电离方程式的书写.电解质定义即在水溶液或熔融状态下能导电的化合物.首先从上一章节分类的观点出发,将电解质牢牢归属于化合物的范围之内,包括酸,碱,盐,部分金属氧化物(熔融状态).其次,导电是由于电离产生的自由移动的离子.再次,水溶液或熔融状态二者选一即可.一句话四个关键词一个重点字,围绕电解质由宏观世界转向微观世界,其中的微观现象肉眼无法可见,只能通过表面现象去演化推算.强调重点在于:电离是本质,导电是现象.
一、迷思概念的探查
1.主次不分
在与学生的交流中,笔者发现存在的迷思概念有:主次不分,认为一个物质如果不是电解质那就应该是非电解质.而存在的迷思概念的原因可能在于,上课期间老师对非电解质含义一笔带过,或者非电解质仅仅强调在水溶液和熔融状态下的“和”字,对于物质如氧气不导电那就会迷惑,下意识看到有非电解质的空就选填上了.在电解质判断上,对于给定的物质,首先应下意识观察其是否为化合物,其次再去判断是否导电的问题.因此,这一类问题的关键在于分清主次,在延续上一章节分类的观念时乘热打铁强调为进一步学习的需要,对化合物进行分类.在判断物质属于化合物的基础上,再对电解质和非电解质进行分析.
2.因果倒置
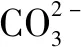
3.知识的错误迁移
学生在强弱电解质的判断还存在的迷思概念有:知识的错误迁移.关于强弱电解质的判断,对于酸的判断明显优于碱,提到弱碱脑海中只有NH3·H2O,部分学生对氢氧化铜和氢氧化镁的弱碱性认识还不足.有学生对知识进行错误的迁移,认为BaSO4和CaCO3作为难溶性物质,溶于水的那一部分是完全电离,属于强电解质,直接的认定沉淀都属于强电解质,Mg(OH)2以及Cu(OH)2是强电解质.当然也存在部分教辅资料不全面,学生太过于依赖教辅没有注重总结积累的结果.电解质的强弱是由物质内部的结构决定的,与外界因素无关.如盐的溶解度大小不是强弱电解质判断的依据.然而学生并不了解物质的内部结构,为什么硫酸就是完全电离,醋酸就是部分电离,教师要想解释清楚时间安排不允许,学生的理解能力也不足.因此,对于强弱电解质的判断唯一的方法就是通过做题积累,例如化学方程式书写进行书写与练习对比.
在平时的练习题讲解中,对电解质本质的理解尤其是酸碱盐的知识反复多次的进行训练,对于主次及因果关系的讲解围绕主要点,从原因本质出发,由里向外的延展,完全电离在前强电解质定义在后,电解质的强弱是由物质的内部结构决定的,与外界因素无关,盐的溶解度大小与强弱电解质的判断无关,并且强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,溶液的导电能力与电解质的强弱没有必然的联系,只取决于溶液中自由移动离子的浓度和所带电荷数.电离才是核心的本质,导电只是外部表现出来的现象.
在学生的实际练习题中会遇到需要单独记忆的特殊情况,如CO2、SO3,其水溶液能够导电,但不是化合物自身电离,而是它们与水反应的产物发生的电离,
在离子方程式中,存在物质拆与不拆的问题,弱电解质在水溶液中属于部分电离,反应物中能拆离子在不断的生成更难电离的物质,弱电解质在生成物中是相对于反应物更难电离的存在,因此不可以拆.由此当遇到这样一个题目时:
判断下列哪个物质属于电解质( ).
A.NaOH固体溶于水后能导电,所以NaOH溶液是电解质
B.CO2的水溶液能够导电,所以C02是电解质
C.NH3不是电解质,氨水可以导电是电解质
D.CaCO3难溶于水,其溶液几乎不导电所以不是电解质
E.NaCl晶体不导电,NaCl是电解质
F.Cu是可以导电的,因此Cu是电解质
这个题目考察的是对电解质定义的理解, A、C、F选项是对关键词中化合物的考察NaOH溶液、氨水属于混合物,Cu属于单质.B、D则是属于需要理解实质性的电离含义,电离是本质物质在水作用下自身产生自由移动的带电离子,CO2是溶于水,与水反应的产物碳酸导电,不属于自身的原因造成的导电,CaCO3难溶不代表完全不溶,少部分溶于水的CaCO3是完全电离的存在.E是对物质的所处状态的探析,NaCl的水溶液能导电,熔融状态的晶体也能导电,满足要求的是物质所处的状态.因此,只有在对电解质定义理解深刻后才能保证正确率的.
对于电解质的判断:可以通过以下流程图进行理解:

二、概念的转变方式
由此,关于电解质存在的迷思概念主要有主次不分,因果倒置、知识的错误迁移等.针对上述存在的迷思概念,笔者认为可以通过两种方式进行概念的转变.
1.化学史引入
对于电解质的研究,开始于法拉第时代,法拉第在研究电解反应时,把电解以前未被分解的物质叫做电解质(electrolyte),认为它是一种能够被电流分解的物质.他还认为,溶液中的电流是由带电荷的被分解的物质输送的,这种物质叫做离子,它的含义是被电流分解出来的物质.但这样的认识是不足片面的.随着科学家的进一步研究,特别是阿累尼乌斯通过研究发现在通电以前,电解质就已经在水溶液中离解了.电离并不需要电流,但由于历史原因电解质这个名词被保留了下来,并一直沿用至今.就像铅笔的主要成分是石墨,因为最初铅笔是由铅制作的,其名称未改变一直延续下来.因此,让学生理解电解质的缘由,能更好的帮助他们理解电解质这个名词.
2.学生实验探究
电离并不需要电流的参与,电离产生的条件又是什么呢?
这时,可以让学生对电解质的电离内容进行活动探究,寻找原因,例如:
①Ba(OH)2少量固体,放入盛有水的烧杯中,观察前后水的pH变化将新制的HCl 气体通入水中后,观察前后水的pH变化.
②取2支相同的试管,加入等量BaCl2固体,加入相同量的水.其中一只试管滴加加入硝酸酸化的硝酸银溶液,观察反应现象:另一只试管滴加稀硫酸溶液,观察反应现象.
③取2支相同的试管,加入等量BaCl2溶液(由①中Ba(OH)2溶液和②中盐酸反应制得)其中一支试管滴加加入硝酸酸化的硝酸银溶液,观察反应现象:另一支试管滴加稀硫酸溶液,观察反应现象.
通过上述实验的探究,酸、碱、盐在水的作用下发生电离,产生自由移动的离子.通过实践发现电离的真相,理解电解质的真实定义.
3.互联网“+”微课
互联网+时代,相信大部分老师都掌握对于PPT的使用,因此在利用office软件中PPT自带的动画效果基础上,年轻教师可以尝试接触微课的设计,利用Focusky,EVC 手绘或相应动画剪辑软件等,将微观粒子的不可视离子反应,用“可视化”动画效果的间接展示,比起板书上一笔一划的文字会更让学生感兴趣,例如在NaCl溶于水的过程环节,适当加入一些动画及声音的特效.就同一信息的接受程度而言,文字的接受程度小于图片及视频接受程度.同时视频使学生更易理解电离的实质,方便后续离子反应教学的进行.其次每个教师对于动画的表现形式都可以是不一样的,在与学生互动交流中可以根据学生的脑海中关于电离的理解想象进行制作动画或者短视频编辑.
高中阶段关于强弱电解质的分类条数对于该阶段的学生而言,是存在一定困难的,综合来看,电解质知识点细又多教辅书知识点收录不全,多数为易错点提醒分析,学生注意平时添砖加瓦的积累,务实打基础,考试时才不会出现分数忽高忽低的情况.最后决定电解质学习的好坏,就是本质的理解加日常的积累.迷思概念的存在也是在理解不到位的基础上滋生出来的,如果教师不及时发现,它就会越发的牢固扎根学生头脑之中,影响学生对正确科学概念的理解,因此,希望大家能对电解质迷思概念引起重视,将问题消灭在萌芽状态.

