12/15-脂氧合酶通过15-HETE/PPARγ途径减轻大鼠脑缺血再灌注损伤
王永健 王海军 于洋 李瑞卿 张嘉伟
(齐齐哈尔医学院附属第一医院神经内科,黑龙江 齐齐哈尔 161041)
脑缺血再灌注损伤能够引起脑部更加严重的功能障碍,并且随着不断实施的溶栓治疗,脑缺血再灌注损伤的危害愈发明显。脑缺血再灌注后能够引起一系列病理损伤,包括中心区脑神经元坏死、神经元凋亡及去极化、氧自由基的产生等〔1〕。氧自由基的产生是导致氧化应激损伤的重要原因,而体内一些酶的代谢产物能够介导炎症及氧化应激损伤〔2〕。
12/15-脂氧合酶可氧化花生四烯酸和亚油酸分别生成12-羟基二十碳四烯酸(HETE)、15-HETE、13-羟基十八碳二烯醇(HODE)等产物〔3〕,而这些产物能够激活过氧化物酶体增殖物激活受体(PPAR)γ〔4〕。研究发现,缺血再灌注损伤可显著诱导脑组织PPARγ表达和核移位增加〔5〕。同时,PPARγ激活可减小脑梗死体积,降低炎性介质细胞间黏附分子-1、白介素-1β、环氧合酶-2 等的表达〔6〕,说明脑缺血引起的PPARγ表达和活性增加可能是机体对于损伤的一种保护性反应。然而,激活PPARγ的内源性物质并不明确。有研究证明,15-HETE 在人血管平滑肌细胞、成纤维细胞中也可激活PPARγ,同时增加PPARγ mRNA水平〔7〕。 然而在脑内是否由于12/15-脂氧合酶的代谢产物如15-HETE激活了PPARγ,进而降低脑缺血再灌注损伤并不明确。本文拟对可能的机制进行探讨。
1 材料与方法
1.1试剂及器材 15-HETE 购于美国 Biomol 公司;聚氰基丙烯酸正丁酯(BCA)蛋白浓度定量试剂盒购自碧云天生物试剂有限公司;PPARγ抗体购自美国Santa Cruz Biotechnology公司;12/15-脂氧合酶抗体购自美国Cayman Chemical公司;二抗为相应辣根过氧化物耦联的抗体,购自美国Santa Cruz Biotechnology公司;其他试剂均为市售分析纯。线栓购自北京西浓科技有限公司,Molecular Imager ChemiDoc XRS+System 曝光仪为美国Bio-Rad公司产品。
1.2模型制备 SPF级SD雄性大鼠90只,体重200~220 g,购自齐齐哈尔医学院。线栓法制备大鼠大脑中动脉梗阻缺血60 min再灌注24 h模型(MCAO/R)。主要步骤:大鼠术前12 h 禁食,但不禁水,4%水合氯醛麻醉后固定于手术台上,取颈部正中切口2 cm,锐性分离颈前正中肌群,分离辨认左侧颈内动脉、颈外动脉后结扎离断颈外动脉,将0.22 mm硅胶线栓缓慢插入约10 mm,同时开始记录缺血时间。 阻断60 min后缓慢拔出线栓恢复血流再灌注,缝合手术切口。大鼠苏醒后自由饮水和进食。以缺血对侧肢体瘫痪为模型成功的标志。大鼠随机分为3组(n=30)。假手术组仅手术暴露、分离颈总、颈内及颈外动脉,不插入线栓;模型组制备MCAO/R模型,在缺血前30 min右侧脑室注入与干预组相同体积的磷酸盐缓冲液(PBS);干预组制备MCAO/R模型,缺血前30 min右侧脑室注入15 μl的15-HETE。 所有动物于模型制备成功24 h后处死。
1.3总蛋白提取 取缺血侧脑皮质进行蛋白提取和分离。处死后的大鼠取全脑,分离脑皮质,置于-80℃冰箱保存。 将不同组的脑皮质50 mg置于500 μl的放射免疫沉淀实验(RIPA)细胞裂解液中,低温匀浆,12 000 r/min离心,取上清液,用BCA蛋白浓度定量试剂盒进行定量分析。蛋白变性后,于-20℃冰箱中保存。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离目的蛋白,将蛋白转印至聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉常温封闭2 h,4℃孵育一抗(1∶1 000)、过夜,吐温20-Tris盐酸缓冲液(TBST)洗3次,每次10 min,常温孵育二抗1 h,TBST洗3次,每次10 min,显色试剂盒进行显色,Imagelab软件进行灰度分析。
1.4Real Time-PCR 取缺血侧脑皮质进行 mRNA提取和分离。定量称取100 mg脑皮质置于1 ml TRIzol中匀浆提取总RNA。通过测定260、280 nm吸光度测定RNA浓度。取500 ng总RNA 通过PrimeScript RT reagent 试剂盒进行逆转录反应。通过SYBR Premix EX Taq试剂盒进行荧光定量反应。12/15-脂 氧合酶上 游 引 物 序 列 5′-TGGGTTCAGGGCAGAAGCAT-3′,下游引物序列5′-GCGGGCAGGAAGACAAGTAGAG-3′ 。PPARγ上游引物序列5′-GTGCCAGTTTCGATCCGTAGA-3′,下游引物序列5′-GGCCGACATCGTGTAGTAGA-3′。内参 GAPDH 上游引物序列 5′-AGAACATCATCCCTGCATC-3′,下 游 引 物 序列 5′-TGGATACATTGGGGGTAGG-3′。实验数据分析采用 2-ΔΔCt方法。
1.515-HETE含量检测 使用Assay Design公司的15-HETE酶联免疫吸附试验(ELISA)试剂盒对脑组织中15-HETE的含量进行测定,按试剂盒说明书进行操作。
1.6统计学处理 采用SPSS13.0 软件行单因素方差分析。
2 结 果
2.1脑缺血再灌注损伤后12/15-脂氧合酶表达水平变化 模型组12/15-脂氧合酶基因表达水平(1.27±0.07)明显高于假手术组(1.01±0.13),24 h基因水平升高了27%。与基因水平结果类似,与空白组蛋白水平(1.01±0.04)相比,模型组12/15-脂氧合酶蛋白表达(1.32±0.21)明显升高,24 h蛋白水平提高了30%。见图1。
2.2脑缺血再灌注损伤后15-HETE含量变化 与假手术组(2.69±0.32)相比,模型组15-HETE在脑内的水平(3.85±0.28)提高了43%,说明蛋白表达的变化引起了酶功能的改变。
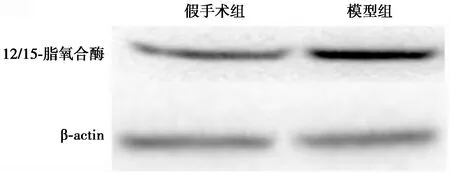
图1 假手术组和模型组脑内12/15-脂氧合酶表达
2.3脑内PPARγ含量的变化 与假手术组(1.05±0.03)相比,模型组脑内PPARγ基因表达(1.26±0.09)明显增加,增加了20%。与基因水平结果类似,与空白组PPARγ蛋白水平(1.17±0.13)相比,模型组PPARγ蛋白水平(1.58±0.16)增加了35%,说明脑缺血再灌注损伤能够造成PPARγ在基因和蛋白水平的激活。见图2。
2.4脑内注射15-HETE后PPARγ表达变化 脑内注射15-HETE后,与模型组PPARγ基因水平(1.08±0.05)和蛋白水平(1.63±0.15)相比,干预组PPARγ在基因和蛋白水平表达明显升高,PPARγ在基因水平(1.24±0.11)提高了15%,在蛋白水平(2.20±0.27)提高了30%。见图3。

图2 假手术组和模型组脑内PPARγ表达

图3 干预组和模型组脑内PPARγ表达
3 讨 论
缺血性脑病致死和致残率均较高,是脑血管病中主要的一种类型,缺血区血流的再灌注可引起脑组织损伤及相关功能障碍即脑缺血再灌注损伤〔8〕。缺血再灌注损伤能够引起脑内氧化应激的改变进而引起神经元凋亡〔9〕。脑内氧化应激基因水平的改变是机体的一种保护机制,也为临床治疗提供了新的靶点。花生四烯酸和亚油酸代谢通路是典型的氧化应激反应通路〔10〕。12/15-脂氧合酶能够催化花生四烯酸和亚油酸产生15-HETE等生物活性物质,参与脑损伤的病理过程。同时,PPARγ与氧化应激反应密切相关,而且,PPARγ激活能降低脑损伤程度,如减少脑损伤面积。PPARγ激活剂罗格列酮可减轻继发性脑损伤,并且对神经元有保护作用〔11〕。
本研究结果说明12/15-脂氧合酶参与了缺血再灌注损伤的过程。吴国建等〔2〕也发现,创伤性脑损伤后12/15-脂氧合酶的表达明显升高。本研究结果表明,造模后脑内15-HETE的含量明显增加,说明12/15-脂氧合酶在蛋白水平的变化引起了其功能改变;而PPARγ能被进一步激活,说明调节内源性生物活性物质能够激活PPARγ,也为脑缺血再灌注损伤的治疗提供了新的思路。

