外源性c-di-GMP影响口腔变形链球菌生物膜形成
康佳 付甜 王一席 胡红梅
(井冈山大学医学部 1口腔系,江西 吉安 343000;2组胚教研室)
龋病是在以细菌为主的多种因素的作用下发生的牙体硬组织慢性进行性破坏疾病,变形链球菌是世界公认的依赖于生物膜生存的主要致龋菌〔1〕,这种细菌因为能适应不断变化的口腔微生物环境而成为牙菌斑的主要组成菌之一。它主要通过对牙面的黏附、凝聚形成牙菌斑生物膜,在生物膜的内部充分利用碳水化合物产酸并具有一定的耐酸能力从而发挥致龋毒力〔2〕,使局部pH下降,从而造成牙釉质脱矿,龋病病变过程开始。如果能够抑制变形链球菌的生物膜形成,则可以在一定程度上降低或预防龋病的发生。本实验拟检测外源性的环鸟苷二磷酸(c-di-GMP)对变形链球菌的生长情况及生物膜形成能力的影响。
1 材料和方法
1.1主要试剂和仪器 c-di-GMP(无内毒素污染,生物学活性检测,无菌,美国InvivoGen公司,产品编号:CGP-38-01)。溶于无内毒素水中,制备成0.908 mmol/L储存液,-20℃冰箱保存备用。厌氧培养箱(规格型号:Y9X-TT,上海新苗医疗器械制造有限公司)。酶标仪(Imark,上海伯乐生命医学产品有限公司 )。
1.2方法
1.2.1变形链球菌的分离及培养 受试者用清水漱口,采用口镜、探针从受试者全口牙间隙、龈缘,尤其是牙面龋坏部位取牙菌斑,取样放置入磷酸盐缓冲液(PBS)中,采用超声震荡5~10 s分离细菌和食物残渣,吹打,形成悬浊液,采用接种环将菌液接种于液体脑心浸液肉汤琼脂(BHI)固体平板中,画线,37℃厌氧培养(90%N2,10%CO2)48 h,得到平板菌落形态(图1),采用接种环挑取菌落,接种至液体BHI培养基中,37℃厌氧培养(90%N2,10%CO2)24 h,得到浑浊菌悬液,取菌悬液进行细菌涂片革兰染色观察细菌形态(图2)。
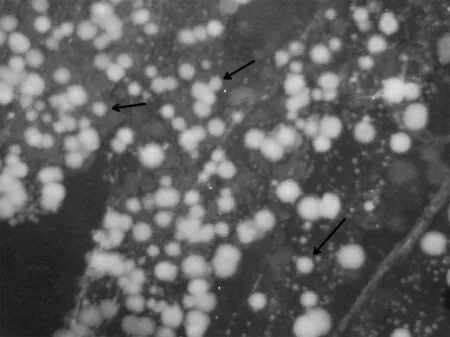
箭头所指白色菌落为变形链球菌图1 临床分离株在BHI培养基上的形态(×5)
1.2.2外源性c-di-GMP对变形链球菌生长的影响 在 BHI肉汤培养基中接种变形链球菌,37℃厌氧条件下(90%N2、10%CO2)培养24 h,取适量菌悬液于新鲜配制的 BHI培养基中,使菌液初始浓度为106CFU/ml(通过计数确定 ),取样10 ml,实验组和对照组各5 ml。实验组加入1 100 μl c-di-GMP,使得终浓度为 200 μmol,对照组加入等量生理盐水,37℃厌氧培养(90%N2,10%CO2)8 h。并在0 min、30 min、1 h、2 h、4 h、8 h时分别取适量菌液进行活菌计数。
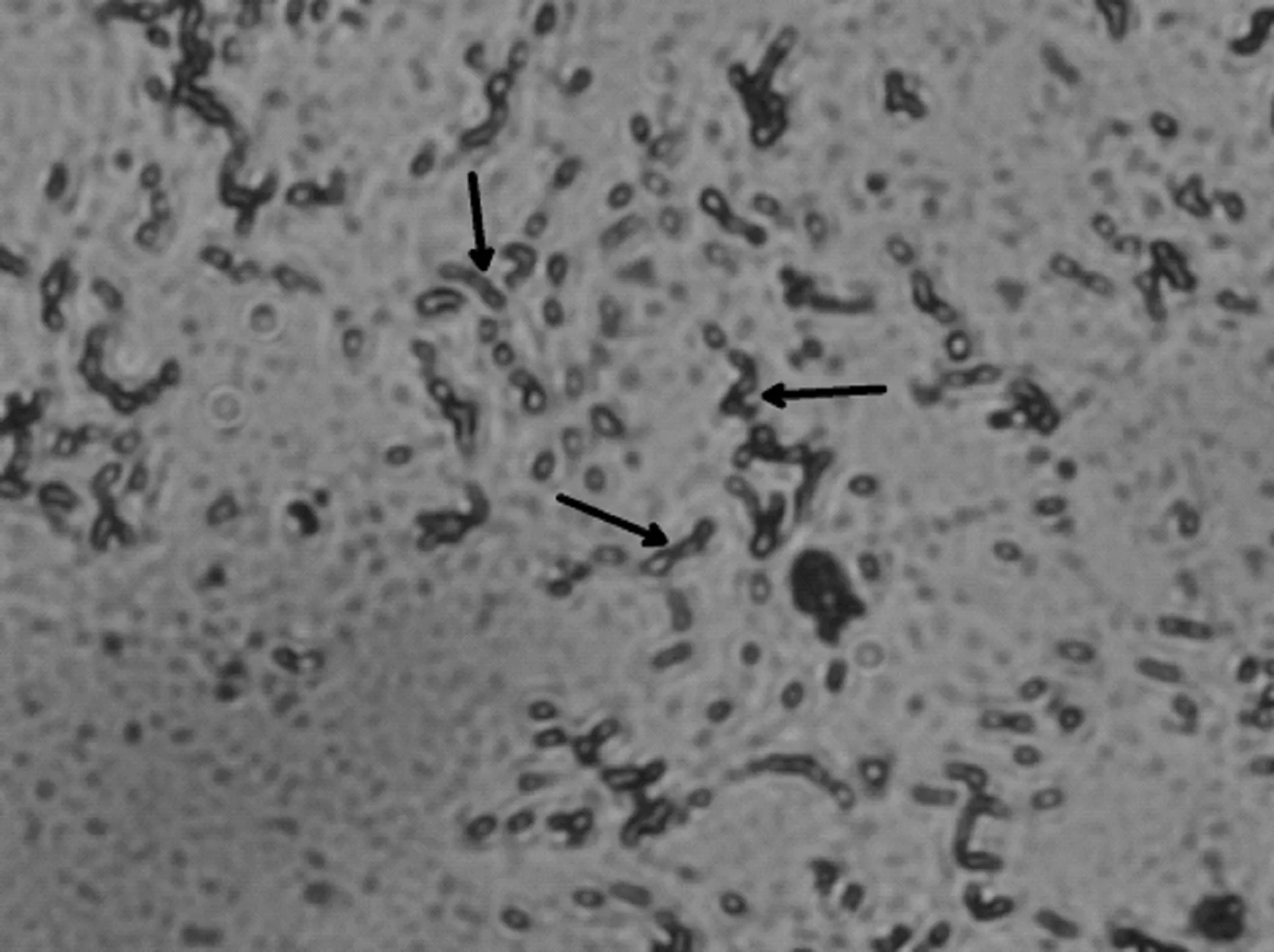
图2 革兰染色变形链球菌(×400)
1.2.3外源性c-di-GMP对变形链球菌生物膜形成能力的研究 在BHI培养基中接种变形链球菌,按200 μl/孔将菌悬液转入无菌的96孔酶标板中,每组3孔,实验组使c-di-GMP 终浓度分别为0 μmol/L、2 μmol/L、20 μmol/L、200 μmol/L、400 μmol/L,去除游离菌液,每孔用200 μl去离子水轻柔洗涤3~4次以去除未结合和结合疏松的细菌,然后将酶标板倒置放置于吸水纸上使其干燥,逐一在每孔中加入50 μl 10 g/L的结晶紫溶液,室温下染色15 min,使结合的细菌着色。吸去染色液用去离子水洗涤3~4次,洗净染色液后自然干燥。然后每孔加入200 μl 95%乙醇显色,使用酶标仪在630 nm测定OD值。
1.3方法学分析 采用SPSS16.0软件进行t检验、单因素方差分析。
2 结 果
2.1c-di-GMP对变异链球菌生长的影响 200 μmol/L的外源性c-di-GMP与等量的生理盐水在对变形链球菌生长率方面的影响没有明显不同,且在相同条件下培养24 h后,两组之间细菌数量也没有明显差异(P>0.05)。见表1。

表1 两组不同时间细菌数量比较
2.2不同浓度c-di-GMP对变形链球菌生物膜形成能力的影响 0 μmol/L、2 μmol/L、20 μmol/L、200 μmol/L、400 μmol/L组c-di-GMP抑制率分别为:(0±0.000)%、(48±0.021)%、(82±0.004)%、(92±0.001)%、(86±0.002)%。200 μmol/L浓度组变形链球菌的生物膜形成能力达到最低,抑制率达到了92%。
3 讨 论
变形链球菌通过形成细菌生物膜的形式定植在牙体表面,促进细菌微生物的黏附,并利用口腔中的碳水化合物代谢产酸,造成釉质脱矿,龋洞形成。研究发现c-di-GMP是存在于原核细胞信号转导中一类新的第二信使,细菌以外的其他物种的信号转导过程中不存在这种物质〔3〕,c-di-GMP由1个磷酸二酯键连接两分子的cGMP而成,它是细菌生存和代谢中的关键性调节因子之一〔4〕。通过分析变形链球菌UA159基因组发现,在变形链球菌中存在一种与GGDEF结构域相关的蛋白(AAN59731)〔5〕,该蛋白具有c-di-GMP信号分子作用〔6〕。研究发现在几种细菌的细胞内均含有较低水平的c-di-GMP,大约每个细胞为0.6 pmol/mg,如果细胞内产生的c-di-GMP水平为生理量,则不会干扰三磷酸鸟苷(GTP)的代谢,因为GTP的浓度是c-di-GMP的100倍〔7〕。但是,细胞内c-di-GMP的浓度会受到GGDEF和EAL结构域编码蛋白过表达的影响〔8〕。高浓度的c-di-GMP在细菌中的作用可被精确的描述为c-di-GMP将细胞锁定于一种无柄状态,相反,低水平c-di-GMP刺激细胞游动和群集运动〔9〕。由此看来c-di-GMP信号传导的调控概念已经很明确,并非所有细胞外基质的产生和多细胞行为都与c-di-GMP浓度增高有联系。比如:群集移动就是在c-di-GMP处于较低浓度时出现的,是一种依赖于细胞间相互作用的多细胞行为。c-di-GMP信号通路的这些调节方式提示该信号通路在个体细胞的形成中是不同的,主要依赖于细胞是否被埋入细胞外基质或是否移动。因此,在细胞周围微环境中极小的变化就会引发c-di-GMP信号通路的发生。c-di-GMP信号通路的调节模式无论是在不相关菌属还是在相关菌属,或相似菌属的个体菌株内都有很高的变异性。细菌生物膜形成是龋病发生的前提条件,如果可以抑制变异链球菌生物膜形成,那就可以有效预防和控制龋病的发生和发展。目前去除牙菌斑生物膜的方法主要有机械措施,化学方法及光动力疗法和声动力疗法,但是效果不是很好,在很大的程度上仍然不能抑制变形链球菌的生物膜形成。本实验通过使用外源性c-di-GMP对变形链球菌生物膜的形成进行干扰,发现c-di-GMP对于生物膜形成有明显的抑制作用。本研究结果表明外源性的c-di-GMP对于变异链球菌的生物膜形成具有抑制作用,且其浓度与抑制率在0~200 μmol/L呈正相关,具体的抑制机制还需要进一步实验研究证明。

