Wnt信号通路介导CIP2A沉默诱导肺癌细胞凋亡
刘喜婷 杨磊 马琴 顾峰 吴玉强
(甘肃省肿瘤医院呼吸肿瘤内科,甘肃 兰州 730050)
蛋白磷酸酶2A的癌性抑制因子(CIP2A)是一种从人胎脑cDNA文库中克隆出来的基因,其在肿瘤组织中高表达,是一种潜在的癌基因〔1〕。研究显示,CIP2A不仅可以促进正常的胚胎成纤维细胞发生癌变,还能够直接促进肿瘤细胞增殖并诱导具有自我更新能力的前体细胞生长,帮助癌细胞躲避治疗引起的细胞老化和衰老〔2,3〕。目前在胃癌、肺癌、结肠癌等组织中均已经发现CIP2A高表达,并且沉默其表达可以诱导胃癌、卵巢癌等肿瘤细胞的凋亡,而其在肺癌细胞凋亡中的作用尚不明确〔4~6〕。研究表明,CIP2A能够稳定致癌因子c-myc的表达,而c-myc是Wnt信号通路的靶基因,CIP2A可能与Wnt信号通路调控作用有关〔7〕。本实验通过沉默肺癌细胞中CIP2A的表达,探讨沉默CIP2A在肺癌细胞凋亡中的作用及机制。
1 材料与方法
1.1材料 非小细胞肺癌细胞H1299购自上海博谷生物科技有限公司;活化的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase)-9抗体购自美国Cell Signaling Technology;CIP2A引物和甘油醛-3-磷酸脱氢酶(GAPDH)引物均由上海生工合成;CIP2A shRNA慢病毒和shRNA阴性对照慢病毒由北京合生基因科技有限公司构建;CIP2A抗体购自美国Santa Cruz Biotechnology公司;RPMI1640、胎牛血清购自美国Gibco;Cleaved Caspase-3抗体购自美国ABCAM;β-catenin抗体、c-myc抗体购自上海优宁维生物科技有限公司;逆转录试剂盒、Realtime PCR试剂盒购自大连宝生物。
1.2慢病毒感染及沉默效果检测 取H1299细胞,用含有10%胎牛血清的RPMI1640培养,细胞接种到6孔板内,观察细胞生长至40%以后,在每个孔内加入适量的病毒液,同时添加1 ml的RPMI1640,病毒感染复数为20,在每个孔中加入1.5 μl的聚凝胺polyberne(8 g/L),混合后,置于饱和湿度、5% CO2,37℃的培养箱中培养。在培养箱中孵育1 d后,更换成1.5 ml的细胞培养液,同时加入1.5 μl的1 mg/ml嘌呤霉素puromycin进行筛选,每隔2 d进行换液,筛选7 d后,用Realtime PCR和Western印迹检测沉默效果。将稳定感染靶向CIP2A shRNA的慢病毒细胞记为CIP2A shRNA组,同时把感染shRNA阴性对照慢病毒的细胞记为shRNA-NC组,以不添加病毒的细胞记为Control组。
Realtime PCR检测沉默效果:取各组细胞,用TRIZOL方法提取细胞中的RNA,步骤同试剂盒,以紫外分光光度计检测RNA的浓度。用逆转录试剂盒合成cDNA,以SYBR Green进行Realtime PCR,步骤均同试剂盒。CIP2A正义链5′-GATAGACTGATTGCTCAGCATCGC-3′,反义链5′-ACATACTAGCAAGTGTCCGTGCCTC-3′。GAPDH正义链5′-CGGAGTCAACGGATTTGGTCGTAT-3′,反义链5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。
Western印迹检测沉默效果:取各组细胞,在细胞中添加苯甲基磺酰氟(PMSF)/RIPA蛋白裂解液,充分吹打混合裂解以后,4℃环境离心。取蛋白上清,用二喹啉甲酸(BCA)法定量,保存在-80℃。配制10%分离胶、5%浓缩胶,在每个孔内加入20 μg的蛋白,首先将电压设置为80 V,电泳约60 min后,蛋白处于浓缩胶和分离胶的交界处,此时蛋白形成一条直线,再把电压升高到150 V,直至染料到凝胶的底部以后,关闭电源。将凝胶取出,进行湿转膜,转膜装置置于冰上,转膜的电压为100 V,转膜时长为70 min。把磷酸纤维素(NC)膜放在封闭液(300 mg脱脂奶粉溶解在10 ml的TBST)中,室温孵育1 h。配制含有1∶100 CIP2A抗体的孵育液,将NC膜置于其中,置于4℃中过夜反应。配制1∶5 000的二抗稀释液,与NC膜在室温中结合2 h后,以电化学发光(ECL)方法显色,采集图像,分析条带的灰度值,GAPDH作为内参蛋白,分析各组CIP2A蛋白水平。
1.3沉默CIP2A对肺癌细胞中Wnt信号通路的影响 取各组细胞,以Western印迹方法检测细胞中Wnt信号通路蛋白β-catenin、c-myc的表达水平,检测沉默CIP2A对Wnt信号通路激活水平影响,步骤同1.2。 用18 mmol/L的Wnt/β-catenin通路激活剂氯化锂(LiCl)处理沉默CIP2A后的肺癌细胞记为CIP2A shRNA+LiCl组。
1.4细胞增殖活性检测 以噻唑蓝(MTT)法检测细胞增殖活性,活细胞中的琥珀酸脱氢酶能够与MTT结合形成蓝色结晶,死细胞不能产生结晶,用二甲基亚砜(DMSO)溶解结晶,检测570 nm的OD值,OD值与活细胞数目呈正比。步骤如下:取H1299细胞,接种到96孔板,每个孔中加入4 000个细胞,按照Control、shRNA-NC、CIP2A shRNA、CIP2A shRNA+LiCl分组处理以后,置于培养箱中孵育4 d,期间每1 d取出培养板进行MTT检测,在细胞中添加MTT溶液,孵育4 h显色,把孔内的液体吸弃以后,加入150 μl的DMSO终止反应,以570 nm的波长检测OD值。
1.5细胞凋亡检测 以膜联蛋白(Annexin)-V FITC和碘化丙啶(PI)双染法测定细胞凋亡。具体步骤如下:Control、shRNA-NC、CIP2A shRNA、CIP2A shRNA+LiCl按照上述方法分组处理以后,培养2 d。用胰蛋白酶消化细胞,以磷酸盐缓冲液(PBS)将细胞洗涤3次,加入100 μl的结合缓冲液、5 μl的 Annexin V-FITC、10 μl的PI混合后,置于室温避光反应15 min。用流式细胞仪检测凋亡变化。
1.6Wnt信号通路激活剂对细胞中Cleaved Caspase-3、Cleaved Caspase-9、β-catenin、c-myc蛋白水平影响 Control、shRNA-NC、CIP2A shRNA、CIP2A shRNA+LiCl细胞按照上述方法处理培养2 d以后,以Western印迹法测定细胞中Cleaved Caspase-3、Cleaved Caspase-9、β-catenin、c-myc蛋白水平,步骤同1.2。
1.7统计学分析 应用SPSS21.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1沉默CIP2A效果检测结果 与Control组比较,CIP2A shRNA组CIP2A mRNA和蛋白表达水平明显下调(P<0.05),shRNA-NC组CIP2A mRNA和蛋白表达水平差异无统计学意义(P>0.05)。见图1、表1。
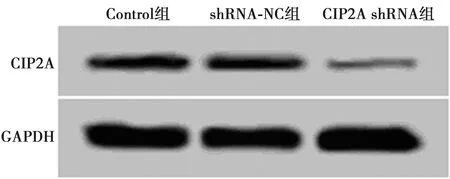
图1 Western印迹检测CIP2A在各组肺癌细胞中的表达
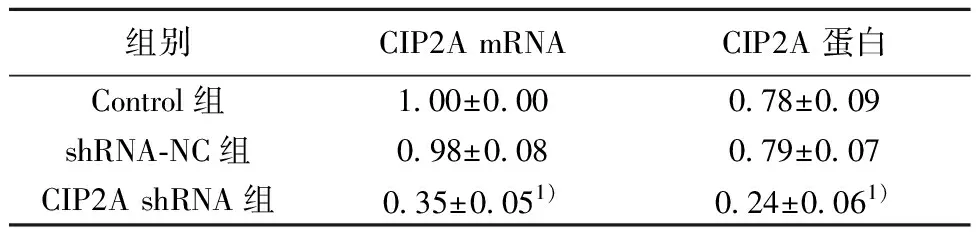
组别CIP2A mRNACIP2A 蛋白Control组1.00±0.000.78±0.09shRNA-NC组0.98±0.080.79±0.07CIP2A shRNA组0.35±0.051)0.24±0.061)
与Control组比较:1)P<0.05;表2同
2.2沉默CIP2A对肺癌细胞中Wnt信号通路激活水平影响 与Control组比较,CIP2A shRNA组β-catenin、c-myc表达水平均明显下调(P<0.05)。见图2、表2。

图2 Western印迹测定β-catenin、c-myc蛋白表达
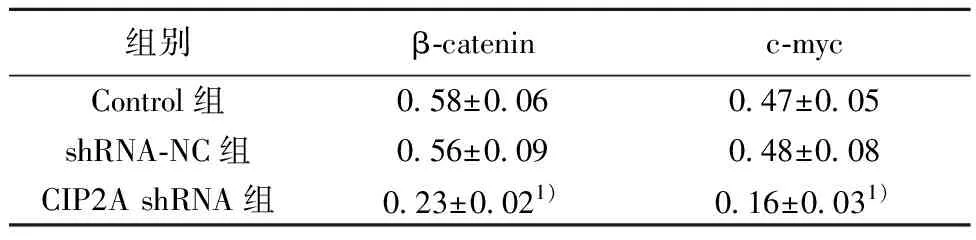
组别β-cateninc-mycControl组0.58±0.060.47±0.05shRNA-NC组0.56±0.090.48±0.08CIP2A shRNA组0.23±0.021)0.16±0.031)
2.3激活Wnt信号通路对沉默CIP2A诱导的肺癌细胞增殖抑制作用影响 与Control组比较,CIP2A shRNA组细胞增殖活性显著降低(P<0.05);与CIP2A shRNA组比较,CIP2A shRNA+LiCl组细胞增殖活性显著升高(P<0.05)。见表3。
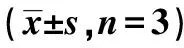
表3 各组肺癌细胞增殖情况及凋亡率比较
与Control组比较:1)P<0.05;与CIP2A shRNA组比较:2)P<0.05;表4同
2.4激活Wnt信号通路对沉默CIP2A诱导的肺癌细胞凋亡影响 与Control组比较,CIP2A shRNA组细胞凋亡率显著增加(P<0.05);与CIP2A shRNA组比较,CIP2A shRNA+LiCl组细胞凋亡率显著降低(P<0.05)。见图3、表4。
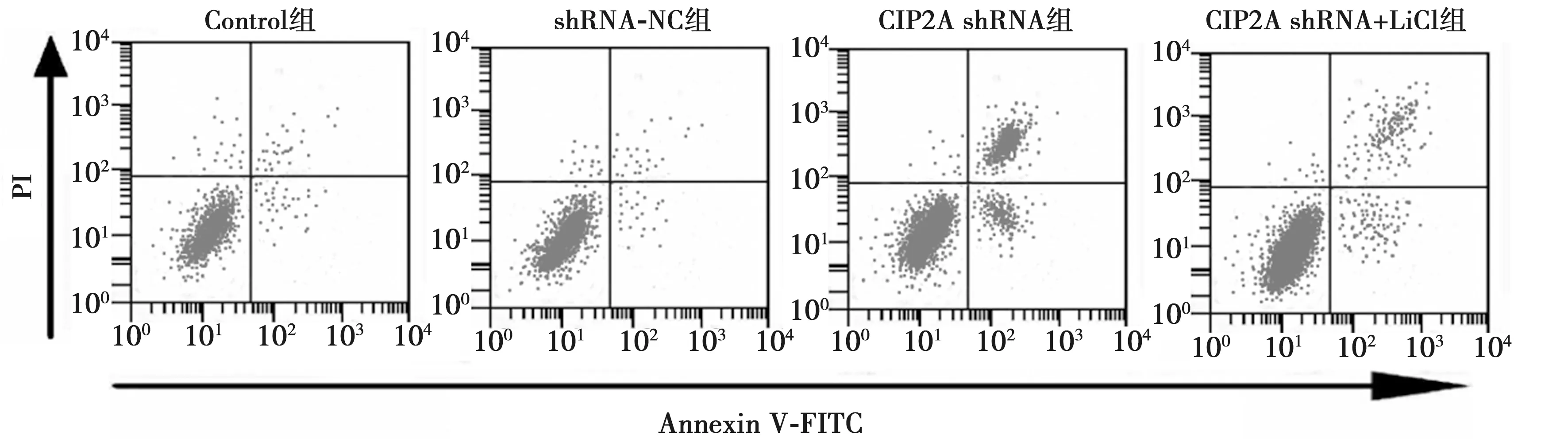
图3 流式细胞术测定肺癌细胞凋亡率
2.5Wnt信号通路激活剂对沉默CIP2A的肺癌细胞中Cleaved Caspase-3、Cleaved Caspase-9、β-catenin、c-myc蛋白水平影响 与Control组比较,CIP2A shRNA组β-catenin、c-myc蛋白表达显著降低(P<0.05),Cleaved Caspase-3、Cleaved Caspase-9蛋白水平显著升高(P<0.05),与CIP2A shRNA组比较,CIP2A shRNA+LiCl组β-catenin、c-myc蛋白表达显著升高(P<0.05),Caspase-3、Caspase-9活化水平显著降低(P<0.05)。见表4和图4。
表4 各组β-catenin、c-myc、Cleaved Caspase-3、Cleaved Caspase-9蛋白水平比较
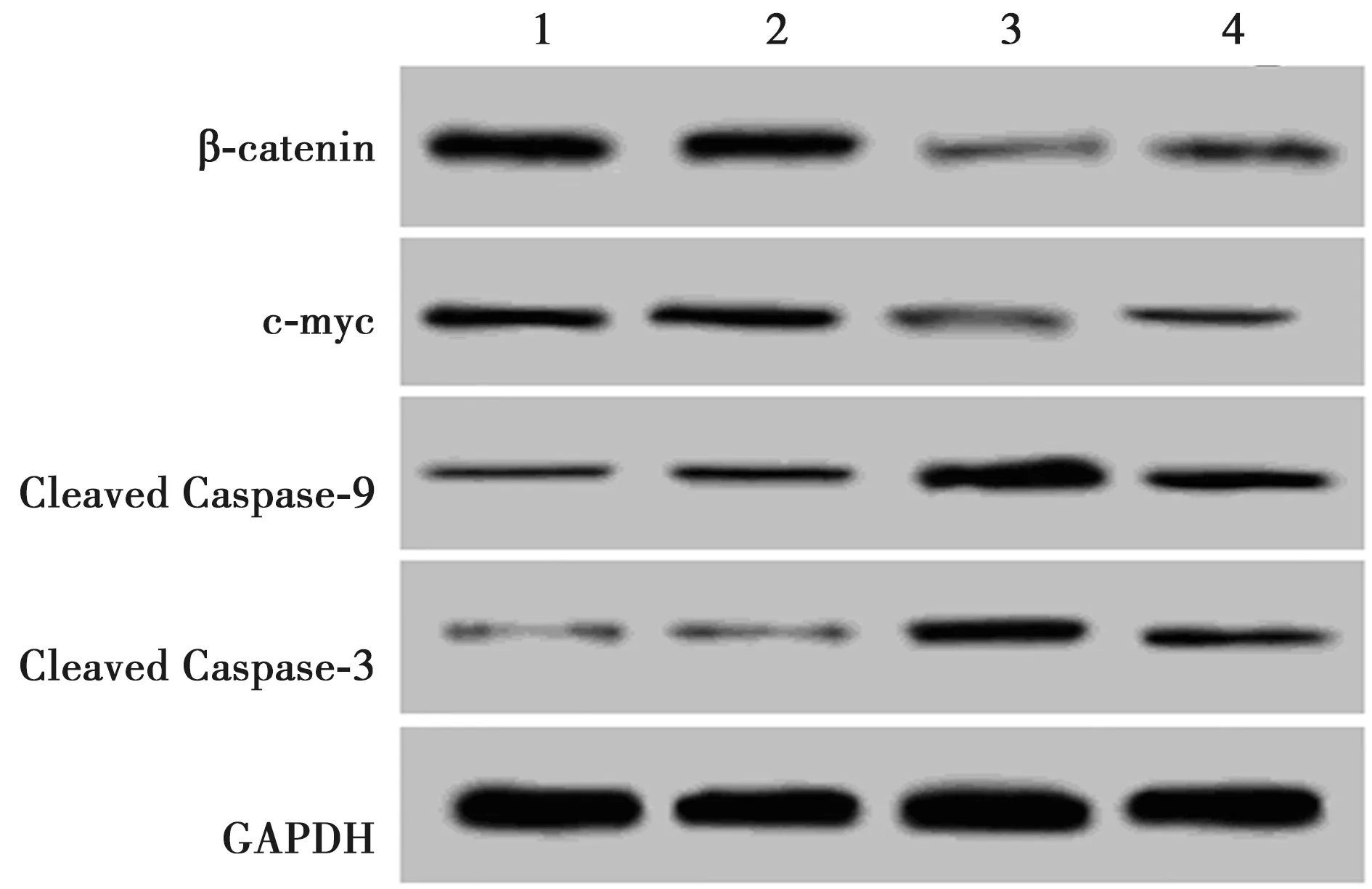
1~4:Control组、shRNA-NC组、CIP2A shRNA组、CIP2A shRNA+LiCl组图4 Western印迹测定β-catenin、c-myc、Cleaved Caspase-3、Cleaved Caspase-9蛋白表达
3 讨 论
编码CIP2A蛋白的基因定位于3q13.13染色体上,其DNA的长度为38.8 kb,含有21个外显子,编码的蛋白由905个氨基酸组成〔8〕。CIP2A主要存在于细胞质中,核酸序列分析显示,其mRNA的5′端含有较多的GC碱基,在其3′端含有AATAAA多聚腺苷磷酸化信号和ATTTA序列,参与维持mRNA的稳定,CIP2A蛋白的羧基端含有1个卷曲螺旋结构域和2个磷酸化位点,卷曲螺旋结构域中含有2个5肽结构,其氨基酸含有亮氨酸拉链结构和Armadillo重复结构,CIP2A蛋白这些结构特点与其参与肿瘤发生具有密切关系〔9~12〕。CIP2A在脑组织、前列腺组织等良性组织中高度表达,在胃、肺等组织中表达水平较低〔13〕。目前的研究表明,CIP2A在肿瘤中高表达,其可以通过与c-myc等结合影响肿瘤的发生,下调其表达后可以诱导肿瘤细胞生长抑制,另外,CIP2A还具有促进正常细胞癌化的作用〔14,15〕。本实验结果表明,CIP2A沉默能够在体外抑制肺癌细胞的生长,诱导肺癌细胞凋亡,CIP2A在肺癌细胞中可能发挥癌基因的作用。
Cleaved Caspase-3和Cleaved Caspase-9是细胞凋亡发生的促进因子,二者在Caspase凋亡反应中发挥凋亡执行和起始的作用,正常情况下,其以没有活性的Caspase-3、Caspase-9形式存在于细胞内,只有被活化后才可以发挥凋亡促进作用〔16,17〕。本实验结果显示,沉默CIP2A后的肺癌细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白水平升高,提示沉默CIP2A促进Caspase介导的肺癌细胞凋亡。
c-myc是目前公认的癌基因,具有调控细胞增殖、分化、凋亡等作用,受到细胞内多种信号及基因的调控作用〔18~20〕。c-myc是Wnt信号通路的下游靶基因,其表达水平的高低可以间接反映Wnt信号通路的激活水平〔21,22〕。目前对于CIP2A调控肿瘤的作用机制研究尚不明确,研究显示,CIP2A可以直接同c-myc的氨基端结合,抑制抑癌因子PP2A的表达,而PP2A的活性升高可以通过抑制β-catenin复合物的降解阻碍β-catenin进入细胞核,引起Wnt信号通路激活受阻,CIP2A可能具有调控Wnt信号通路激活的作用〔23~25〕。本实验结果表明,沉默CIP2A后的肺癌细胞中Wnt信号通路激活水平降低,并且Wnt信号通路激活剂可以逆转沉默CIP2A对肺癌细胞增殖凋亡的影响,沉默CIP2A可以通过降低Wnt信号通路的激活水平诱导肺癌细胞凋亡。CIP2A影响肿瘤细胞的生长、凋亡的机制较为复杂,本实验初步探讨了沉默CIP2A对肺癌细胞凋亡的影响与Wnt信号通路有关,二者是通过何种调控及结合方式尚未研究。
综上,沉默CIP2A可以诱导肺癌细胞凋亡,抑制肺癌细胞增殖活性,其作用机制与下调Wnt信号通路激活水平有关,对于其是如何靶向调控Wnt信号通路机制尚未探讨。本实验明确了CIP2A在肺癌细胞增殖凋亡中的作用,为靶向CIP2A治疗肺癌提供了新思路,为明确CIP2A在肺癌发生中的机制奠定了基础。

