两例β-地中海贫血病例中罕见HBB基因突变的鉴定
郭薇霞,唐 健,何建萍,罗胜军,黄 铠,林克勤,褚嘉祐,杨昭庆△
(1.中国医学科学院&北京协和医学院医学生物学研究所医学遗传学研究室,云南昆明 650118;2.昆明市妇幼保健院遗传室,云南昆明 650031)
β-地中海贫血是由β珠蛋白基因突变导致β珠蛋白肽链合成速率降低或缺如所引起的血红蛋白病,呈常染色体单基因隐性遗传[1]。β-地中海贫血在中国人群中的分布以南方为主,其中广西、广东、海南和云南等地区是高发地区,发病率高达7%~20%以上[2-3]。β-地中海贫血主要有2类,完全不能合成β链的称为β0地中海贫血,能部分合成β链称为β+地中海贫血。其临床表现与基因突变类型相关,其中杂合子携带者常表现为轻度小细胞低色素贫血或无明显临床症状,而β0地中海贫血纯合子以及一些β0/β+复合杂合子会产生中到重度的溶血性贫血症状,需通过长期输血和祛铁治疗维持生命[4]。因此开展地中海贫血孕前、产前筛查对减少重型地中海贫血患儿的出生具有重要意义。目前我国临床检验上采用反向点杂交法检测β-地中海贫血基因主要针对常见的17种突变类型,不能检测到罕见的突变类型,具有一定局限性。近年来,一些罕见突变陆续被报道和发现[5-7],但目前对罕见地中海贫血突变的类型、分布和检测策略仍然缺乏了解,临床诊治中对其基因型与表型的关系和临床病理意义也缺乏认知。因此本研究报道了2例罕见型β0突变Codon5(-CT),并对基因型和表型进行了分析。
1 资料与方法
1.1一般资料 2例患者均为女性,汉族,年龄分别为24岁和36岁,云南省昆明籍贯。二者之间无血缘关系,于云南省昆明市妇幼保健院进行产前地中海贫血筛查时发现疑似地中海贫血。根据知情同意原则获取患者乙二胺四乙酸二钾(EDTA-K2)抗凝外周静脉血2~3 mL。
1.2方法
1.2.1血液学检查 采用血细胞分析仪sysmex XT-2000i(日本)及配套试剂检测患者外周静脉血红细胞血红蛋白含量(HBG)、平均红细胞体积(MCV)和平均血红蛋白含量(MCH)等血常规检测指标。血红蛋白电泳及定量分析采用欧洲Helena V8全自动等电聚焦毛细管电泳仪和配套试剂进行检测。
1.2.2常见地中海贫血突变基因检测 采用Axygen公司(杭州)的AxyPrep血基因组DNA小量制备试剂盒从外周静脉血样中分离基因组DNA。采用基于PCR-反向点杂交法的地中海贫血基因检测试剂盒(亚能生物技术公司,中国深圳))检测23种见中国人常见的α-和β-地中海贫血基因型(SEA、-α3.7、-α4.2、αCSα、αQSα、αWSα、41-42M、654M、-28M、71-72M、17M、βEM、IVS-I-1M、IVS-I-5M、27/28M、43M、-29M、-30M、31M、-32M、14-15M、IntM和CAPM)。
1.2.3β珠蛋白基因测序 引物序列参照文献[8],由昆明硕擎生物技术有限公司合成,扩增包括转录启动子序列及3个外显子在内β珠蛋白基因序列,共1 973 bp。PCR扩增采用大连宝生物公司的TaKaRa LA Taq酶,扩增体系为30 μL:每一反应体系含10×Mix Buffer 3 μL、dNTP 3 μL、上下游引物各0.3 μL、LA Taq 0.3 μL、H2O 20 μL、DNA模板含量约100 ng。使用美国ABI公司的9700PCR扩增仪,反应条件为:94 ℃ 4 min,94 ℃ 45 s,64 ℃ 40 s,72 ℃ 90 s,共35个循环,72 ℃延伸20 min。纯化PCR产物后,送昆明硕擎生物技术有限公司进行测序。
2 结 果
2.1血液学检查结果 2例患者的血常规和血红蛋白电泳检测结果见表1,MCV、MCH降低,均为明显的小细胞低色素,血红蛋白结果显示2例患者为轻度贫血。血红蛋白电泳结果显示2例患者HbA2水平异常升高,提示β-地中海贫血。
2.2基因型检测结果 二者均未检出中国人中常见的α、β-地中海贫血基因突变。β珠蛋白基因测序结果发现2例患者均有Codon 5(-CT)β0杂合突变,国际命名法(HGVS name):HBB:c.17_18delCT,部分测序结果见图1。其中患者B还检出HBB基因多态性HBB:c.9T>C,CD2 His>His,为同义突变。
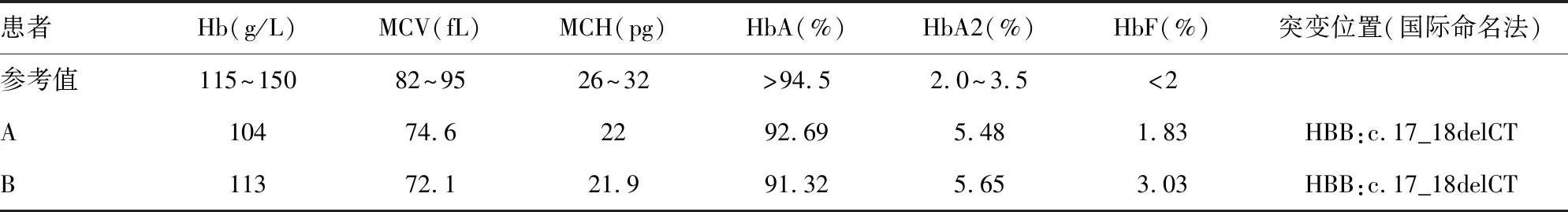
表1 患者A、B基因型与血液学表型

图1 患者A和患者B β珠蛋白基因测序结果图
3 讨 论
β-地中海贫血具有较大的遗传异质性,存在地域和民族分布差异[9]。目前世界上已报道800多种β基因突变类型,我国发现的超过了60种,常见的突变类型有-28M、17M、41-42M、71-72M、654M,这5种突变占我国β-珠蛋白基因突变的90%以上[10]。而云南分布最多、报道较多的是17M、41-42M、βEM突变[11]。本研究联合运用血液学检查、常见地中海贫血基因检测和HBB基因测序,在云南昆明地区鉴定出2例罕见Codon 5(-CT)β0杂合突变,进一步扩展了云南人群中的地中海贫血突变谱。
罕见型β0地中海贫血-5(-CT)是由于β珠蛋白基因第5位密码子CCT缺失了CT 2个碱基,产生移码突变,使得β链的合成在第21位密码子就提前终止,完全不能合成β链。这一突变首次在一希腊患者中被报道[12],随后国外多个人种中都有报道[13-14]。根据人类血红蛋白变异体数据库HbVar(http://globin.bx.psu.edu/hbvar/menu.html)显示,这一突变在英国人中的分布最高,达到了8.7%。而我国仅有检出1例的报道,目前缺少在群体中的分布频率。[15],本研究这是第2次报道。由于本研究和之前的报道都是在云南人群中检出这一突变,国内其他地区尚未见报道,这是否说明该突变的分布和频率存在明显的地域差异,还有待于进一步研究。
国外研究显示这一突变表现为小细胞低色素轻度贫血[4],而我国目前仍然缺乏该突变的临床信息。本研究中这2例患者为β0地中海贫血-5(-CT)杂合子,二者都呈现明显的小细胞低色素轻度贫血,血红蛋白电泳结果HbA2增高,临床表现为轻型地中海贫血,这与国外研究相一致。尽管该突变杂合子不产生严重的临床表现,也无需接受治疗,但是由于云南是地中海贫血和异常血红蛋白病高发区,罕见突变携带者与常见地中海贫血突变携带者婚配后,有可能生下复合杂合子患儿,产生严重的临床表型。已有文献报道,β0地中海贫血-5(-CT)合并β+IVS-I-5 (G->A)则产生重型地中海贫血表现,需要长期输血治疗[12]。因此,有必要对罕见突变进行鉴定,从而进一步研究其人群发生率和临床危害性。
根据患者血液学表型,这2例患者疑似为β-地中海贫血携带者,而通过地中海贫血常规基因检测并未检出我国常见的17种β基因突变类型。因此推测这2例患者可能存在非中国人常见的17种突变位点之外的突变,随后通过对HBB基因进行测序验证,从而成功检出这2例罕见突变。由此可见,目前的常规地中海贫血检测试剂盒往往会造成罕见突变的漏检,因此在临床检验中,应严格遵循血液学表型与基因型相结合的原则,当血液学表型与地中海贫血基因型不相符合时,应该考虑珠蛋白基因测序的方法,以明确是否存在罕见或新发的地中海贫血突变类型,避免漏诊。
本研究报道了2例罕见型β0地中海贫血-5(-CT),进一步扩展了云南β珠蛋白基因突变谱。通过基因型和表型探讨,β0地中海贫血-5(-CT)杂合子表现为轻型地中海贫血。由于云南是地中海贫血高发区,为了避免复合杂合子的产生,联合运用血液学、血红蛋白电泳、常规地中海贫血基因检测以及基因测序等,有利于明确患者基因型,更好地指导临床诊治、产前诊断和遗传咨询。

