Co/La-Ga-O复合氧化物用于催化二氧化碳加氢制乙醇
郑晋楠, 安 康, 王嘉明, 李 晶, 刘 源,*
(1. 天津大学化学工程学院 天津市应用催化科学与工程重点实验室, 天津 300072;2. 天津化学化工协同创新中心, 天津 300072)
鉴于化石燃料紧缺和温室效应问题的紧迫性,将丰富又廉价的CO2转化成高附加值的化学品的课题研究,引起全球研究者的广泛关注。但因其C=O键的断裂需要克服高能垒,CO2难以被活化[1],所以,目前CO2的转化研究仍处于初步阶段。
近年来,CO2资源化利用的主要方向是通过加氢生成有附加值的化学品,包括CO2加氢生成CH4[2-4]、长链烃[2,5]、甲醇(MeOH)[2,5]、二甲醚(DME)[6]以及乙醇(EtOH)[7,8]和低碳醇(HAs)[9]等。其中,加氢生成醇类(目前研究成果主要为合成MeOH方向)的反应是CO2转化利用最有前景的途径之一[1]。比起MeOH,EtOH具有高热值、低毒、运输安全以及应用广泛等优点[1,2,10]。但是相比于合成MeOH,需要催化剂具备双活性位点来完成C-C链增长和CO2部分还原[11,12]步骤的EtOH合成过程更具挑战性。
目前,所报道的用于CO2加氢制EtOH或HAs的催化剂主要有贵金属(Ru基[9]、Pt基[11]),Co基[13],Fe基[14]以及Cu基[15]催化剂体系,其中,贵金属催化剂因其高催化活性和高HAs选择性而备受关注,如均相催化剂[Ru3(CO)12/Rh2(CO)4Cl2-LiI][9]在200 ℃下EtOH和HAs总选择性高达96.4%,但催化剂高昂的价格限制其在工业生产中的应用。而用非均相催化剂催化反应时,反应所需的高温促进了副反应逆水煤气反应(RWGS)的进行,使副产物CO增多。如Guo等[15]报道的K/Cu-Zn催化剂在350 ℃、3 MPa的反应条件下的CO2转化率为32.4%,CO选择性高达45.3%,但C2+OH选择性却只有11.8%。相比之下,在CO2加氢反应中表现出弱RWGS活性的Co基催化剂[5,16,17]引起研究者的关注。但因其优异的加氢性能,Co基催化剂通常被运用于CO2甲烷化反应[18,19]。如1%Na/20%Co-SiO2催化剂[13],在H2预还原后主要产物是CH4(选择性80.0%)和C2-4烃。因此,本研究的研究思路在于降低Co基催化剂加氢性能,提高醇类产物的选择性。
本研究设计了一种以钙钛矿型复合氧化物(PTO)LaCo1-xGaxO3为前驱体的新催化剂,还原后得到的Co基催化剂用于CO2加氢直接制EtOH的反应。实验发现,LaCo0.7Ga0.3O3前驱体还原得到的Co/La2O3-La4Ga2O9催化剂表现出很高的EtOH选择性和良好的活性;催化剂中Ga对CO2加氢制EtOH的过程起到促进作用。通过表征,研究了催化剂的结构组成与催化性能的关系,推测出了CO2加氢合成EtOH的反应机理。
1 实验部分
1.1 实验原料
La(NO3)3·6H2O, Co(NO3)2·6H2O,柠檬酸,分析纯(AR),阿拉丁试剂有限公司;Ga(NO3)3·9H2O,AR,北京华威锐科化工有限公司;乙二醇,无水乙醇,AR,天津光复化工研究所;去离子水,天津大学;二氧化碳、氢气和氮气混合气,99.999%,天津市液化有限公司。
1.2 催化剂的制备
采用柠檬酸络合法制备一系列以PTO为前驱体的LaCo1-xGaxO3(x=0、0.2、0.3、0.4和0.5)。首先按照物质的量比La∶Co∶Ga=1∶(1-x)∶x取一定量的La(NO3)3·6H2O, Co(NO3)2·6H2O和Ga(NO3)3·9H2O与柠檬酸和乙二醇一并加入去离子水中溶解,其中,柠檬酸物质的量为总阳离子量的1.2倍,乙二醇物质的量为柠檬酸的0.2倍。所得混合溶液放入水浴锅80 ℃搅拌蒸干后,烘箱120 ℃干燥12 h,得到蓬松的样品。然后以2 ℃/min的速率程序升温至350 ℃煅烧2 h,再升温至650 ℃煅烧5 h,得到前驱体LaCo1-xGaxO3(x=0、0.2、0.3、0.4和0.5)。然后在选定温度下还原3 h,得到催化剂,升温速率设定为2 ℃/min,由H2-TPR测试结果确定钴离子被完全还原的温度,还原温度分别取660、740、740、750和780 ℃。
1.3 催化剂的表征
X射线粉末衍射(XRD)表征选用Bruker D8-Focus型Cu靶X射线衍射仪测试,测试条件:λ=0.15406 nm,20°-80°扫速,扫描速率8(°)/min。
选用Agilent 7700X型电感耦合等离子体发射光谱仪测定催化剂中的钴镓比。测试准备:将催化剂溶解到强酸中配置成溶液,然后稀释到指定浓度。
N2吸附-脱附测试在Quantachrome Quadra Sorb SI 型孔径分布测试仪进行,用BET方程计算比表面积,BJH法计算孔容。
程序升温脱附(H2/CO2-TPD)表征选用天津大学北洋化工实验设备公司自主研制的吸附-脱附还原反应多功能反应器测试。测试步骤如下:100 mg试样还原后,先用氢气或氦气 (30 mL/min) 300 ℃原位预加热1 h,然后用氦气吹扫30 min,随后催化剂在氦气中冷却到50 ℃,切换阀门通入H2/CO2吸附气体2 h,再通入氦气吹扫30 min,待检测器基线稳定后,在氦气吹扫升温的过程中记录H2/CO2探针分子脱附曲线。测试条件:测试温度40-900 ℃,升温速率10 ℃/min。催化剂表面Co的分散度可基于H2-TPD数据通过下列等式计算:
(1)
式中,Ns:催化剂表面Co原子的数目;NA:催化剂总的Co原子的总数目;假设H/Co=1[20,21]。
场发射透射电子显微镜(TEM)表征选用JEOL JEM-2100F电子显微镜测试。测试准备:样品用无水乙醇稀释、研磨、静置后,取上层清液用无水乙醇稀释,超声20 min后滴加至铜网上,待样品自然干燥后测试。
X射线光电子能谱(XPS)表征选用美国Thermo ESCALAB 250Xi测试仪测试。测试条件:单色AlKα(hv=1486.6 eV),功率150 W,500 μm束斑。电子结合能用样品C 1s峰(284.8 eV)作为内标校正。
热重(TG)分析选用DTG-50/50H热分析仪测试,计算催化剂上的焦炭和炭的沉积量。测试条件:空气气氛,升温速率10 ℃/min,测试20-900 ℃,20 mg催化剂。炭沉积量由公式(2)计算:
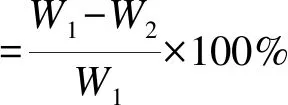
(2)
式中,W1和W2分别为TG测试前后催化剂的质量。
1.4 催化剂的性能测试
在微型固定床反应装置上评价催化剂催化CO2加氢制EtOH的活性。将0.5 g催化剂(40-60目)与石英砂等体积混合均匀后装入反应管,通入反应气体并升压,升温到所需的反应温度,维持12 h达到稳定状态后测试。测试条件:混合气H2/CO2=3.0,3 MPa,空速为3000 mL/(gcat·h),反应通入N2作为内标气体测试产物气体组成。采用SP-3400型气相色谱(GC)在线检测产物组成。气相产物(CO、CO2、H2、CH4)由TCD检测,碳氢化合物和液相产物由FID检测。其中,CO2转化率(xCO2),产物选择性(si)和总醇中各种醇的质量分数(wi)计算公式如下:
(3)
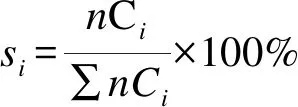
(4)
(5)
式中,[CO2]in和[CO2]out分别为反应进气和出气中的CO2摩尔量;n和Ci分别是含碳产物i的碳原子数和摩尔数;mi为液相产物中各个特定醇的质量。
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRD表征
图1(a)为不同钴镓比LaCo1-xGaxO3前驱体煅烧后的XRD表征。由图1(a)可知,对比LaCoO3(PDF#75-0279)的标准衍射峰,可以发现,所有样品的XRD谱图中只检测到归属于LaCo1-xGaxO3的衍射峰,未发现其他杂相的衍射峰,表明镓离子成功掺入LaCoO3中形成镧钴镓PTO。这保证了Co和Ga离子在原子水平上均匀混合,两者紧密接触形成相互作用。如图1(a)插图所示,随着掺杂Ga含量的增多,样品的XRD 衍射峰向小角度逐渐偏移。这是由于Co3+(0.0545 nm)和Ga3+(0.0620 nm)的不同造成的,离子半径大的Ga3+掺杂到LaCoO3中形成LaCo1-xGaxO3钙钛矿会导致晶格间距变化,且随着Ga掺杂量的增多,晶格间距的差距逐渐增大,表现为XRD衍射峰向低角度偏移。这表明镓元素成功进入LaCoO3钙钛矿晶格中。
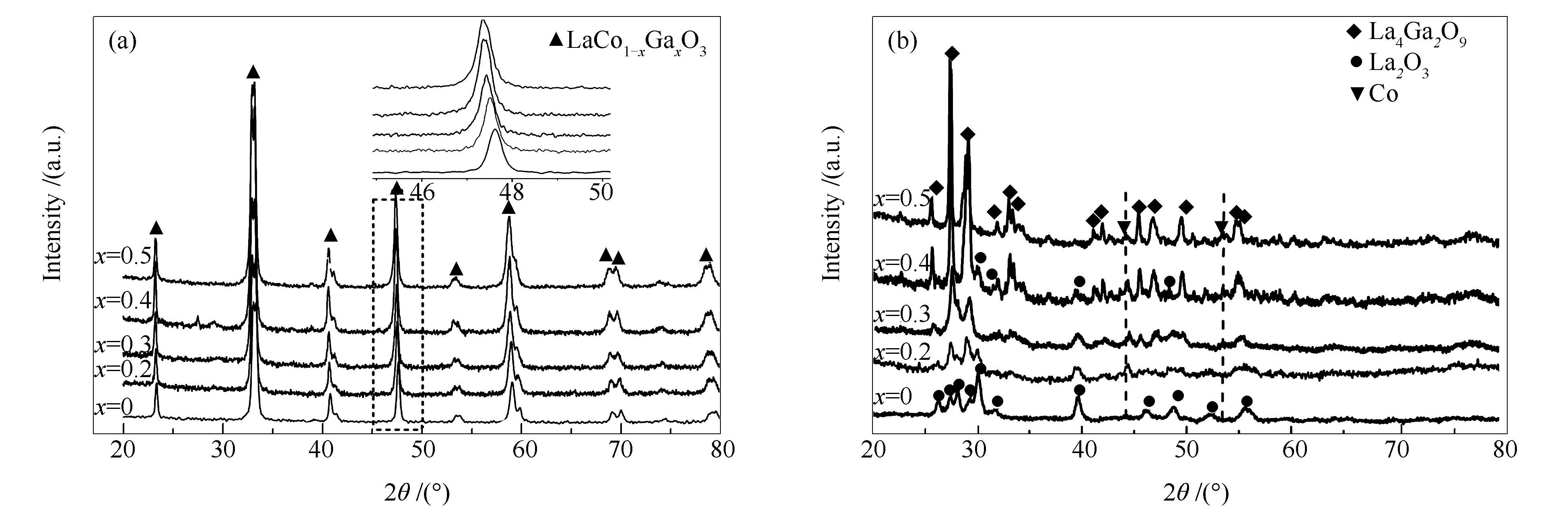
图 1 LaCo1-xGaxO3样品(x=0、0.2、0.3、0.4和0.5)的XRD谱图
图1(b)为还原后的LaCo1-xGaxO3催化剂(x=0、0.2、0.3、0.4和0.5)的XRD谱图。由图1(b)可知,谱图中归属于钙钛矿的衍射峰消失,这说明钙钛矿结构被破坏。当x=0时,出现归属于Co(111)和(100)晶面的特征衍射峰(PDF#88-2325),以及La2O3(101)、(102)和(110)晶面的特征衍射峰(PDF#74-2430)。当x=0.2、0.3和0.4时,出现对应于Co(PDF#88-2325)、La2O3(PDF#74-2430)以及La4Ga2O9(PDF#53-1108)的特征峰。而当x=0.5时, La2O3的特征峰消失,只有Co(PDF#88-2325)和La4Ga2O9(PDF#53-1108)的衍射峰出现,这符合化学计量比的规律。观察发现,随Ga含量的增加,La4Ga2O9衍射峰强度逐渐增强,而La2O3衍射峰的峰强度逐渐减弱。
图2为前驱体为LaCo1-xGaxO3的催化剂(x=0和0.3)在煅烧后、还原后以及在给定的反应条件下反应48 h后(当x=0.3时还含有进行100 h稳定性测试后的样品)的XRD表征结果。当x=0时,煅烧后形成单一的PTO,还原后钙钛矿结构被破坏,出现Co和La2O3的衍射峰。反应48 h后的样品XRD谱图中出现LaCO3OH(PDF#26-0815)和Co2C(PDF#72-1369)的衍射峰,而Co和La2O3的衍射峰消失。其中,LaCO3OH是由La2O3和CO2以及反应生成的H2O反应形成(La2O3+CO2→La2O2CO3, La2O2CO3+CO2+H2O→LaCO3OH[22]),Co2C的形成归因于金属钴在含CO2的反应气中被碳化[23]。类似的,当x=0.3时,煅烧后只检测到LaCo0.7Ga0.3O3的衍射峰,还原后的衍射峰归属于Co、La2O3和La4Ga2O9的存在。比较还原后,反应48 h以及100 h后的样品的XRD谱图可知,反应前后样品的XRD衍射峰强度无明显的变化。因此,可以推断出以LaCo0.7Ga0.3O3为前驱体的催化剂在反应过程中展现出很好的抗烧结能力。

图 2 LaCoO3(a) 和LaCo0.7Ga0.3O3 (b)样品煅烧后、还原后和反应后的XRD谱图
对于以LaCo0.7Ga0.3O3为前驱体的催化剂有两点需要强调:第一点,比较H2-TPD和TEM以及XRD表征结果,发现反应前后(甚至是反应100 h以后)的催化剂的Co颗粒平均粒径相差不大,这说明以LaCo0.7Ga0.3O3为前驱体的催化剂有很好的抗烧结能力。第二点,与LaCoO3比较发现,即使是反应100 h后的LaCo0.7Ga0.3O3催化剂的XRD谱图上也没有发现与Co2C有关的衍射峰,这可能是因为Ga的掺杂有助于Co颗粒的分散[24]和抑制Co2C的形成。Du等[25]发现La2O3的添加可以促进Co2C的生成,而Al2O3的添加则会抑制Co2C的生成。基于Ga和Al在元素周期表上位于同一主族,可以推测Ga和Al对于抑制Co2C生成方面有类似的性质。
2.1.2 H2-TPR表征
图3为LaCo1-xGaxO3(x=0、0.2、0.3、0.4和0.5)的H2-TPR表征结果。由图3可知,所有样品均出现两个明显的H2还原峰,对应PTO中的B位钴离子的两步还原过程。当x=0时,位于350-550 ℃的低温H2还原峰(峰α)归因于PTO晶格中的Co3+还原为Co2+的过程[26,27]。
LaCoO3+1/2H2→LaCoO2.5+1/2H2O
(6)
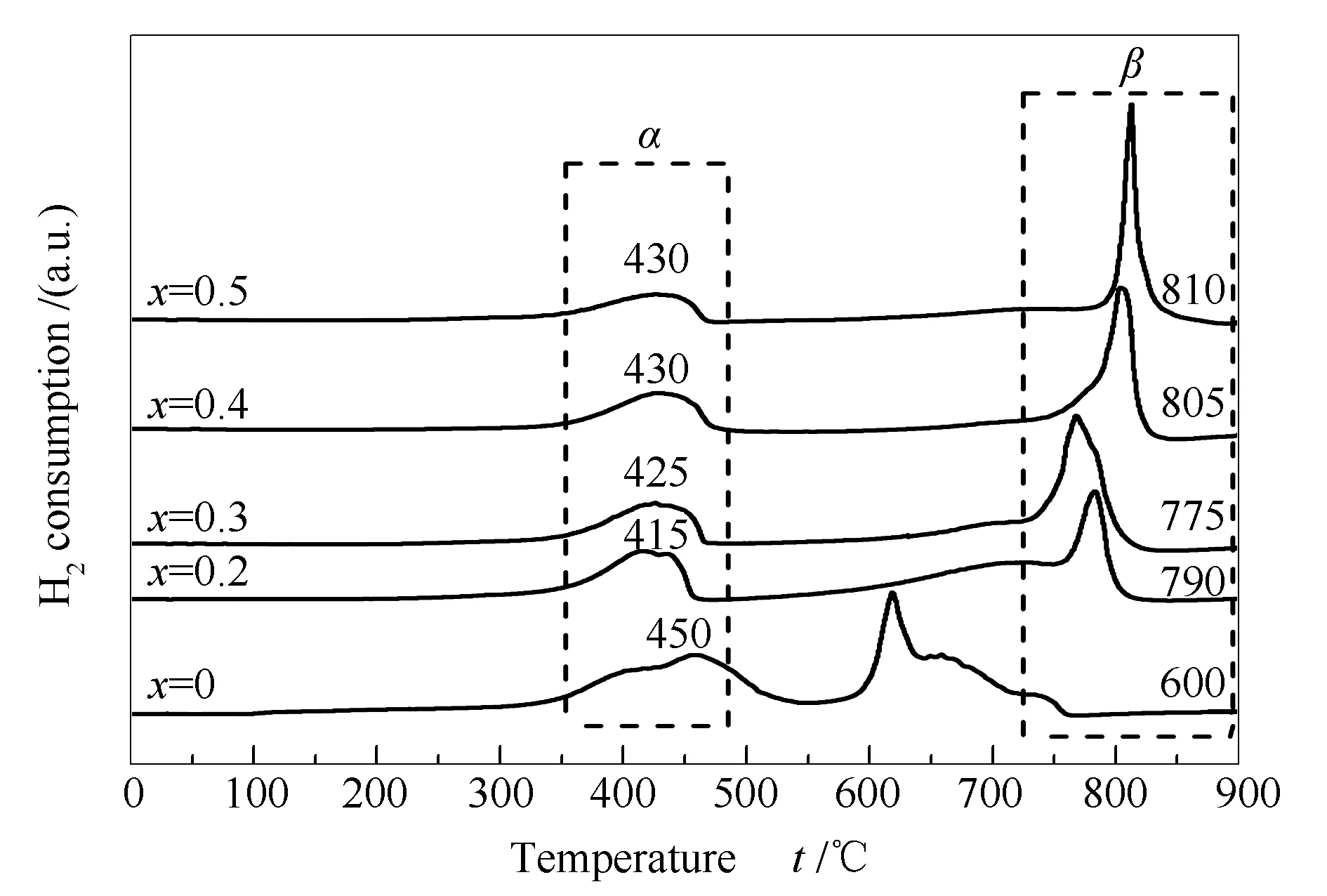
图 3 LaCo1-xGaxO3 样品(x=0,0.2,0.3,0.4和0.5)的H2-TPR谱图
出现在550-750℃的H2还原峰(峰β)归因于Co2+进一步还原变成金属Co的过程[26,27]。峰β分裂为两个峰,一般认为对应表面和体相中的Co2+还原为Co的过程[28],还原后形成Co/La2O3。
LaCoO2.5+H2→1/2La2O3+Co+H2O
(7)
当x=0.2-0.5时,与LaCoO3的H2-TPR谱图相比,可以看到峰α的还原温度向较低温度方向移动,峰β的还原温度向高温方向移动,这说明Ga的掺杂使PTO晶格中的Co3+还原成Co2+的过程变得相对容易,但对Co2+→Co的过程起到抑制作用。
H2-TPR的耗氢量表明还原至β峰对应的温度后,钴离子被完全还原为金属钴。所有样品的峰β和峰α的耗氢峰面积比接近2∶1,与钴离子两步还原过程一致。对应数据见表1。
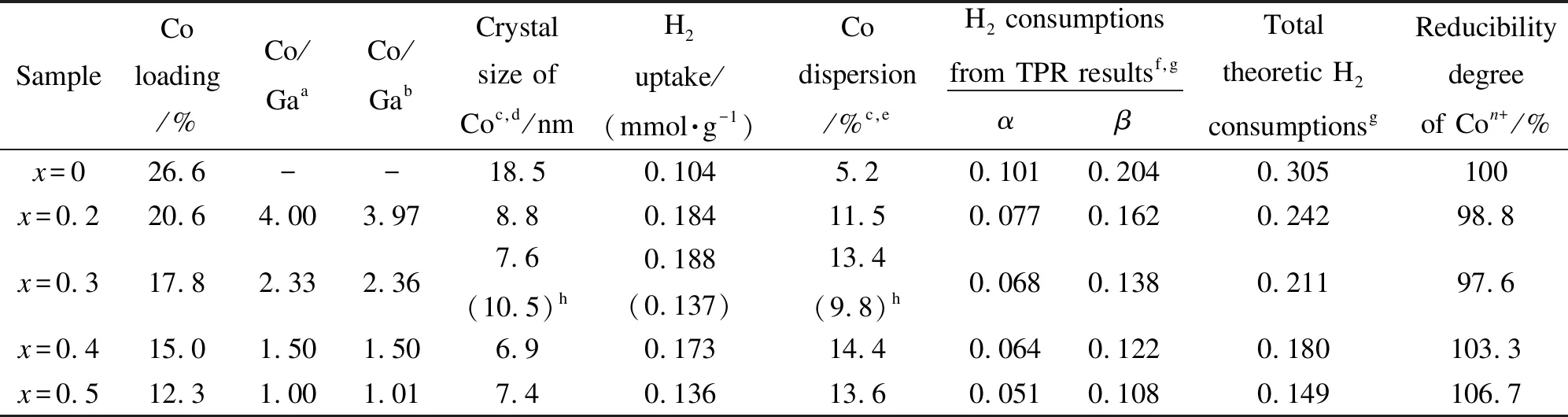
表1 LaCo1-xGaxO3样品(x=0、0.2、0.3、0.4和0.5)的元素组成、晶粒粒径、耗氢量以及还原度计算
a: Co/Ga ratio in synthesis system;b: Co/Ga ratio in sample measured from ICP;c: calculated from the results of H2-TPD;d: the crystal size for catalysts after reduction;e: assuming H/Co=1;f: experimental H2consumptions calculated from TPR results using CuO as the reference material;g: the unit is mmol H2per 50 mg of catalyst;h: crystal size of Co after 100 h stability test in the parentheses
2.1.3 N2吸附-脱附表征
各样品的N2吸附-脱附等温线见图4。
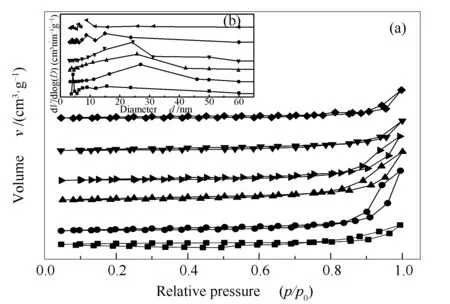
图 4 还原后的LaCoO3(■)、LaCo0.8Ga0.2O3(●)、LaCo0.7Ga0.3O3(▲)以及LaCo0.7Ga0.3O3反应100 h后(▶)、LaCo0.6Ga0.4O3(▼)和LaCo0.5Ga0.5O3(◆)样品的N2吸附-脱附等温线(a)和BJH孔径分布曲线(b)Figure 4 N2 adsorption-desorption isotherms (a) and BJH pore size distribution (b) of the reduced LaCoO3 (■), LaCo0.8Ga0.2O3 (●), LaCo0.7Ga0.3O3 (▲) and LaCo0.7Ga0.3O3 after reaction for 100 h(▶), LaCo0.6Ga0.4O3 (▼) and LaCo0.5Ga0.5O3 (◆) samples
由图4可知,所有样品的吸附等温线形态与Ⅳ型吸附等温线非常相似,并出现较弱的H3型滞留环,这说明样品中存在一定量的介孔(孔径在2-50 nm),这与BJH孔径分布曲线表征结果一致。观察到滞留环的起始位置在p/p0=0.8,这说明形成的孔大多是堆积孔[29],其原因可能是煅烧样品分解柠檬酸盐形成PTO结构的过程中,催化剂颗粒堆积形成多孔结构[30]。并且由表2的数据可知,与LaCoO3相比,掺杂Ga后样品的比表面积和平均孔径增大,但是随着Ga掺杂量的增加,样品的比表面积又从9.6 m2/g减少到6.5 m2/g,平均孔径从27.0 nm减少至6.2 nm。结合图1(b)的XRD结果分析, La4Ga2O9晶粒粒径随着Ga掺杂量的增加而逐渐增大(表现为La4Ga2O9的衍射峰强度逐渐增强)是催化剂比表面积和平均孔径逐渐减少的主要原因。
对于LaCo0.7Ga0.3O3,反应100 h后,催化剂的比表面积由9.4 m2/g减少至9.1 m2/g,平均孔径由25.8 nm变为24.4 nm;同时,反应前后的N2吸附-脱附等温线和BJH孔径分布曲线的变化几乎可以忽略不计;均体现催化剂的抗烧结能力强。

表2 还原后LaCo1-xGaxO3样品(x=0、0.2、0.3、0.4和0.5)的物理性质
a: data in the parentheses are for the spent catalyst after 100 h reaction test
2.1.4 CO2-TPD表征
不同钴镓比催化剂的CO2-TPD表征结果见图5,记脱附峰的峰强最大的温度值为tm。tm位于100-200 ℃的脱附峰主要为吸附在弱碱性位上的CO2脱附,高温段(>600 ℃)出现的脱附峰主要是因为LaCO3OH的分解[22]和CO2与强碱性位之间的强作用力[31],由于CO2自身的低能级轨道和高电子亲和能(38 eV),CO2得电子的能力强,所以金属Co可以通过转移电子来吸附活化CO2[18,19,32],而Yazdani等[33]也指出,碱性氧化物La2O3上弱、中等和强碱性位均存在。所以位于200-500 ℃的脱附峰(峰α)主要为吸附在金属Co和La2O3上的CO2脱附,对应催化剂表面的中等碱性位[31]。一般认为,中等吸附强度的CO2(峰α)属于有效的活化,参与化学反应[31,34]。
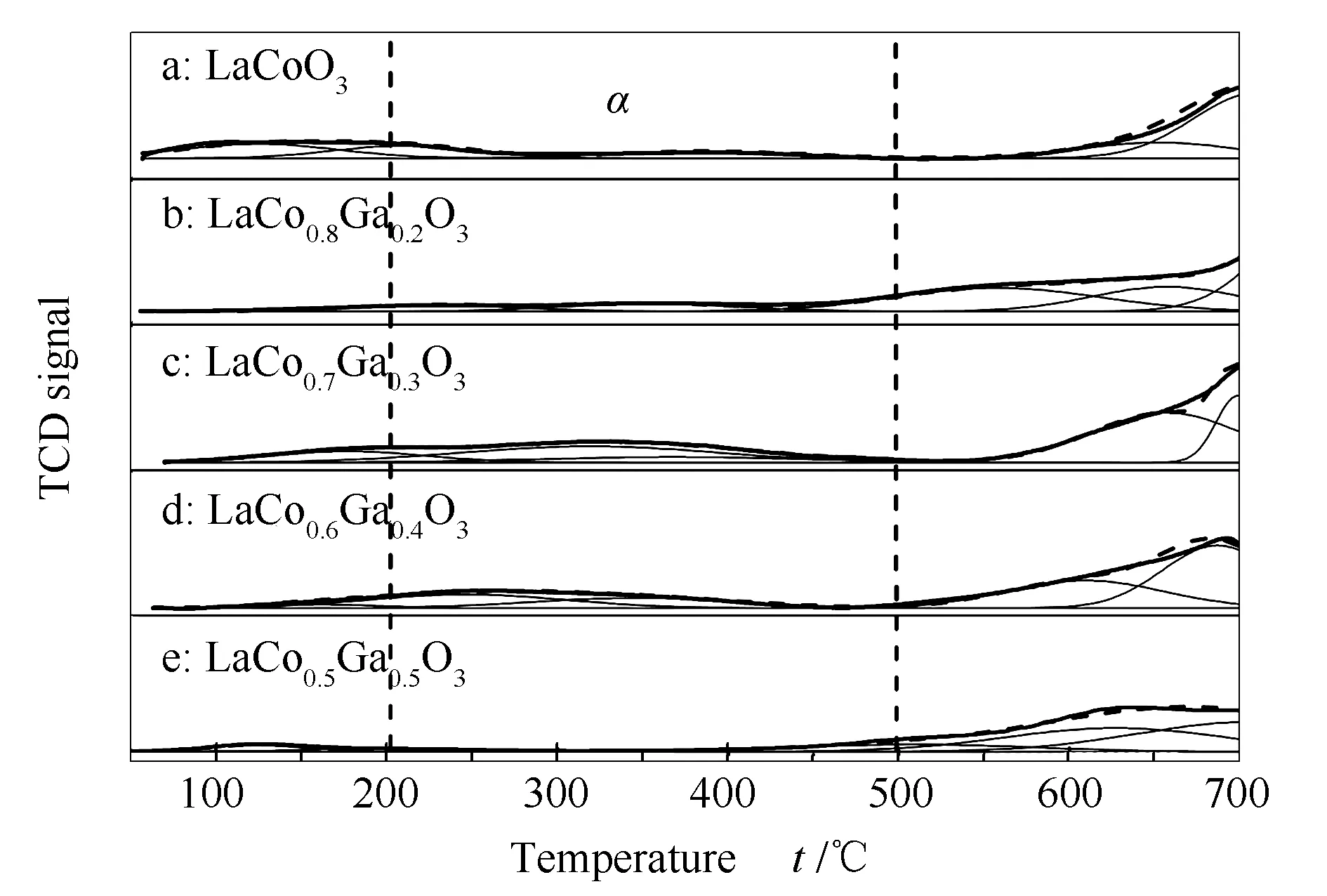
图 5 还原后的LaCo1-xGaxO3 样品的CO2-TPD谱图Figure 5 CO2-TPD profiles of the reduced LaCo1-xGaxO3 samplesa: x=0; b: x=0.2, c: x=0.3, d: x=0.4; e: x=0.5
如上所述,峰α对应的CO2吸附应该是金属Co和La2O3共同作用的结果。虽然随着x的增加,催化剂中的Co和La2O3含量均逐渐减少,但是两者的分散度也都随之增加,在这两个因素的共同作用下催化剂对CO2吸附、活化效果在x=0.3时达到最佳状态,表现为峰α的峰面积达到最大值。而当x=0.5时,峰α的峰面积显著减少,说明当Ga的掺杂量过多时,催化剂表面的中等碱性位点数量反而减少。此时还原后催化剂中无La2O3的存在,结合XRD数据认为,还原后催化剂中La2O3含量影响催化剂吸附活化CO2的性能。通过计算,峰α所代表的化学吸附CO2的量占总吸附量的百分比顺序为:LaCo0.7Ga0.3O3(31.9%)> LaCo0.6Ga0.4O3(29.3%)> LaCo0.8Ga0.2O3(10.4%)> LaCoO3(7.9%)> LaCo0.5Ga0.5O3(3.4%)。表明前驱体为LaCo0.7Ga0.3O3的催化剂反应性能最好,这与活性测试结果相符。
2.1.5 XPS表征
采用XPS表征来进一步探究催化剂的表面状态。其中,催化剂表面各元素的含量见表3。图6为LaCoO3和LaCo0.7Ga0.3O3催化剂反应前后的XPS谱图及其拟合结果。由图6(a)可知,反应后的LaCoO3催化剂的La 3d谱图在835.2和852.0 eV处出现分别归属于La 3d5/2和La 3d3/2的特征峰,表明反应后LaCO3OH的存在[35],与XRD表征结果一致。与反应后的LaCoO3的La 3d峰相比,反应后的LaCo0.7Ga0.3O3催化剂的La 3d5/2电子结合能(834.7 eV)和La 3d3/2电子结合能(851.5 eV)都向低结合能进行了位移,这应该是因为催化剂中部分La以La4Ga2O9形式存在。由图6(b)可知,反应前后LaCo0.7Ga0.3O3催化剂均出现在17.0和19.0 eV附近的特征峰对应Ga3+的电子结合能[36],结合XRD谱图证明反应前后催化剂中La4Ga2O9的存在。由图6(c)可知,对Co 2p谱峰进行分峰处理。778.4 eV附近的特征峰对应Co0的电子结合能,780.1和795.7 eV附近出现的特征峰以及相邻的卫星峰(satellite peak)分别对应于Co2+的Co 2p3/2和Co 2p1/2的电子结合能。表明反应后的LaCoO3和LaCo0.7Ga0.3O3催化剂表面均存在金属Co和Co2+。结合XRD表征结果,LaCoO3中的Co2+可以归因于反应过程中生成的Co2C;而LaCo0.7Ga0.3O3的Co2+可能是因为Co0在反应过程中或催化剂暴露于空气被氧化所致。与标准Co0电子结合能(777.9 eV)[37,38]和标准Ga3+电子结合能(17.4 eV)[36]相比,LaCo0.7Ga0.3O3催化剂中Co0电子结合能升高,Ga3+电子结合能降低。这可能是因为Ga离子与金属Co之间存在电子协同作用,含Ga化合物的形成使部分Co处于带正电状态。观察Co 2p峰的峰位置和形状,与反应后的LaCoO3催化剂相比,反应后的LaCo0.7Ga0.3O3的Co 2p的特征峰的形状和位置与金属Co的Co 2p1/2和Co 2p3/2峰很接近,且在主峰临近高结合能一侧的卫星峰的峰强小,这说明反应过程中LaCo0.7Ga0.3O3催化剂表面的Co0物种部分被氧化,催化剂是以金属Co和CoO的混合状态存在的[39],但XRD谱图中并未检测到CoO的衍射峰,这可能是因为反应过程Co颗粒氧化形成的CoO颗粒粒径小,分散度高的缘故。
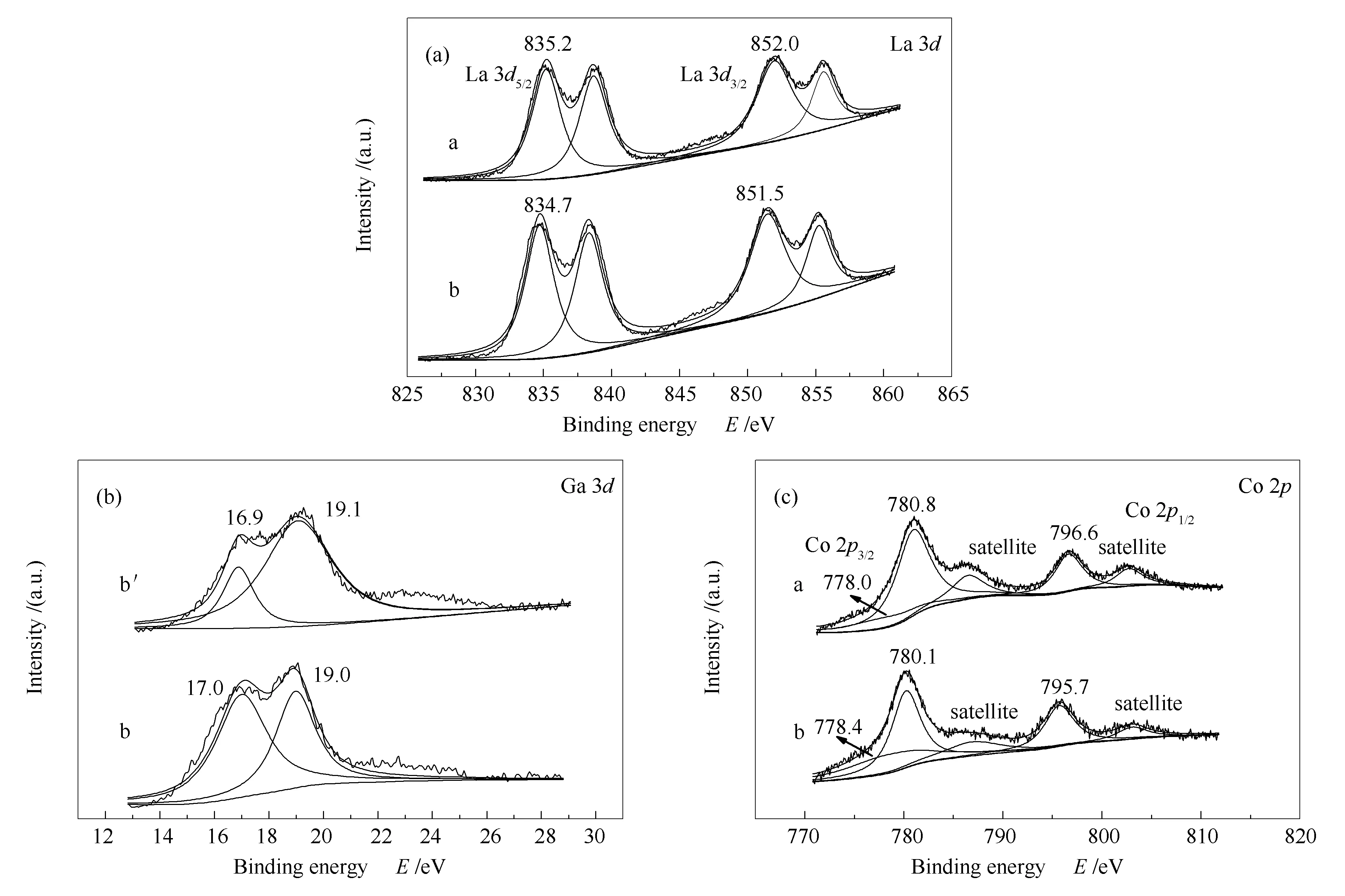
图 6 反应后的LaCoO3(a), LaCo0.7Ga0.3O3(b)和还原后LaCo0.7Ga0.3O3(b′)样品的XPS谱图
由表3可知,掺杂Ga后,催化剂表面Co/Σ[M]物质的量比明显低于体相,而Ga存在表面富集现象。这可能是因为含Ga的化合物(La4Ga2O9)与Co之间存在强相互作用,促进La4Ga2O9迁移到催化剂表面,表现为Ga元素的表面富集。
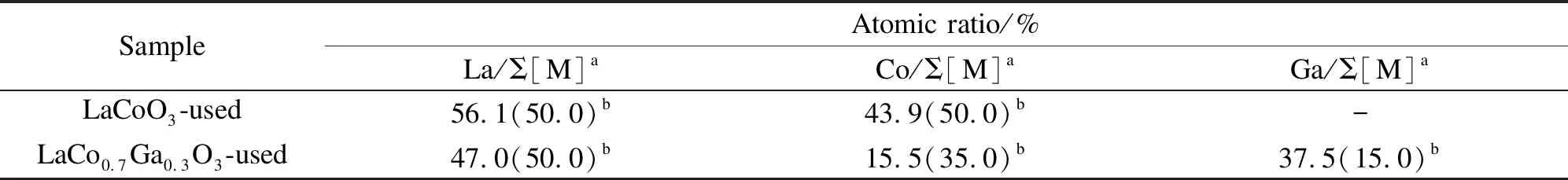
表3 通过XPS计算所得反应后的LaCo1-xGaxO3样品(x=0和0.3)表面组成
a: the atomic ratio of metal M is M/(La+Co+Ga) and the data in the parentheses are theoretical values
2.1.6 TEM表征
图7为LaCo0.7Ga0.3O3催化剂反应前后的TEM照片。图7(a)中可识别的较暗区域以及黑点归属于Co颗粒,还原后的催化剂表面活性组分Co颗粒分布比较均匀,Co颗粒的晶粒粒径为3.4-15.0 nm,平均晶粒粒径为7.7 nm,与H2-TPD表征计算结果相符。图7(a′)中高倍透射电镜照片中的晶格条纹分别对应金属Co的(100)晶面(晶面间距d=0.217 nm),La4Ga2O9的(022)以及(-221)晶面(晶面间距分别为0.391和0.324 nm),说明活性组分Co均匀地负载在载体氧化物上。类似的,图7(b)为反应100 h后的催化剂的TEM照片,其中,Co颗粒的晶粒粒径为4.3-19.9 nm,平均晶粒粒径为10.8 nm。对比图7(a)和图7(b)可知,反应后催化剂的活性组分发生轻微团聚烧结现象,在TEM照片上显示出不同的衬度,聚集体尺寸稍微变大。图7(b′)显示的晶格条纹与CoO(101)晶面(晶面间距d=0.245 nm)和La4Ga2O9(002)晶面(晶面间距d=0.547 nm)一致,而图7(b″)中晶面间距分别为0.205和0.324 nm的晶格条纹分别对应金属Co(111)晶面和La4Ga2O9(-221)晶面,与XPS表征结果一致。反应前后TEM表征结果对比再次证实反应气氛中的CO2或/和过程中产生的水使得部分Co颗粒被氧化成CoO。

图 7 还原后((a)和(a′))以及反应100 h后((b)、(b′) 和(b″))的LaCo0.7Ga0.303样品的TEM照片
2.1.7 TG表征
图8为反应后催化剂的TG曲线。由图8可知,反应48 h的LaCoO3催化剂的TG曲线出现两处明显的失重峰,分别归属于大分子烃类和石墨化炭的燃烧[40],总失重率约为15.4%,而相同反应条件下,反应48和100 h的LaCo0.7Ga0.3O3催化剂的TG曲线上只有一个归属于大分子烃类和无定型炭燃烧的失重峰,总失重率分别为7.8%和9.9%。所有样品在150-350 ℃均存在增重的现象,可归属于催化剂中的金属Co被空气气氛中氧气氧化的过程[41]。计算反应48 h的催化剂单位质量Co对应增质量,相比于反应后的LaCoO3(单位质量Co增重0.11 g),LaCo0.7Ga0.3O3在反应后的氧化增重现象并不明显(单位质量Co增质量0.02 g),这可能是因为反应过程中LaCo0.7Ga0.3O3中部分金属Co已经被氧化,结合性能测试结果,LaCo0.7Ga0.3O3催化剂反应过程中部分金属Co被氧化可能是液相分布不稳定的一个原因。
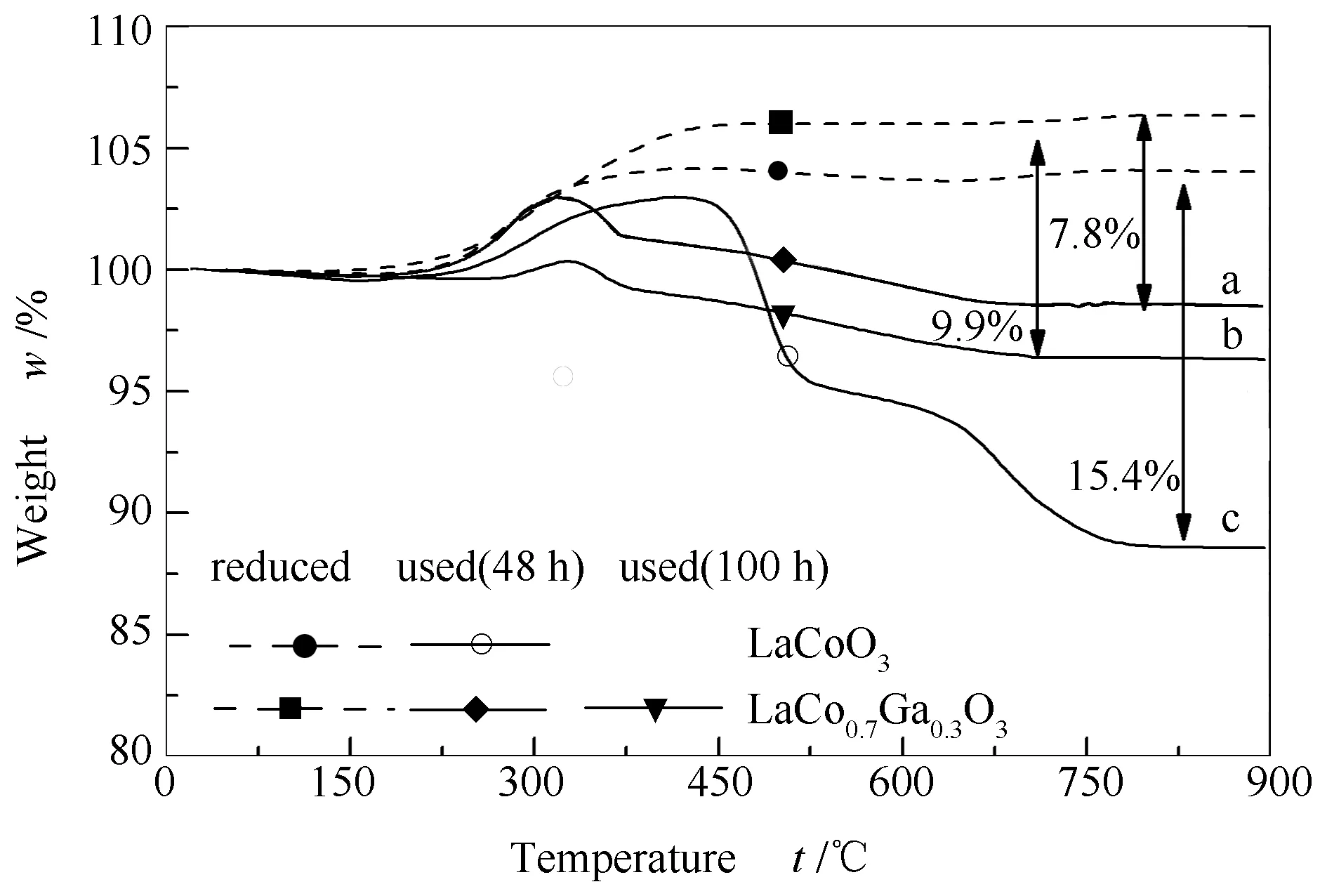
图 8 LaCo0.7Ga0.3O3样品反应48 h(a)、100 h(b)和LaCoO3样品反应48 h(c)的TG曲线
TG表征结果表明,Ga的掺杂提高了催化剂的抗积炭能力,这可能是因为两方面的原因,第一,氧空位的消积炭作用[42]:反应气氛中H2的还原作用促进La4Ga2O9表面氧空位的形成,在氧空位上吸附、活化的氧物种可以起到消积炭的作用;第二,Co2C是金属Co表面形成石墨化炭的中间物种[43]。如前所述,反应后的LaCoO3催化剂上存在Co2C物种,同时热分析结果显示反应过程中LaCoO3催化剂上形成石墨化炭;而XRD表征和热分析结果都表明反应后的LaCo0.7Ga0.3O3催化剂中检测不到Co2C,也无石墨化炭形成;这些结果相互印证。
2.2 催化剂的性能评价
2.2.1 钴镓比对催化性能的影响
表4为以LaCo1-xGaxO3为前驱体的催化剂催化CO2加氢制EtOH的CO2转化率和产物选择性。反应条件为:t=240 ℃,p=3MPa,n(H2)/n(CO2)=3.0,GSHV=3000 mL/(gcat·h),反应时间为18 h。由表4可知,随着镓含量的增加,CO2的转化率和CH4的选择性持续降低,总醇选择性持续升高,而总醇产物中的EtOH占比表现出先升高后降低的趋势,当x=0.3时达到最大。
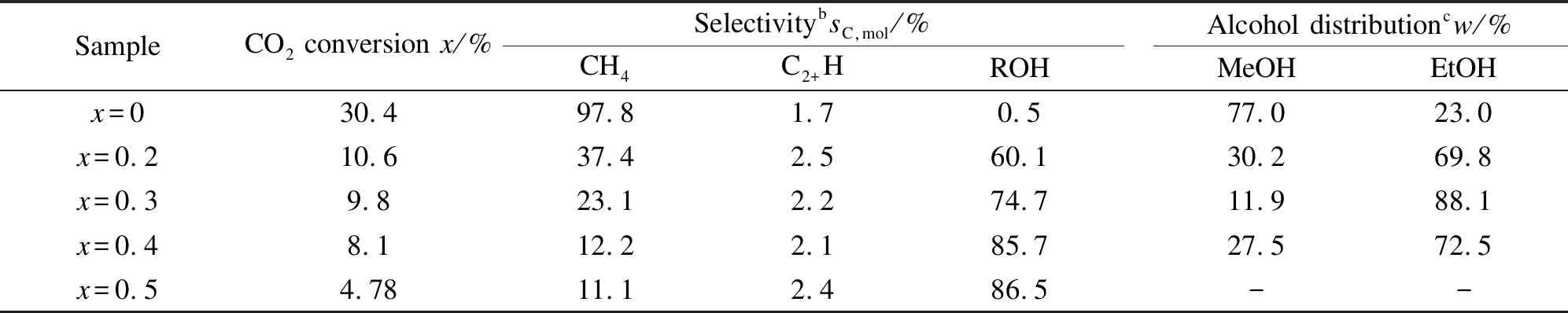
表4 LaCo1-xGaxO3(x=0、0.2、0.3、0.4和0.5)系列样品在CO2+H2的催化转化
a: reaction conditions: 240 ℃, 3 MPa,n(H2)/n(CO2) = 3.0, GSHV = 3000 mL/(gcat·h); the data were obtained after 18 h on stream;
b: product selectivity was based carbon molar quantity, defined as the carbon molar quantity in a carbon-containing product divided by converted carbon moles; C2+H represents hydrocarbons exclusive of methane;
c: alcohol distribution (mass ratio) is the weight fraction of each alcohol in total alcohols
其中,当x=0时,催化剂的CO2转化率达到30.4%,但CH4的选择性也高达97.8%,表现出Co基催化剂优异的CO2甲烷化的性能[18,19],而少量醇的形成可以归因于Co和Co2C的协同催化,这个已有报道[44]。当x=0.2-0.5时,LaCo0.7Ga0.3O3催化剂表现出良好的催化CO2加氢制EtOH的性能,当CO2转化率为9.8%时,总醇选择性达到74.7%,液相产物中的EtOH质量分数可达到88.1%。表5列出的是文献报道的一些用于CO2加氢反应的Co基催化剂[11,18,45]。由表5可以看出, 本研究高的EtOH选择性在已有的文献报道中难以找到。
结合XPS表征合理推断:Ga的掺杂影响催化剂的催化性能,使得CO2转化率降低;这是因为Ga的掺杂抑制催化剂表面Co元素的富集,催化剂表面的Co活性位点减少,并且Ga掺杂量的增加对应着催化剂中的Co含量降低(性能测试时,固定LaCo1-xGaxO3催化剂的总用量)。而CH4选择性降低,总醇产物中的EtOH占比增加,则是因为Co与Ga之间的相互作用使得催化剂界面处的部分Co以Coδ+的状态存在,Co和Coδ+的协同作用可以适当减弱金属Co的加氢性能,抑制CO2加氢生成CH4,并且促进EtOH的生成[46,47]。
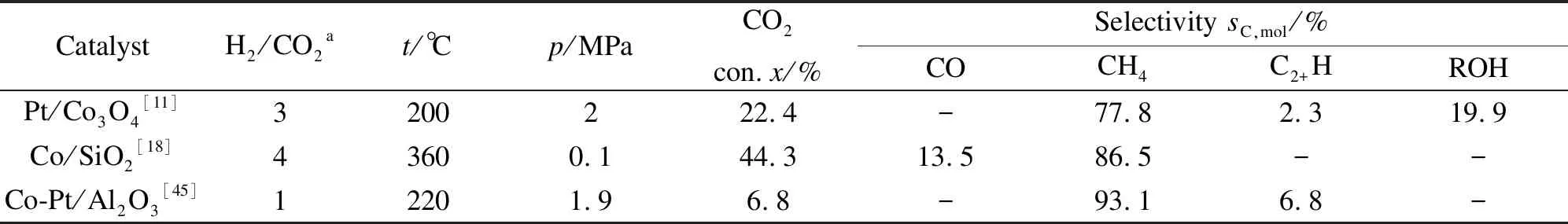
表5 Co基催化剂在适当反应条件下的CO2加氢活性和产物选择性[11,18,45]
a: the mole ratio of H2to CO2
2.2.2 反应温度和反应时间对催化性能的影响
图9为反应温度对LaCo1-xGaxO3催化剂(x=0、0.2-0.5)催化性能的影响。由图9可知,反应温度对LaCo1-xGaxO3催化剂的催化性能影响较大。相对于LaCoO3催化剂,LaCo1-xGaxO3催化剂(0.2-0.5)在整个反应温度区间(230-290 ℃)均呈现出高总醇选择性和高EtOH分布。具体来说,随着反应温度的升高,LaCo1-xGaxO3催化剂的CO2转化率升高(图9(a)),总醇选择性(图9(b))和液相产物中EtOH含量占比(图9(c))下降。而x=0.5时,虽然在230-270 ℃反应区间的总醇选择性下降不明显,但是CO2转化率一直保持在较低的水平(5%左右)。综合CO2转化率和EtOH选择性这两个评价催化剂性能的重要指标,选择240 ℃为最佳反应温度。
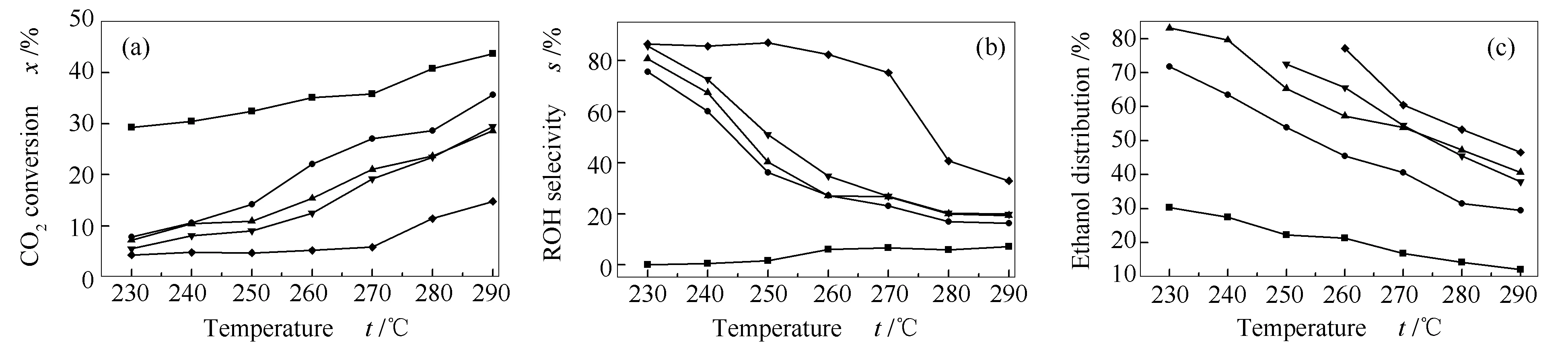
图 9 还原后的LaCoO3(■)、LaCo0.8Ga0.2O3(●)、LaCo0.7Ga0.3O3(▲)、LaCo0.6Ga0.4O3(▼)、LaCo0.5Ga0.5O3(◆)样品的CO2转化率(a)、总醇选择性(b)和乙醇分布(c)随反应温度的变化
图10为液相产物分布随反应时间的变化。

图 10 还原后LaCo0.7Ga0.3O3样品的液相分布随反应时间(h)的变化
由图10可知,随着反应的进行,液相产物中的MeOH质量分数逐渐增加,而EtOH质量分数相应减少。据文献报道[7],在CO2加氢制EtOH的反应中,Co基催化剂中的Co和CoO的相对含量影响液相产物中醇类分布。催化剂中的CoO含量的增加促进液相产物中的MeOH的生成。基于以上表征结果与文献阐述,本研究认为随着反应的进行,反应气氛中的CO2或/和水会使催化剂中的金属Co活性组分被部分氧化成CoO[48,49],导致液相醇分布发生变化。
2.2.3 反应机理分析
本研究提出初步机理:CO2和H2在Co/La2O3-La4Ga2O9催化剂上发生催化反应形成EtOH的过程是金属Co-Coδ+协同催化生成。
金属Co解离H2形成H*[11,18];金属Co解离吸附CO2,随后形成CH3*[7];Coδ+上发生CO2的非解离吸附,并接受金属Co上迁移来的H*形成HCOO*物种。随后分解形成CO*[18,19];CH3*与相邻的CO*耦合形成CH3CO*,加氢形成EtOH物质。
催化剂表面金属Co活性位点上形成的CH3*物种可以促进HCOO*物种转化为CH3CO*中间体,利于EtOH的生成。Coδ+是CO2非解离吸附的活性位,含Ga化合物La4Ga2O9起稳定Coδ+的作用。
3 结 论
本研究采用柠檬酸络合法合成一系列以LaCo1-xGaxO3(x=0、0.2-0.5)为前驱体的Co基催化剂,将其用于CO2加氢直接制EtOH反应。实验结果表明,相比于Co/La2O3,Co/La2O3-La4Ga2O9表现出优良的催化性能(适宜的CO2转化率,显著高的EtOH选择性,抗积炭能力强),其中,x=0.3时的催化剂表现出最佳的催化性能。表征结果表明,Ga的掺杂不仅可以提高催化剂表面活性组分金属Co的分散度,还通过形成含Ga化合物(La4Ga2O9)与金属Co产生相互作用使得界面产生Coδ+,Co和Coδ+协同作用促进EtOH的生成。

