ER阳性乳腺癌中FGFR1蛋白的表达与ER及预后的关系
王宇航,宋全福,吴俊强,南丁阿比雅斯,阿勒哈,庞 达,姜永冬
1.哈尔滨医科大学附属肿瘤医院乳腺外科,黑龙江 哈尔滨 150081;
2.阿勒泰地区人民医院肿瘤科,新疆维吾尔族自治区 阿勒泰 836000;
3.哈尔滨医科大学附属肿瘤医院病理科,黑龙江 哈尔滨 150081
乳腺癌作为女性常见的恶性肿瘤之一,全世界范围内每年乳腺癌新发病例约140万例,其发病率在发展中国家和发达国家中均呈逐年上升趋势,严重威胁人类健康[1-2]。在乳腺癌病例中,雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)阳性的患者比例约70%[3],且随着乳腺癌诊疗技术的日臻完善和辅助内分泌治疗的广泛应用,此类患者往往预后较好。然而,激素敏感型乳腺癌患者有时却并不能从内分泌治疗中获益,约30%的ER阳性患者内分泌治疗无效[4]。目前,内分泌治疗耐药已成为一个亟待解决的问题。
成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFRs)是一类具有自身磷酸化活性的受体酪氨酸激酶[5-7],在细胞的生长和分化、新生血管形成及损伤修复等诸多生物学过程中均发挥着重要作用[8-9]。FGFRs通过基因突变、融合蛋白、差异表达和受损的成纤维细胞生长因子(fibroblast growth factor,FGF)信号的减量调节等途径导致酪氨酸激酶受体持续活化,与包括乳腺癌在内的诸多恶性肿瘤的发生、发展密切相关[10-13]。FGFR1是FGFRs家族成员之一,有研究表明,FGFR1基因在约10%的乳腺癌中存在扩增,而该基因的扩增与其过表达直接相关,并能够导致乳腺癌复发转移增加及患者生存率降低,尤其在ER阳性和(或)低分化的乳腺癌中更为显著[14]。同时,FGFR1的高表达常与ER阳性乳腺癌患者的内分泌治疗耐药有关,这一现象已得到证实[15],但其导致耐药的具体作用机制目前尚无定论。这提示FGFR1对乳腺癌预后的不良影响,有相当一部分原因来自其对于抗雌激素治疗的负面作用。因此,研究FGFR1介导的内分泌治疗的耐药机制,对于改善ER阳性乳腺癌患者的预后具有重要临床意义。
既往研究发现,FGFR1高表达常发生于Luminal型乳腺癌中,并且FGFR1的表达与患者的ER及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER 2)状态有关[16],这些现象均提示FGFR1与ER之间存在潜在关系。因此,本研究通过检测ER阳性乳腺癌样本中FGFR1蛋白水平,结合患者的临床病理特征加以统计分析,试图明确FGFR1蛋白的表达与乳腺癌临床病理学特征,尤其是与患者ER表达水平之间的关系,并探讨FGFR1蛋白的表达与ER阳性乳腺癌预后的相关性。
1 材料和方法
1.1 研究对象
本研究选取哈尔滨医科大学附属肿瘤医院2008年9月—2011年12月收治的184例ER阳性乳腺癌患者,平均年龄为(50.16±10.47)岁。入选患者均是于哈尔滨医科大学附属肿瘤医院首次确诊,通过术前乳腺穿刺活检或手术切除活检证实为乳腺癌,根据术后免疫组织化学分析结果确定患者的ER状态。入选者要求无其他肿瘤病史或肿瘤家族史,术前未接受新辅助放化疗。患者的一般情况见表1。

表1 研究对象的基本特征Tab.1 Disease characteristics of the study population[n (%)]
1.2 免疫组织化学方法
入选的184例乳腺癌患者的组织样本均采用免疫组织化学方法检测FGFR1蛋白的表达情况。采用Benchmark XT自动染色仪(美国Ventana Medical Systems公司)进行免疫组织化学染色,使用的FGFR1抗体(兔抗人多克隆抗体,英国Abcam公司)的稀释比例为1∶2 000。简要操作步骤如下:取4 μm厚的石蜡组织切片,经脱蜡、水化、梯度乙醇(95%、75%和50%)处理后,置于PBS中漂洗。加入3%H2O2耗竭内源性过氧化物酶,而后依次温育一抗和二抗并显色。FGFR1高、低表达的典型组织切片见图1。ER、PR、HER-2、Ki-67、p53(ZM-0104、ZM-0215、ZM-0065、ZM-0165和ZM-0405,均为小鼠抗人单克隆抗体,北京中杉金桥生物技术有限公司)的免疫组织化学方法同上。
免疫组织化学染色结果判定:① ER和PR可见明显细胞核着色且≥1%为阳性,无着色或阳性肿瘤细胞数<1%和着色弱且阳性肿瘤细胞数>1%为阴性[17],同时根据Allred等[18]的评分方法,依照阳性细胞所占比例分为1+、2+、3+。② HER-2可见细胞膜着色,>10%的肿瘤细胞呈现强、完整、均匀细胞膜着色(3+),定义为阳性;无着色或≤10%的肿瘤细胞呈现不完整的微弱的细胞膜着色(0分),>10%的肿瘤细胞呈现不完整的微弱的细胞膜着色(1+),两者为阴性;>10%的肿瘤细胞呈现不完整和(或)弱至中等强度的细胞膜染色或≤10%的肿瘤细胞呈现强而完整的细胞膜染色(2+),均为不确定性[19]。③ Ki-67、p53抗体染色阳性结果为肿瘤细胞的细胞核呈棕黄色或棕褐色颗粒,Ki-67标记指数判断标准根据St.Galeen共识,阳性细胞数≥14%为高阳性率,<14%为低阳性率[20];p53判断标准,阳性细胞数>10%为阳性,≤10%为阴性。④ FGFR1蛋白表达于细胞膜及细胞质内,以所有细胞中染色阳性细胞的百分率(0%~100%)进行评估,选用10%的临界值作为高低表达的评判标准[21],≥10%为FGFR1蛋白高表达,<10%为FGFR1蛋白低表达(图1)。所有免疫组织化学切片由2名病理医师分别阅片,结果一致者为最后判定。
1.3 统计学处理
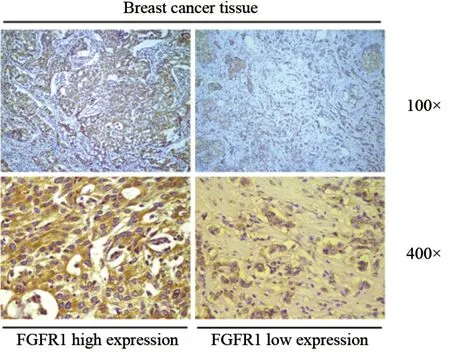
图1 ER阳性乳腺癌组织切片中FGFR1蛋白表达情况Fig.1 Representative sections of FGFR1 protein expression in ER-positive breast cancer
使用SPSS 13.0软件对数据进行统计学分析。采用χ2检验分析FGFR1蛋白水平与乳腺癌临床病理学特征的关系,Spearman相关分析评估变量间是否存在相关性;采用Kaplan-Meier法进行单因素生存分析,并绘制总生存曲线;采用COX回归进行多因素生存分析,以评估乳腺癌风险因素。显著性检验均采用双侧概率检验,P<0.05为差异有统计学意义。
2 结 果
2.1 FGFR1蛋白水平与ER阳性乳腺癌患者临床病理特征的关系
本研究对184例ER阳性乳腺癌患者的FGFR1蛋白水平进行了检测,并通过χ2检验分析FGFR1蛋白水平与ER阳性乳腺癌临床病理学特征的相关性(表2)。结果显示,FGFR1蛋白高表达的患者比低表达的患者更易发生淋巴结转移(P=0.012),且FGFR1蛋白的表达与ER的表达水平显著相关(P=0.011)。进一步通过Spearman相关分析发现,FGFR1表达水平与淋巴结转移正相关(r=0.186),与ER表达水平负相关(r=-0.221)。此外,在肿瘤临床分期、肿瘤大小、组织学分级、PR、HER-2及P53水平上,FGFR1高低表达的患者间无显著性差异(P>0.05)。
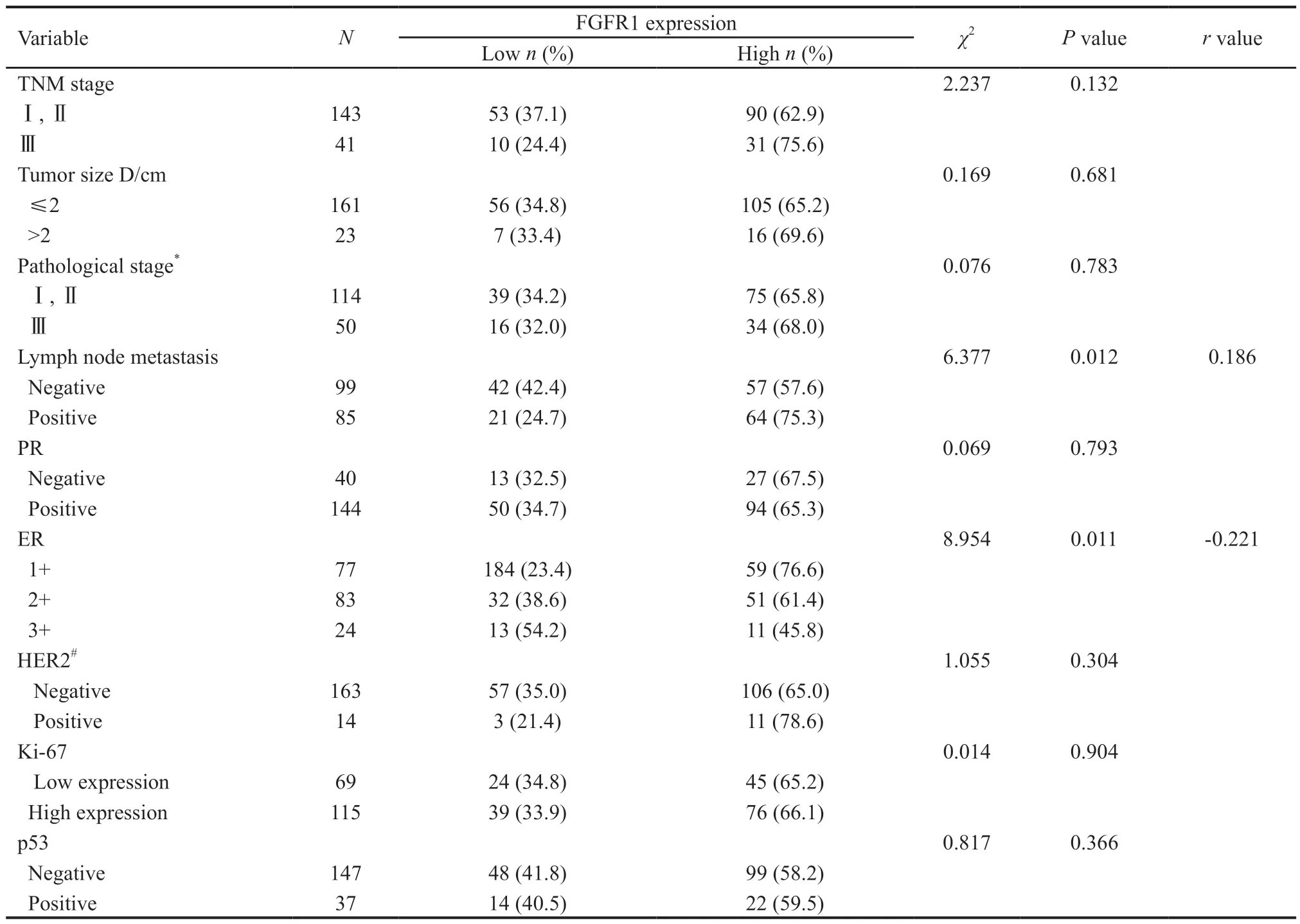
表2 FGFR1蛋白的表达与ER阳性乳腺癌患者临床病理特征的相关性Tab.2 Associations between FGFR1 expression and clinicopathological features of ER-positive breast cancer
2.2 FGFR1蛋白水平对ER阳性乳腺癌患者预后的影响
本研究对临床分期、肿瘤大小、组织学分级、淋巴结转移情况、ER、PR、HER-2、Ki-67标记指数、P53和FGFR1蛋白水平等预后因素进行了分析。在COX单因素分析中,ER阳性乳腺癌患者的临床分期、淋巴结转移情况、Ki-67阳性率与FGFR1蛋白的表达水平及预后显著相关(表3)。

表3 COX风险比例模型中相关因素对乳腺癌预后的影响Tab.3 Prognostic factors of ER-positive breast cancer in COX regression analysis
为消除混杂因素及各因素之间交互作用的影响,本研究将单因素分析中临床分期、淋巴结转移情况、Ki-67阳性率和FGFR1蛋白的表达共同纳入COX多因素分析进行统计。结果表明,淋巴结转移情况和Ki-67阳性率是ER阳性乳腺癌患者预后的独立风险因素,OR为1.744(95%CI:1.002~3.034,P=0.049)和1.882(95% CI:1.015~3.491,P=0.045)。此外,本研究还运用Kaplan-Meier法对不同FGFR1表达水平的ER阳性乳腺癌患者的总生存率进行了分析(图2)。结果显示,FGFR1蛋白高水平的患者的总生存率比低表达的患者更低,预后较差(P=0.036)。
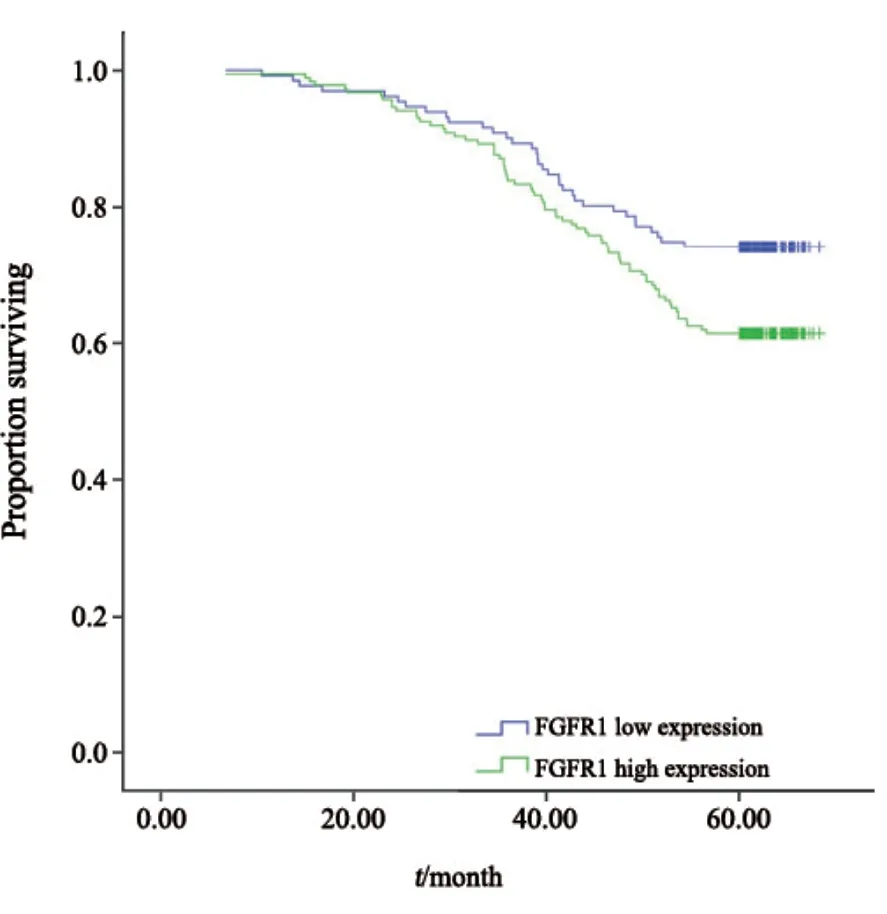
图2 FGFR1蛋白水平与ER阳性乳腺癌患者总生存时间的关系Fig.2 Kaplan-Meier analysis for overall survival in ER-positive breast cancer patients,based on FGFR1 protein level
3 讨 论
为研究FGFR1表达对ER阳性乳腺癌患者的影响,本研究通过免疫组织化学法检测了184例ER阳性乳腺癌患者的FGFR1蛋白水平。结果显示,FGFR1高表达的患者更易发生区域淋巴结转移,且FGFR1蛋白的表达水平与患者ER的表达水平呈显著负相关。此外,FGFR1是ER阳性乳腺癌患者的预后因素之一,FGFR1高表达显著降低患者的总生存率。
FGFR1基因定位于染色体8p12上,已有大量研究证实该区域的拷贝数增加与FGFR1过表达显著相关,并且约10%的乳腺癌中存在FGFR1基因扩增[22-24]。在正常生理条件下,FGFR1的表达促使丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)及蛋白激酶B的转录激活,最终调控管腔上皮细胞的生长和分化,与乳腺正常生长发育密不可分[25]。而异常高表达的FGFR1则能够导致MAPK和磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)等信号通路的异常激活[26-27],且后者的活化与包括乳腺癌在内的诸多恶性肿瘤的发生、发展密切相关。目前,关于FGFR1基因扩增与乳腺癌相关性的研究较多,较为一致的观点认为其与乳腺癌患者的预后及对内分泌治疗的反应有关。Turner等[15]的研究表明,在Luminal型乳腺癌中,FGFR1基因扩增和过表达可能导致预后较差,与内分泌治疗耐药有关,并且还发现FGFR1基因拷贝数增加与FGFR1蛋白的表达水平升高存在一定关联。Elsheikh等[14]的研究表明,FGFR1基因扩增是乳腺癌的独立预后因素。而本研究选取的研究对象均为ER阳性的乳腺癌患者,证明FGFR1蛋白的表达水平是ER阳性乳腺癌的预后因素之一,这与现有研究的结论相一致。
已有研究表明,FGFR1基因扩增能够导致ER阳性乳腺癌患者内分泌治疗耐药。Balko等[28]的研究发现,1例术前接受来曲唑治疗的双侧乳腺癌患者,其两侧病灶对内分泌治疗的反应不同,进一步对患者的肿瘤组织样本进行基因芯片检测,结果提示内分泌治疗效果较差的肿瘤组织中存在明显的FGFR1基因扩增。此外,联合应用布立尼布能够增强他莫昔芬对ER阳性乳腺癌的疗效[29]。目前,FGFR1介导内分泌治疗耐药的作用机制仍未明确。有研究认为FGFR1可能通过雌激素依赖/非依赖途径激活MAPK和PI3K等肿瘤相关通路,进而代偿雌激素信号的缺失[14-15,30]。也有研究观察到FGFR1信号通路的激活能够抑制患者PR的表达[16],这可能从一定程度上加剧了乳腺癌对内分泌治疗药物的抵抗。而Formisano等[31]对应用来曲唑治疗的ER阳性肿瘤患者进行Ki-67、FGFR1和RNA测序研究,雌激素缺乏的ER/FGFR1扩增细胞的芯片分析显示,FGFR1和ERα与DNA结合,并且调节ER依赖基因的转录表达,用来曲唑治疗的FGFR1基因扩增患者肿瘤的RNA测序数据显示雌激素反应活跃且E2F靶基因丰富。ERα通路在雌激素缺乏的ER+/FGFR1-扩增乳腺癌中仍然有效。众所周知,乳腺癌患者ER的状态与其对抗雌激素药物的敏感性关系最为密切,而目前未见对FGFR1与ER表达水平之间的相关性进行分析的研究报道。本研究发现,FGFR1的表达与ER阳性乳腺癌ER水平负相关,提示FGFR1可能通过抑制肿瘤细胞ER的表达介导内分泌治疗耐药,该结果与之前的研究互为补充。
综上所述,本研究从蛋白水平证实了FGFR1高表达对ER阳性乳腺癌预后的不良影响,并发现FGFR1蛋白水平与患者ER状态之间呈负相关。这些发现为探索乳腺癌内分泌治疗耐药机制提供了新思路,并且支持抗雌激素治疗失败的乳腺癌患者联合应用FGFR1拮抗剂以逆转内分泌治疗耐药,从而改善患者的预后,延长生存期。

