胆囊转移性恶性黑色素瘤伴结石误诊为息肉1例
胡英男,徐菁铭,吴 靖,傅永清,周 剑,黄 捷
1 临床资料
患者女性,70岁。因右上腹胀痛不适3 d,于2018年10月31日入院。患者3 d前因饱食油饼后夜间自觉右上腹胀痛不适,呈间歇性,伴有呃逆、反酸、嗳气。无肩背放射痛,无黑便,无发热等。于当地医院行B超检查,示胆囊内偏低回声团,首先考虑腺瘤。既往体质良好,3年前曾因右足跟黑痣行浅表肿物切除术,病理诊断恶性黑色素瘤。辅以达卡巴嗪化疗,定期复查血清指标及胸部CT等,未见明显转移征象。无吸烟史及饮酒史,无家族性肿瘤病史。体格检查:神志清,体态偏胖。全身皮肤及巩膜无黄染,浅表淋巴结未及明显肿大。心肺无异常。全腹部平软,轻压痛,无反跳痛,无腹肌紧张,肝脾肋下未及,未扪及明显包块。墨菲征阴性。右足跟可见陈旧性手术疤痕。CYFRA21-1 3.37 ng/mL,总胆固醇6.73 mmol/L。血常规、余肿瘤类指标、凝血四项等未见异常。上腹部平扫加增强CT,胆囊体部见一结节影,直径约2 cm。增强扫描明显强化,胆囊边界清晰。肝、脾、胰腺及腹腔内淋巴结未见明显异常(图1)。诊断为胆囊内占位,考虑胆囊息肉。静吸复合麻醉下行腹腔镜胆囊切除、肠粘连松解术。术中见胆囊略水肿,与周围组织黏连,胆囊三角区欠清。胆总管不粗。右上腹网膜粘连明显。切除胆囊,冰冻病理示胆囊恶性肿瘤,首先考虑神经内分泌肿瘤(图2)。病理诊断为胆囊转移性恶性黑色素瘤,胆囊结石。大体标本(图3):胆囊体部见一肿块1.5 cm×1.2 cm×0.8 cm。另见游离肿块2.2 cm×1.3 cm×0.8 cm。镜下(图4):肿瘤细胞圆形,排列成巢团状,细胞中-重异型,核仁明显,核分裂像多见(>20个/10 HPF),肿瘤细胞部分胞浆淡染,可见黑色素沉着,肿瘤浸润胆囊壁全层至浆膜下。胆囊颈切缘阴性,胆囊颈淋巴结1枚呈反应性增生。免疫组化染色结果(4):P53(10%+)、Ki-67(30%)、CKpan(-)、CK7(-)、P40(-)、Syn(-)、CgA(-)、CD56(-)、LCA(-)、MLH1(+)、PMS2(+)、MSH2(+)、MSH6(+)、HMB-45(+)、MelanA(+)、HER-2(-)特殊染色结果:Perls(-)。术后随访3个月,患者身体状况良好。
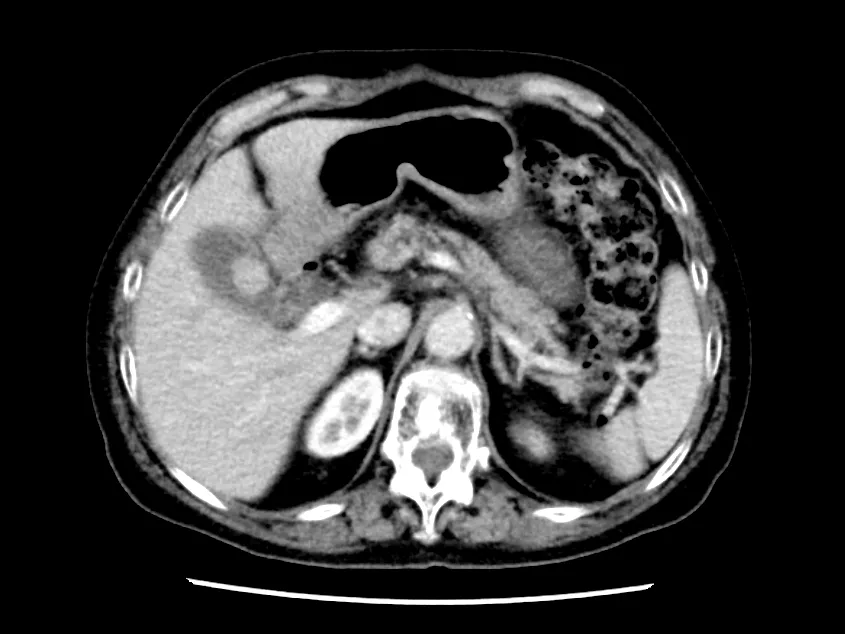
图1 增强CT示胆囊体部见一结节影,直径约2 cm,胆囊边界清晰。肝、脾、胰腺及腹腔内淋巴结未见明显异常。诊断胆囊内占位,考虑胆囊息肉
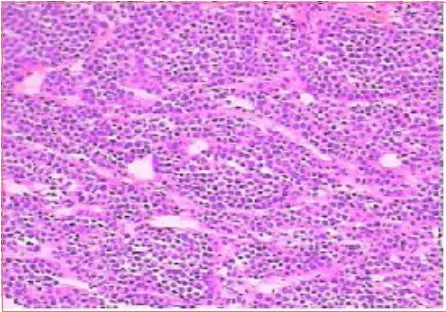
图2 肿瘤细胞大小一致,呈现小梁状或腺管样排列为主,染色质细,未见明显核仁(HE100×)
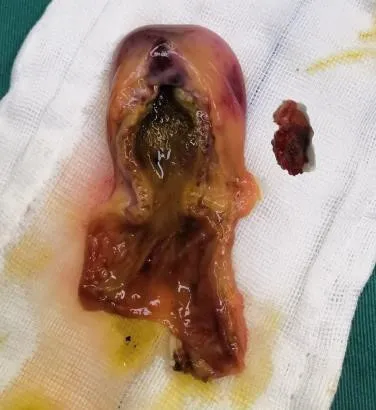
图3 胆囊稍水肿,腔内少量泥沙状小结晶,体部见一肿块1.5×1.2×0.8 cm,另见,游离肿块:2.2×1.3×0.8 cm
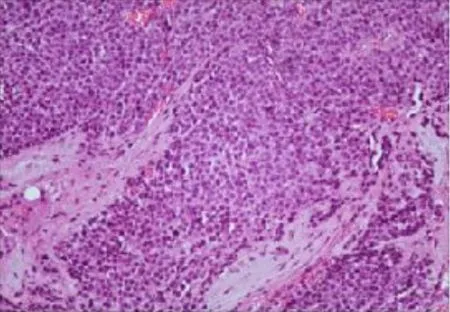
图4 肿瘤细胞圆形,排列成巢团状,细胞中-重异型,核仁明显,核分裂像多见(>20个/10HPF),肿瘤细胞部分胞浆淡染,可见黑色素沉着(HE 100×)
2 讨论
恶性黑色素瘤是源于神经嵴黑色素细胞的恶性变,是一类侵袭力极强的高度恶性肿瘤,占全部恶性肿瘤的0.18%[1]。目前,其发病率逐年增加,年增长率约为 3%~5%[2],中老年人多见。常发生于皮肤黏膜的任何部位,多见于下肢足部,表现为广泛转移到软组织、肺、脑和肝等全身各个脏器为特征[3]。黑色素瘤仅有2%~4%的患者发生胃肠道系统转移,在此类患者中约15%伴有胆囊转移[4]。而胆囊转移性疾病中,黑色素瘤约占50%~65%[5]。胆囊作为恶性黑色素瘤转移的靶器官之一,极少作为孤立的转移脏器存在,往往是其广泛转移的一部分,确诊时已是疾病后期。这使得胆囊转移性恶性黑色素瘤的诊断更为复杂。
胆囊转移性恶性黑色素瘤罕见,缺乏典型的临床症状及体征。少数患者生存期内未出现异常症状,临床上以急性胆囊炎最常见,其次是胆道梗阻导致胆管炎和黄疸,瘘管形成和胆道出血也会发生[6]。主要表现为右上腹突发性疼痛难忍,并放射至肩背部、腹胀纳差、恶心呕吐、发热,体检右上腹压痛及墨菲征阳性等。本例患者以腹胀不适为著,疼痛感不明显,无放射痛,无发热,墨菲征阴性。与胆囊息肉表现相似,这也是误诊的原因。恶性黑色素瘤无特异性指标,miRNA 标记物等仍需研究验证[7]。该患者CYFRA21-1 、总胆固醇稍高,可能与其年龄及喜嗜油腻食物相关。
该病常用的影像学检查包括B超、CT和MRI。B超因简单易行安全性高,且能直接显示胆囊内肿物或息肉大小、形态、血流状况及有无伴有胆囊结石等,成为本病首选的筛查手段。胆囊腔内转移性病灶通常直径>1 cm且附着于胆囊壁,一般呈现单发息肉样、多发扁平或浸润性表现。本例B超示胆囊壁上呈单发息肉隆起样病变,直径>2 cm,考虑腺瘤可能。CT检查准确定位病灶的位置及转移情况,且对实质性器官状况作出评估,有助于术前制定手术方案。本例CT检查提示胆囊内占位,未见邻近脏器及淋巴结转移征象。一般来说,恶性黑色素瘤MRI上表现为T1WI高信号,T2WI低信号[8]。但疾病晚期黑色素细胞降低或伴有出血、坏死等因素,MRI呈现不典型情况。Furumoto等[9]曾报道1例转移性恶性黑色素瘤,MRI表现为T1WI低信号,T2WI高信号,提示疾病晚期可能。另外,PET-CT由于价格昂贵而不常使用,但对于微小病灶的探查、疾病早期的诊断以及全身转移性病变具有独特的作用,不应被忽视。术中冰冻病理有错误可能,与本文术中冰冻病理提示神经内分泌肿瘤报道一致。总之,本病术前及术中难以确诊。胆囊恶性黑色素瘤的诊断最终依靠病理及免疫组化结果,但病灶仍不易辨别原发性或转移性。
目前,胆囊原发性恶性黑色素瘤公认的诊断标准[10]为局限于胆囊黏膜浅层的孤立性病灶,呈息肉状或乳头状,伴有交界性变化;排除其他部位的原发灶且无黑色素瘤病史。本例患者既往恶性黑色素瘤病史明确,结合辅助检查、术后病理及免疫组合结果,诊断为胆囊转移性恶性黑色素瘤。此外,胆囊黑色素瘤通常不合并胆囊结石[11],而本例术后病理示胆囊结石存在,患者就诊时异常症状可能与之相关。
本病预后较差。转移性黑色素瘤的中位总生存时间为7.5个月,5年生存率为6%[12]。本病标准化治疗策略缺乏共识。目前,手术是主要且有效的治疗方法[13],尤其以孤立的、可切除的胆囊转移瘤患者效果更佳。手术的治疗目标在于缓解异常症状,减少肿瘤并发症和提高总体生存率。Dong等[14]报道,病变局限于胆囊内的患者行手术治疗,1年生存率为100%;而未切除的多病灶转移患者,1年生存率为0%。Katz等[15]报道9例本病患者,行手术治疗后,其异常症状均不同程度缓解,生存期得以延长。此外,即便对于广泛转移的患者,仍受益于姑息性胆囊切除术[16]。其中手术的时机、切除的范围以及腹腔镜的应用与否仍有争议[13]。参考既往文献及结合本例体会,笔者认为,既往曾患恶性黑色素瘤者,一旦考虑本病存在,病情可耐受情况下,应尽早行手术治疗。其次,该病术前诊断困难、远处转移迅速、瘤体易在腔内生长等特点[17],术中行单一的胆囊切除术已经足够,不必额外扩大手术范围。特别是本病确诊后,更应详细追溯相关病史、仔细查体寻找有无其他转移灶;必要时可行其他部位影像学检查或PET-CT,以探查潜在的微小病灶。针对原病灶的复发及转移情况,及时采取手术等治疗措施。本病应用腹腔镜切除胆囊,部分学者[16,18]持有保留意见。其原因在于,腔镜下难以直观触摸腹腔内脏器、肠管及淋巴结等可疑转移灶,同时会造成穿刺孔处转移风险。但开腹的腹壁切口同样有此类风险[19],直接探查转移灶依赖于术者的经验。Seelig[20]与Kohler 等[21]各报道1例,行腹腔镜切除胆囊均未发生穿刺孔处复发。考虑为术中标本袋的使用,降低了上述风险。鉴于腹腔镜具有多角度探查病灶、避免粘连、创伤小等优点,对于本病是一种更好的选择。其他治疗方法如放疗、化疗和免疫治疗等,效果尚不明确。基于特定标记物的个性化治疗,已逐步成为本病研究热点[22]。该患者确诊恶性黑色素瘤3年后,仅发生胆囊转移病灶而未见其他转移征象,这与当时手术效果、化疗疗效及患者体质有一定的关系。
该病术前诊断困难,易误诊,侵袭力、转移性强,恶性程度高,预后差。手术治疗可以有效缓解异常症状,甚至延长生存期。对于既往曾患恶性黑色素瘤病史者,应警惕本病发生。
——中国居民收入分配中的逆向调节机制

