红豆树种子化学成分及其抗氧化和抑菌活性研究
翟大才,房 震,汪 勇,张明亮,胡宗浩,李 强,柏晓辉*
1 黄山学院生命与环境科学学院,黄山 245041;2 安徽省祁门县查湾森工采育场,黄山 245600;3 黄山学院分析测试中心,黄山 245041
红豆树学名(OrmosiahosieiHemsl.Et Wils.),是隶属于红豆树属(OrmosiaG.Jacks)的一种落叶乔木或半常绿乔木,也是我国II级重点保护的特有树种[1]。红豆树天然分布于湖北、四川、江西、浙江、福建等省,在安徽也有零星栽培[2]。红豆树木材纹理美观有光泽、耐腐蚀强而常被用于制作各种家具、地板或装饰品;其根、皮、茎和叶都可入药,用于治疗无名肿毒、风湿关节炎等病症[1]。
红豆树木材珍贵,多年来砍伐现象严重,导致其野生自然资源非常稀少,甚至已近枯竭;这促使人们不断研究红豆树人工栽培技术,但存在红豆树种子产量低且大小年现象明显,繁殖材料缺乏,发芽困难,培育幼苗难[3]等问题。
目前,对红豆树种子的研究主要集中在种子萌发规律[4]、不同水温浸泡[4]和机械破皮[5]对种子萌芽率的影响、种子和幼苗性状变异分析[6]等,而对其种子化学成分及其生物活性研究还处于空白阶段。因此,本课题组以红豆树种子为材料,利用不同极性溶剂对其生物活性物质进行萃取,并结合气相色谱-质谱联用技术(GC-MS)对其化学成分进行鉴定;同时,采用DPPH和ABTS法及抑菌圈实验评价其生物活性物质的体外抗氧化及抑菌活性,以期为红豆树种子资源的开发和综合利用提供科学依据。
1 材料与方法
1.1 试剂与材料
1.1.1 试剂与仪器
过硫酸钾(K2S2O8)、石油醚、正丁醇、乙酸乙酯、甲醇等试剂均为分析纯,购自于上海国药集团;1,1-二苯基-2-三硝基苯肼(DPPH)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)均为分析纯,购买于东京化成工业株式会社;蛋白胨、Yeast Extract、琼脂和维生素C(Vc)等生化试剂购买于上海生工有限公司。
SQ510C灭菌锅(重庆雅马拓科技公司)、ZHJH-C1106B超净工作台(上海智城分析仪器公司)、Agilent 7890A-5975C型气相色谱-质谱联用仪(美国 Agilent 公司)、UV754N紫外可见分光光度计(上海精密科学仪器公司)。
1.1.2 实验材料
本实验中所用红豆树种子(凭证标本采集号-05;采集人:翟大才;鉴定人:潘健博士;采集地点:安徽歙县;采集时间:2018年11月24日)采集于安徽歙县坑口乡。
抑菌实验所用LB(Luria-Bertani)平板培养基参照文献[7]方法配制,所用受试菌株金黄色葡萄球菌(Staphylococcusaureus)、苏云金芽孢杆菌(Bacillusthuringiensis)、枯草芽孢杆菌(Bacillussubtilis)、大肠杆菌(Escherichiacoli)、绿脓杆菌(Pseudomonasaeruginosa)和鼠伤寒沙门氏菌(Salmonellatyphimurium)均购买于中国典型培养物保藏中心并保存于本校微生物学实验中心。
1.2 实验方法
1.2.1 红豆树种子成分的提取
称取30.0 g新采集的红豆树种子置于粉碎机中完全粉碎至粉末状,将粉末置于圆底烧瓶中并按料液比1∶16(g/mL)加入甲醇后充分混匀,60 °C恒温萃取3 h后收集过滤后的上清液,过滤残渣再按照上述提取步骤重复提取2次;合并3次提取液后用旋转蒸发仪60 °C恒温蒸发得到甲醇提取物。将甲醇提取物小心收集后称重,然后用100 mL双蒸水重悬甲醇提取物,混匀后依次用石油醚、乙酸乙酯和正丁醇等按体积比1∶1进行萃取,每种试剂萃取3次后合并萃取液并用旋转蒸发仪浓缩,分别收集每种试剂的萃取物并称重;再用二甲基亚砜(DMSO)分别将上述萃取物配制成10 mg/mL后4 °C保存备用。
1.2.2 红豆树种子甲醇提取物GC-MS分析
选用石英毛细管柱DB-5 MS(30 m × 250 μm × 0.25 μm)为色谱柱,0.5 μL样品以无分流方式进样; 99.999%氦气为载气,流速为1.0 mL /min;柱箱程序升温,起始温度60 °C,以5 °C /min升至160 °C保持8 min,再以5 °C /min 升至 260 °C保持5 min,运行时间为 56 min。
离子源为电子轰击(EI)源,电子能量为70 eV,离子源温度设为 230 °C,四极杆温度设为150 °C;扫描范围设为m/z50.0~500.0,标准谱库NIST08作为质谱数据库。
1.2.3 红豆树种子萃取物对DPPH自由基的清除能力
参照文献[8]方法并适当改善测定红豆树种子萃取物对DPPH自由基的清除能力,简述如下:分别取100 μL DMSO稀释的红豆树种子正丁醇、乙酸乙酯和石油醚萃取物加到0.06 mmol /L DPPH-乙醇(95%)溶液中配制成不同浓度;混匀后避光反应,并在517 nm波长处测定其吸光值(Ax)。在DPPH乙醇溶液中加入100 μL DMSO为空白对照,测其吸光值(A0);阳性对照为Vc,每组样品重复 3 次,以平均值按公式(1)计算清除率。
清除率(%)=[(A0-Ax)/A0]× 100%
(1)
1.2.4 红豆树种子萃取物对ABTS自由基的清除能力
依据文献[9]方法测定红豆树种子萃取物对ABTS自由基的清除能力。取7 mmol /L ABTS与2.45 mmol /L K2S2O8溶液按体积比1∶1混匀并于暗处反应。用甲醇将上述反应液稀释至波长734 nm处吸光值为0.68~ 0.72。分别移取不同浓度的红豆树种子正丁醇、乙酸乙酯和石油醚萃取物200 μL至2 mL暗处反应后的ABTS与K2S2O8混合液中,混匀反应6 min并测其吸光值(Ax)。200 μL甲醇与2 mL的ABTS与K2S2O8混合液反应后吸光值为A0。200 μL不同浓度红豆树种子正丁醇、乙酸乙酯和石油醚萃取物与2 mL甲醇溶液反应后吸光值为Ay。每组样品重复 3 次,以平均值按公式(2)计算清除率。
清除率(%)=[1-(Ax+Ay) /A0]× 100%
(2)
1.2.5 红豆树种子萃取物的抑菌活性
参考文献[7]方法测定红豆树种子萃取物的抑菌活性,测量不同受试菌抑菌圈的大小并记录,每组样品重复3次,求平均值来分析。
2 结果与分析
2.1 红豆树种子化学成分的分析
用GC-MS对红豆树种子的甲醇粗提取物进行分析,得到其总离子流结果(图1),利用峰面积归一法对各组分的相对含量进行计算,结果见表1。从图1离子流结果知,从红豆树种子粗提取物中共分离出17个色谱峰;将此17个色谱峰与标准谱库NIST08的质谱峰进行比对共鉴定出12个化合物(表1),占粗提取物总量的89.03%。鉴定的12个化合物中相对含量高于2.00%的依次为5-羟甲基糠醛(52.98%)、D-阿洛糖(7.24%)、2,3-二甲氧基-10,11-二氢二苯并(b,f)恶庚英-10-醇(6.51%)、甲基丁香酚(4.53%)、2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮(4.45%)、黄樟素(3.75%)、α-松油醇(3.31%)、2,6-二甲氧基苯酚(2.01%),此8种成分占总量的84.78%。

图1 红豆树种子萃取物GC-MS总离子流图Fig.1 The total ion chromatogram of the extraction of the seed of O.hosiei Hemsl.Et Wils.
2.2 红豆树种子萃取物的抗氧化作用
2.2.1 红豆树种子萃取物对DPPH自由基的清除作用
测定红豆树种子正丁醇、乙酸乙酯和石油醚等萃取物对DPPH自由基的清除作用,结果见图2。从测定的结果可知,正丁醇、乙酸乙酯和石油醚等萃取物对DPPH自由基有明显的清除作用,且萃取物浓度与清除率间呈正相关,随着萃取物浓度的逐渐增大,DPPH清除率逐步增大。从图2A结果可知,正丁醇萃取物浓度(X)与清除率(Y)的回归方程为:Y=295.12X+5.854 (R2=0.978 2),当正丁醇萃取物浓度为0.25 mg/mL时,对DPPH自由基清除率为75.17 ± 0.25%;从图2B结果可知,乙酸乙酯萃取物浓度(X)与清除率(Y)的回归方程为:Y=1 877.70X+10.170 (R2=0.951 5),当乙酸乙酯萃取物浓度为0.042 mg/mL时,对DPPH自由基清除率为80.88 ± 0.04%;从图2C结果知,石油醚萃取物浓度(X)与清除率(Y)的回归方程为:Y=1 212.60X+1.307 (R2=0.995 6),当石油醚萃取物浓度为0.072 mg/mL时,对DPPH自由基清除率为85.83 ± 0.07%。Vc浓度(X)与清除率(Y)的回归方程为:Y=18 782.00X-0.553 (R2=0.992 1)。红豆树种子正丁醇、乙酸乙酯和石油醚萃取物及Vc对DPPH自由基清除作用的ED50值分别为0.149 6、0.021 2、0.040 2、0.002 7 mg/mL。
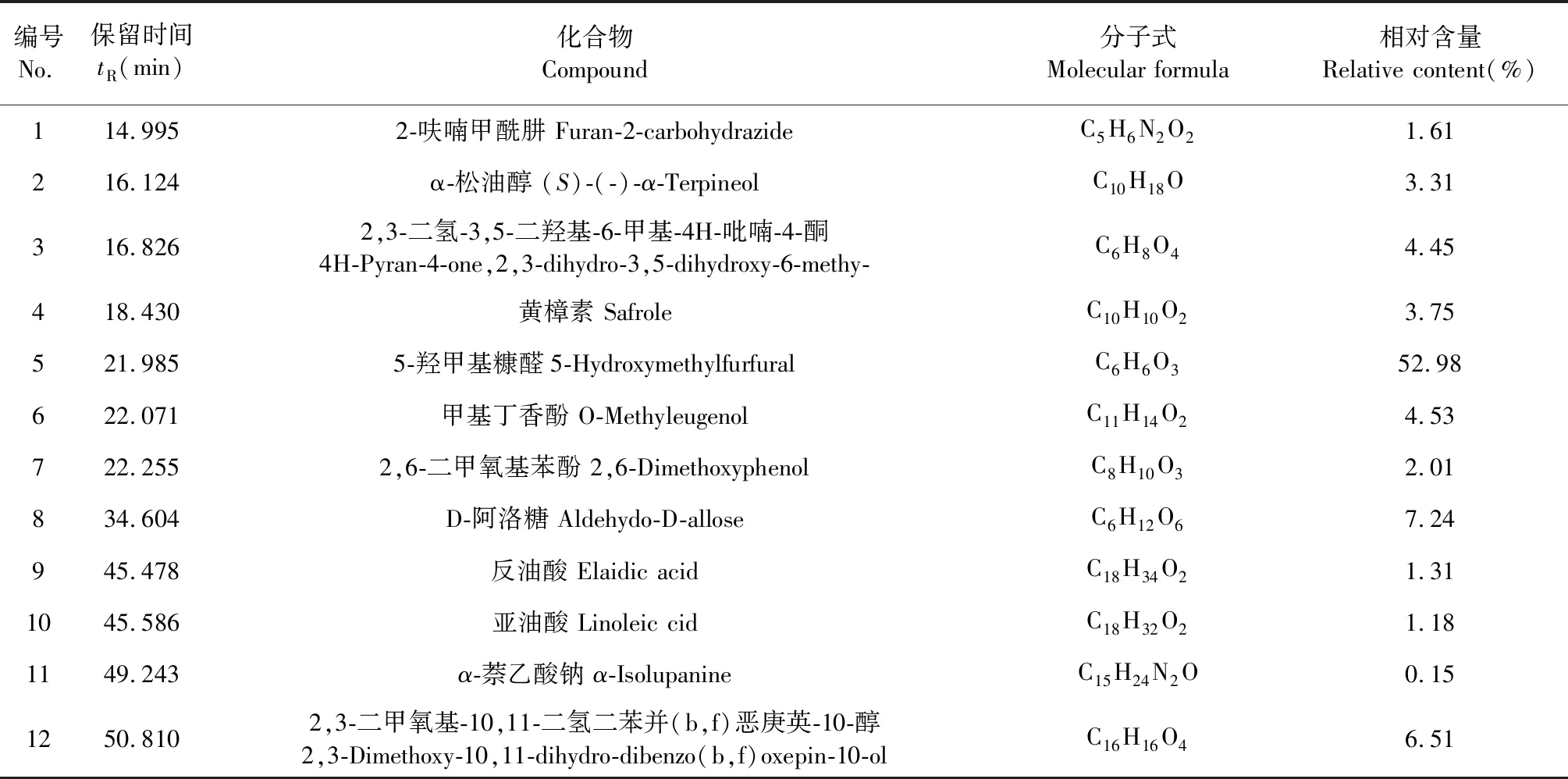
表1 红豆树种子的化学成分分析Table 1 The chemical constituents of the seed of O.hosiei Hemsl.Et Wils

图2 红豆树种子不同溶剂萃取物对DPPH自由基的清除作用Fig.2 Free radical scavenging assays of different solvent extraction of the seed of O.hosiei Hemsl.Et Wils.against DPPH
2.2.2 红豆树种子萃取物对ABTS自由基的清除作用
测定红豆树种子正丁醇、乙酸乙酯和石油醚等萃取物对ABTS自由基的清除率,结果如图3。该实验结果可知,红豆树种子正丁醇、乙酸乙酯和石油醚等萃取物对ABTS自由基有显著的清除能力,且随着萃取物浓度的增加,其清除ABTS自由基的能力逐渐增强。从图3A结果知,正丁醇萃取物浓度(X)与清除率(Y)的回归方程为:Y=1 666.90X+4.701 (R2=0.987 2),当正丁醇萃取物浓度为0.05 mg/mL时,对ABTS自由基清除率为84.80 ± 0.05%;从图3B结果知,乙酸乙酯萃取物浓度(X)与清除率(Y)的回归方程为:Y=323.39X+10.280 (R2=0.963 9),当乙酸乙酯萃取物浓度为0.30 mg/mL时,对ABTS自由基清除率为98.40 ± 0.30%;从图3C结果知,石油醚萃取物浓度(X)与清除率(Y)的回归方程为:Y=1 605.10X+13.602 (R2=0.919 1),当石油醚萃取物浓度为0.05 mg/mL时,对ABTS自由基清除率为90.88 ± 0.05%。Vc浓度(X)与清除率(Y)的回归方程为:Y=21 963.00X-0.288 (R2=0.998 2)。红豆树种子正丁醇、乙酸乙酯和石油醚萃取物及Vc对ABTS自由基清除作用的ED50值分别为0.027 2、0.122 8、0.023 0、0.002 3 mg/mL。
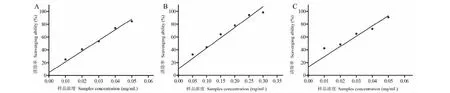
图3 红豆树种子不同溶剂萃取物对ABTS自由基的清除作用Fig.3 Free radical scavenging assays of different solvent extraction of the seed of O.hosiei Hemsl.Et Wils.against ABTS
2.3 红豆树种子萃取物的抑菌作用
检测红豆树种子正丁醇、乙酸乙酯和石油醚等萃取物对金黄色葡萄球菌、苏云金芽孢杆菌和绿脓杆菌等菌株的抑菌活性,结果见表2。从表2结果可知,红豆树种子正丁醇、乙酸乙酯和石油醚等萃取物对受试的三种革兰氏阳性菌金黄色葡萄球菌、枯草芽孢杆菌、苏云金芽孢杆菌和三种革兰氏阴性菌大肠杆菌、绿脓杆菌、鼠伤寒沙门氏菌均具有抑制效果;其中正丁醇萃取物对大肠杆菌、绿脓杆菌和鼠伤寒沙门氏菌的抑菌效果最佳,抑菌圈直径分别为11.17 ± 1.09、9.42 ± 0.85、9.10 ± 0.98 mm;乙酸乙酯萃取物对枯草芽孢杆菌的抑菌效果最佳,抑菌圈直径为15.18 ± 0.74 mm;石油醚萃取物对金黄色葡萄球菌和苏云金芽孢杆菌的抑菌效果最佳,抑菌圈直径分别为10.07 ± 0.51、9.30 ± 0.15 mm。正丁醇萃取物在相同浓度下对受试菌的抑制强度为:大肠杆菌>绿脓杆菌>鼠伤寒沙门氏菌>枯草芽孢杆菌>苏云金芽孢杆菌>金黄色葡萄球菌。乙酸乙酯萃取物在相同浓度下对受试菌的抑制强度为:枯草芽孢杆菌>绿脓杆菌>大肠杆菌>鼠伤寒沙门氏菌>苏云金芽孢杆菌>金黄色葡萄球菌。石油醚萃取物在相同浓度下对受试菌的抑制强度为:金黄色葡萄球菌>苏云金芽孢杆菌>枯草芽孢杆菌>大肠杆菌>绿脓杆菌>鼠伤寒沙门氏菌。由此结果可知,红豆树种子正丁醇萃取物对上述革兰氏阴性菌的抑制效果强于革兰氏阳性菌;而石油醚萃取物恰巧与此相反,其对上述革兰氏阳性菌的抑制效果强于革兰氏阴性菌。
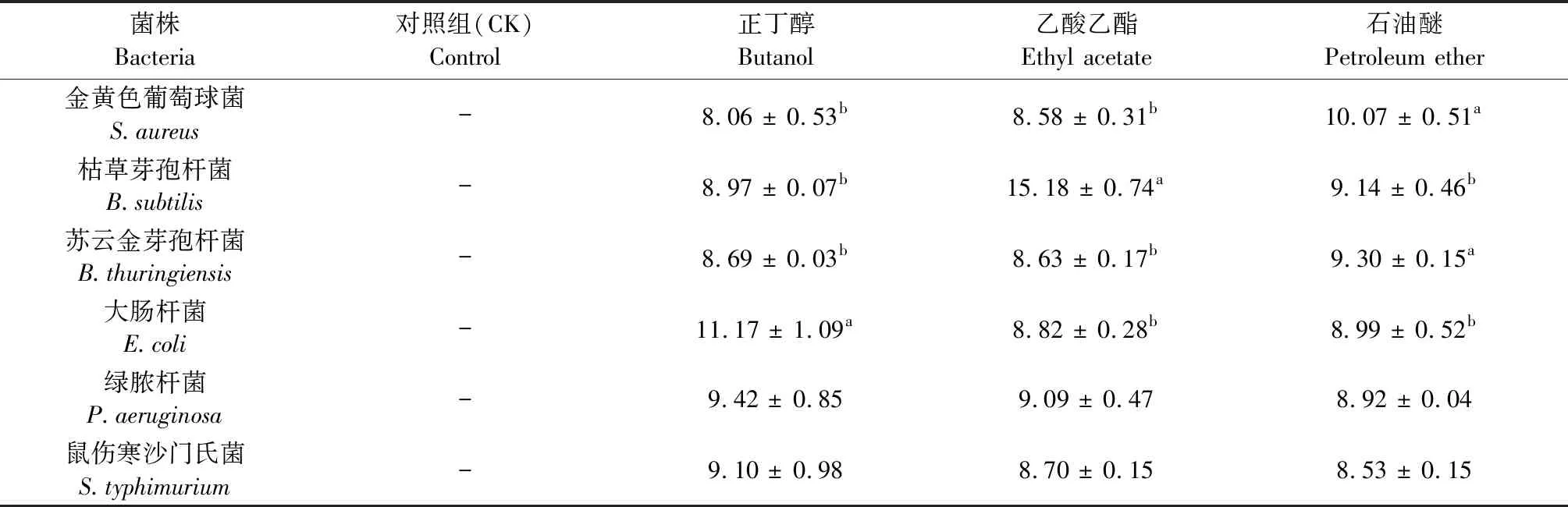
表2 红豆树种子不同溶剂萃取物对不同受试菌的抑菌活性(mm)Table 2 Antibacterial activity of different solvent extraction of the seed of O.hosiei Hemsl.et Wils.against the tested bacteria (mm)
注:同行不同字母表示统计学上具有显著差异(P< 0.05)。
Note:Different letters in the same row indicate statistically significant differences (P< 0.05).
3 结论
本文首次报道红豆树种子的化学成分,并利用GC-MS从萃取物中共鉴定出12个化合物,占萃取物总量的89.03%;其中含量最多的为5-羟甲基糠醛(52.98%),其次为醇类(2种,9.82%)、糖类(1种,7.24%)、酚类(2种,6.53%)、酮类(1种,4.45%)和脂肪酸(2种,2.48%);红豆树种子中化合物的组成及含量与本课题组前期研究的红豆树叶子成分[10]明显不同,与邱亚铁等报道的红豆树茎枝中化学成分也存在显著差异[11],各种化合物在红豆树内的分布值得进一步研究。从鉴定的化合物结果可知,红豆树种子中5-羟甲基糠醛含量最为丰富,高达52.98%;5-羟甲基糠醛不仅是一种重要的化工原料[12],而且广泛存在于中药炮制品中[13],具有抗心肌缺血和抗氧化等功效[14]。D-阿洛糖的含量次之,为7.24%;D-阿洛糖属于一种稀有糖,是一种重要的免疫抑制剂可用于器官移植[15],具有抑制缺血再灌注损伤[16]和抑制肿瘤细胞增殖[15]等功效,以上结果暗示红豆树种子具有潜在药用开发价值。Yu Xiangyingetal.[17]报道2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮具有很强的抗氧化活性,而红豆树种子中也含有这类物质且相对含量排名第五为4.45%。
红豆树种子萃取物DPPH和ABTS自由基清除实验结果证明,其正丁醇、乙酸乙酯和石油醚等萃取物对DPPH和ABTS自由基均具有非常强的清除能力,且抗氧化活性与萃取物浓度间呈线性相关;正丁醇、乙酸乙酯和石油醚萃取物对DPPH自由基清除率的半数有效量(ED50)依次为0.149 6 、0.021 2、0.040 2 mg/mL;对ABTS自由基清除率的半数有效量(ED50)依次为0.027 2 、0.122 8、0.023 0 mg/mL。红豆树种子萃取物具有较好的抗氧化活性,可能与其含有丰富的抗氧化物质如5-羟甲基糠醛、2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮等相关。此外,抑菌实验结果也表明红豆树种子萃取物对多种细菌均具有较好的抑制效果;其中正丁醇萃取物对大肠杆菌、绿脓杆菌和鼠伤寒沙门氏菌的抑菌效果最佳,乙酸乙酯萃取物对枯草芽孢杆菌的抑菌效果最佳,石油醚萃取物对金黄色葡萄球菌和苏云金芽孢杆菌的抑菌效果最佳。本研究结果为红豆树种子资源的开发和综合利用提供了数据支持。

