光动力对瘢痕疙瘩的抑制效果研究
游传华,王一贺,陆雪飞
(1.海南医学院第一附属医院 整形美容外科,海南 海口,570102;2.海南医学院第一附属医院 麻醉科,海南 海口,570102)
瘢痕疙瘩是临床上常见的皮肤组织的良性纤维增生性疾病,是一种以成纤维细胞的增殖和细胞外基质大量堆积为主要特征的疾病[1]。目前,临床治疗方法多种多样,例如手术切除,药物注射,激光,放疗,物理治疗等等,但复发率较高,总体疗效不满意[2],仍需要寻求一种疗效确切、不良反应率和复发率低的治疗方法。我们采用氨基酮戊酸光动力疗法(ALA—PDT)对瘢痕疙瘩模型进行试验研究,取得一定效果,报道如下:
1 实验对象与材料
1.1 实验动物
成年健康裸鼠15只。
1.2 试剂与仪器
光敏剂:外用盐酸氨酮戊酸(5-ALA,商品名艾拉,上海复旦张江生物医药股份有限公司,国药准字H20070027)
激光设备:光动力治疗仪(武汉亚格光电技术有限公司,型号LED-EB)
2 试验方法
2.1 动物瘢痕模型建立
瘢痕疙瘩来源:患者外伤后1~2 年内形成的瘢痕疙瘩,未使用任何干预治疗,经手术切除,病理检查证实,患者知情同意。
瘢痕模型建立:消毒环境下,去除瘢痕疙瘩表皮及基底部分正常组织,依次以1.0cm内径环钻和手术刀切割,形成直径1.0cm,高度0.5cm的圆柱形瘢痕疙瘩颗粒。在裸鼠背部两侧间隔中线1.5cm处分别作两条纵行约1.5cm切口,深度达鼠背肌筋膜表面,创周稍作分离,将瘢痕疙瘩颗粒埋置于皮下,缝合2-3针。每只裸鼠背侧埋置4个瘢痕疙瘩,此后可形成15周~20周稳定的病理性瘢痕[3]。
2.2 实验动物分组
将15只裸鼠由1~15依次编号,随机分为实验组1、实验组2和对照组三组,共计60处瘢痕疙瘩,每组5只20处瘢痕疙瘩。
2.3 试验方法
分别于第4、8、12周进行实验,实验组1裸鼠瘢痕疙瘩以棉片湿敷浓度10%氨基酮戊酸溶液30分钟,实验组2湿敷浓度20%氨基酮戊酸溶液30分钟,对照组湿敷生理盐水棉片,随后均采用输出波长635nm的连续波激光照射20 min,照射功率密度100J/cm2,光斑直径1cm。
2.4 标本采集
于第6、10、14周选择三组15只裸鼠,每只切取1处背部相同部位的瘢痕疙瘩及周围部分正常皮肤,切取深度为表皮至肌筋膜表面,切取后裸鼠背创面缝合消毒处理。
2.5 指标检测
2.5.1 外观及镜下观
2.5.2 瘢痕指数 切取的瘢痕疙瘩剔除周围脂肪和肌肉组织,自表皮至基底由正中纵行切开成两部分,一部分4%中性甲醛溶液固定,石蜡包埋,5μm厚度切片,HE染色后置于低倍光镜下检测,测量瘢痕组织凸起最高点至肌筋膜表面厚度(H1),周围正常组织表皮面至肌筋膜厚度(H2),计算瘢痕指数HI(HI=H1/H2)。
2.5.3 成纤维细胞数量(NA) Masson染色切片低倍光镜下检测,每张切片随机选取5个视野,利用图像分析系统,统计蓝染的胶原纤维数量,结果取均数。
2.5.5 Western blot检测 定量瘢痕标本粉碎研磨,取各组匀浆胰酶消化洗涤离心,细胞沉淀加入裂解液提取蛋白。经配胶、泡膜、转膜、封闭、显影后拍照留存,以图像分析软件Image j采集数据并通过Graph pad 6.0分析数据。
2.6 统计学方法
实验结果以均数±标准差表示,采用spss17.0统计软件分析,组间采用t检验和重复测量的方差分析。P<0.05表示有显著差异。
3 结 果
3.1 外观及镜下观
第6周三组模型外观差异不明显,第9周~10周后,实验组2瘢痕萎缩情况明显优于观察组,也优于实验组1,硬度及充血状况均有所改善。电镜下可见实验组细胞核膜萎缩,浆内存在大量空泡,线粒体数量减少,体积增大;对照组细胞核膜平整光滑,线粒体丰富。
3.2 瘢痕指数和成纤维细胞数量
各组数据显示,经ALAL-PDT治疗1次治疗后,瘢痕指数(表1)和成纤维细胞数量(表2)虽有所下降,但不显著(P>0.05);自2、3次治疗,对照组2瘢痕组织瘢痕指数、成纤维细胞数量显著低于对照组,实验组1、2间也有差异,各组间差异有统计学意义(P<0.05)。

表1 瘢痕指数(n=15)
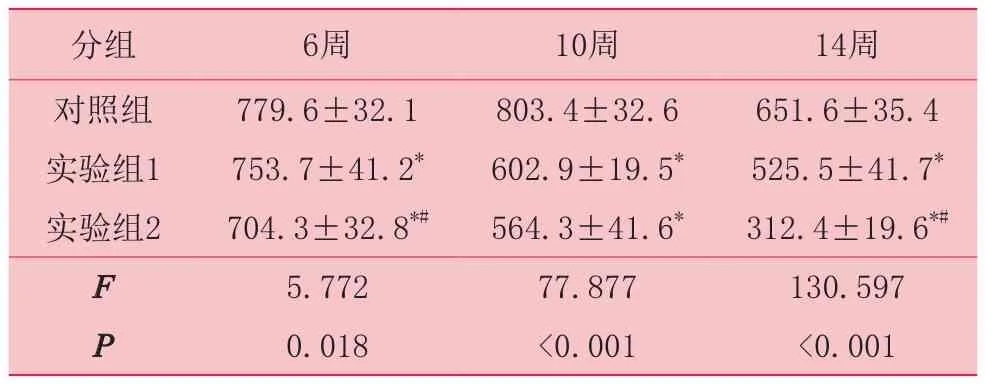
表2 瘢痕组织成纤维细胞数量(n=15)
3.3 TG-β1 lOD值
三组中TGF-β1表达均为阳性,对照组阳性染色颗粒的数目、染色强度、密集程度均明显高于实验组(表3),组间比较差异有统计学意义(P<0.01),表明实验组治疗后瘢痕疙瘩TGF-β1显著降低。

表3 瘢痕组织TGF-β1 IOD值(n=15)
3.4 Western blot检测
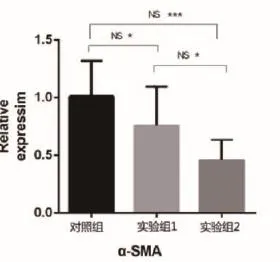
通过检测α-SMA在三组细胞中均有表达,其中对照组表达较高,实验组2表达量最低,各组件对比均有差异,实验组2与对照组显著差异。
4 讨 论
瘢痕疙瘩主要表现为成纤维细胞紊乱和胶原纤维过度增生[5],呈现失代偿、无调控性生长,普通手术切除往往造成新损伤,修复机制启动,一定条件下成纤维细胞新一轮增殖并重新生成瘢痕疙瘩。如何控制成纤维细胞生物合成和增殖、诱导成纤维细胞凋亡,是瘢痕疙瘩生长形成抑制的关键。
增生性瘢痕和瘢痕疙瘩植入裸鼠体内能在约20周内保持其原有的组织学结构特征[6],建立裸鼠瘢痕疙瘩模型是可行的,通过PDT治疗后瘢痕相关指标分析,可以推断出PDT对瘢痕疙瘩的可能作用机制。
瘢痕组织细胞代谢较其他组织旺盛,对光敏剂的吸收也高于其他组织,这种特异性作用使得瘢痕可作为光敏剂靶细胞。ALA外敷30分钟后部分透皮吸收,在靶细胞内转换成原卟啉IX(PpIX),经635nm波长激光照射后激发,PpIX发生Ⅰ、Ⅱ型光动力反应,从单重态系间激发到三重态,继而形成羟自由基和单态氧(1O2),这两种产物造成自由基链式反应和氧化损伤[7],瘢痕疙瘩中成纤维细胞占据吸收光敏剂的主导地位,损伤直接诱导成纤维细胞凋亡,造成瘢痕疙瘩的萎缩,达到治疗的目的。
本研究中,治疗后2周瘢痕厚度即开始降低,微血管数量及成纤维细胞数量均减少,镜下胶原纤维排列较规则有序,表明在治疗早期瘢痕增生已得到抑制,这可能就是由氧化损伤的毒性反应所引起的。而在治疗后期治疗组瘢痕退缩程度仍远快于对照组,则表明可能并非单一由氧化反应诱发细胞凋亡引起作用。皮肤真皮组织病理分类为上皮组织,瘢痕疙瘩为间叶组织,瘢痕增生过程中涉及上皮组织到间叶组织的转化过程,有研究表明TGF-β1可促进瘢痕疙瘩表皮细胞发生上皮-间质转化(EMT)[8],而α-SMA是上皮间质转化过程中成纤维细胞的特异性表达蛋白,也是使TGF-β1/Smad信号通路发生作用的重要分子蛋白[9]。本实验中,实验组TGF-β1及α-SMA显著低于对照组,通过调控上游信号,减少上皮组织分泌细胞因子及趋化因子,诱导降低间叶组织特异性蛋白α-SMA、波形蛋白等表达,从而抑制EMT的过程,阻止瘢痕化进程。据此分析,ALA-PDT能够破坏成纤维细胞合成进程,抑制成纤维细胞形成、增殖及胶原等胞外基质产生,最终抑制瘢痕增殖。
综上,本实验研究表明ALA-PDT作用下瘢痕疙瘩中成纤维细胞数量降低,瘢痕增生明显抑制,20%ALA浓度下作用更为明显。其作用机制可能与①激光能量作用造成部分胶原分解;②光敏剂分解形成单线态氧的细胞毒作用,诱发成纤维细胞凋亡;③降低TGF-β1与α-SMA含量,调控减少瘢痕疙瘩表皮细胞发生上皮-间质转化,减轻成纤维细胞合成和胞外基质沉积有关,但还需要开展进一步实验研究。

