北疆地区副猪嗜血杆菌的分离鉴定及药敏试验
章 莲,武 磊,高建鹏,汪骁轩,赵 鑫,齐亚银,张 莉*
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.新疆克拉玛瑞恒畜牧开发有限责任公司,新疆 克拉玛依 834000)
副猪嗜血杆菌病(Hps):称革拉泽氏病,可引起猪的多发性浆膜炎、脑膜炎和关节炎等症状[1]。其致病菌为革兰氏阴性小杆菌,巴氏杆菌科嗜血杆菌属的成员。此病原菌主要危害1~4月龄的仔猪和保育猪,该病的病死率为达15%,严重感染时高达50%[2]。副猪嗜血杆菌为健康猪群的常在菌,以前多为散发[3]。随着现代规模化养殖场的不断扩大,饲养密度也随之变大,猪群的环境卫生受到了限制,副猪嗜血杆菌病的病死率有呈上升的趋势。尤其在猪群发生支原体、伪狂犬、高致病性蓝耳病、圆环病毒病等疫病时,更易引起此病的发生,给猪场造成严重的经济损失。
随着HPS病的流行,在世界各地均有报道过该病的发生[4]。目前,副猪嗜血杆菌的致病机理尚不清楚。据研究表明,强毒株可破坏鼻粘膜,进入血液,到达中枢神经系统。从而通过血脑屏障,最终造成脑膜炎的发生[5-7]。该菌主要存在于猪的上呼吸道,通过直接接触、空气和污染物传播。此外,带菌猪和慢性感染猪使得病原菌长期存在,给猪群健康带来威胁。
2018年秋季以来,北疆三个规模化猪场病猪陆续出现呼吸困难、发热、关节肿大、跛行等疑似副猪嗜血杆菌的典型症状。剖检可见,病死猪的气管内有大量泡沫样分泌物,肺脏出现典型的纤维素样病变。心脏出血,外附有一层黄白色纤维素样渗出物,心包和胸腹腔有大量积液。据了解,A场发病猪病死率为21%,B场发病猪病死率为14%,C场发病猪病死率为10%。为科学防控该病,本试验采集有HPS典型症状的病死猪肺脏、淋巴结和胸腹腔渗出液等病料,选择TSA培养基进行致病菌的分离,采用生理生化特性及基于PCR的分子特性对病原菌进行鉴定,同时对其药物敏感性进行检测。
1 材料与方法
1.1 材料
1.1.1 病料来源 病死猪肺脏、胸腹腔积液、淋巴结、关节液和心包液进行分离。金黄色葡萄球菌来自本实验室分离保存。
1.1.2 主要仪器 冰箱、PCR仪、震荡培养箱、电泳仪、恒温培养箱、Bio凝胶成像仪、CO2培养箱、超净工作台。
1.1.3 主要试剂 TSB(胰蛋白大豆肉汤)、TSA(胰蛋白大豆琼脂)培养基等均购自青岛海博有限公司;生化鉴定管、NAD(v因子,烟酰胺腺嘌呤二核苷酸)和细菌DNA提取试剂盒购自北京索莱宝公司;小牛血清购自杭州四季青生物公司。
1.1.4 药物 选用四环素、青霉素、头孢噻肟、氨苄西林、洛美沙星、环丙沙星、恩诺沙星、林可霉素、利福平、阿莫西林等共14种。
1.1.5 生化鉴定管 氧化酶、阿拉伯糖、山梨醇、脲酶、半乳糖、葡萄糖、蔗糖、木糖、吲哚、麦芽糖、硝酸盐还原酶、硫化氢等14种生化培养基。
1.1.6 实验动物 5周龄健康昆明系小鼠来源于石河子大学实验动物中心。
1.2 方法
1.2.1 病原菌的分离 无菌采集病料,用接种环将其无菌接种于TSA平板上(NAD和小牛血清),于5% CO2条件下,73 ℃培养24~36 h,镜检观察菌体形态。同时将可疑菌落接种鲜血琼脂平板。
1.2.2 染色镜检 挑取单个菌落涂片,革兰氏染色镜检,观察菌落形态。
1.2.3 生化鉴定 挑取鲜血琼脂平板上的单菌落,无菌接种于生化鉴定培养基(添加NAD)中,37℃培养16~48 h后,观察培养基的颜色变化。
1.2.4 P C R检测 参照文献[8]中的特异性引物进行P C R扩增,H P S-F: 5′—GGCTTCGTCACCCTGTG— 3′;HPS-R: 5′—GTCAGAGGAAGGGTGGT— 3′;预期扩增目的片段大小为821bp。
反应体系(25ul):上游引物 1uL,下游引物 1μL,Mix 12.5ul,ddH2O 8.5ul,模板 2ul。其反应条件为:94℃ 4 min;94 ℃ 50 s;59℃ 50 s;72℃ 50s;32个循环后;72℃ 10 min,4℃结束反应。制备1%的琼脂糖凝胶,进行电泳,成像后观察结果。
1.2.5 药敏试验 无菌吸取分离菌株的TSB纯培养物0.2 ml于TSA平板上,用高压灭菌的涂布棒将菌液涂布均匀。将药敏纸片贴于TSA平板上,37℃培养24 h后,观察抑菌圈大小。参照美国CLSI推荐的判定方法,通过测定抑菌圈直径,进行分离株对药物的敏感性分析。
1.2.6 致病性试验 将30只小鼠将其分为6组(组/5只),设一组为对照组,其余为实验组。对菌液进行细菌计数,每组实验组注射相同剂量的同一毒株菌液,分别对5组实验组小组进行腹腔注射0.2 ml/只(浓度为1×107cfu /ml)。观察小鼠的感染情况,对病死小鼠进行剖检,采集心血进行致病菌分离鉴定。
2 结果
2.1 细菌分离
将病料接种于TSA平板,培养36 h后,可见无色透明、直径为1 mm左右、圆形的单个菌落,见图1所示。结果从病料中共分离出5株疑似副猪嗜血杆菌分离株,分别编号为XJS1-2(A 场 )、XJS3-6、XJS3-9(B场 )、XJS7-7、XJS7-W(C场)。同时将这5株分离菌株无菌接种于TSB培养基(含0.2g/L的NAD和50mL/L的犊牛血清)中,放于震荡培养箱中37℃摇菌培养16 h后,放于4℃冰箱保存备用。

图1 细菌分离结果
2.2 染色镜检
革兰氏染色镜检,结果见图2所示。可见分离菌为革兰氏阴性菌,形态各不相同,视野内可见有长杆状、球状、短杆状的菌体,但大多数为小杆菌,少数为长杆状和球状的菌体。
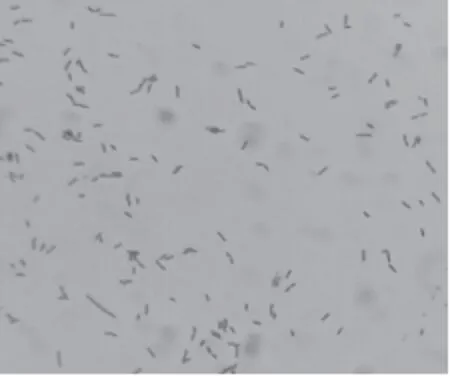
图2 分离菌株镜检结果(倍数100×10)
2.3 生化试验
对不同地区HPS分离株进行生理生化鉴定。结果显示大部分分离株可发酵葡萄糖、麦芽糖、蔗糖、半乳糖,不发酵D-核糖、木糖、吲哚和阿拉伯糖。硫化氢试验、脲酶、山梨醇、硝酸盐还原试验阴性,触酶阳性。分离株的生化试验结果表明这5株分离株生化试验结果符合副猪嗜血杆菌的生化特性。

表1 分离菌的生化试验结果
2.4 药敏实验
根据抑菌圈大小,对每一株分离株进行药物的敏感性试验分析,实验结果见表2所示。XJS3-6和XJS3-9对恩诺沙星最为敏感;XJS1-2对头孢噻肟最为敏感;XJS7-W对磺胺异恶唑最为敏感;XJS7-7对四环素最为敏感。
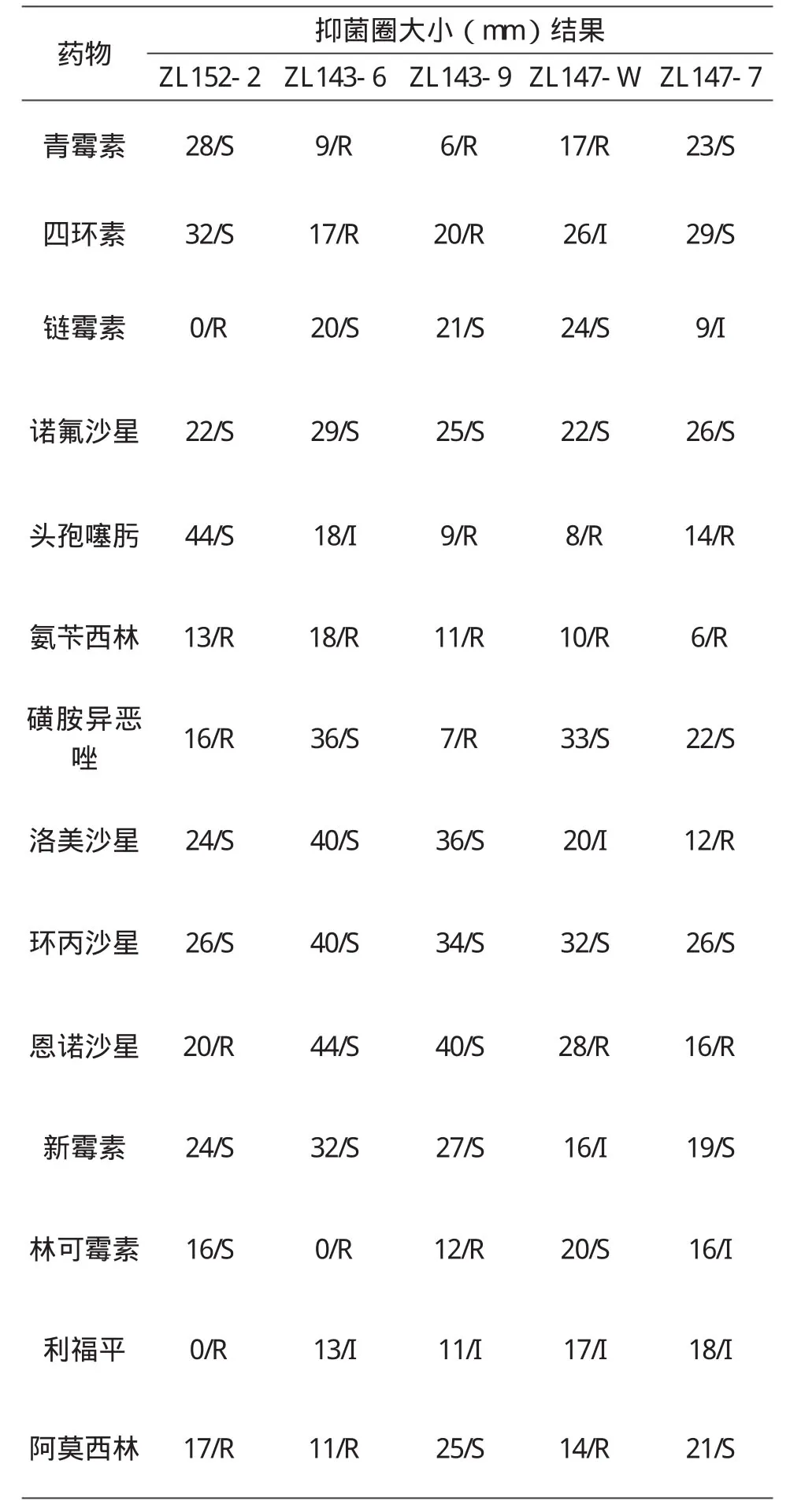
表2 部分分离菌的药敏试验结果
2.5 PCR检测结果
用细菌DNA提取试剂盒对分离菌的DNA进行提取,作为PCR扩增的模板,4℃保存备用。经PCR扩增,凝胶电泳成像后可见5株分离菌株均扩增出大小约为821 bp的片段,与目的片段相一致。
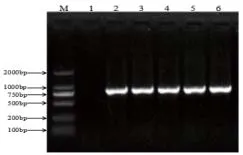
图3 PCR反应结果
M.DNA 标准DL 2000;1.阴性对照;2.XJS1-2;3. XJS3-6;4. XJS3-9;5. XJS7-W;6.XJS7-7
2.6 致病性试验
对照组小鼠均正常,实验组小鼠均出现行动缓慢,48h内,试验组XJS1-2中,有3只小鼠死亡,XJS3-6X、JS3-9组有4只小鼠死亡,实验组XJS7-W和 XJS7-7小鼠均死亡,取病死小鼠心血无菌接种于TSA中,结果分离并鉴定出副猪嗜血杆菌。
3 讨论
副猪嗜血杆菌(HPS)具有明显的宿主专一性。于1910年,Glasse首次报道该菌。1922年才首次成功分离到HPS,在临床病例中的分离率很低,仅30%左右,尤其是在死亡12h以后的病死猪组织中,很难分离成功[9]。HPS对培养的营养要求苛刻,需要v因子(NAD)和血清,在含NAD和血清的TSA平板上生长较好。研究表明,从病料中,分离该菌最好在12h之内,否则很难再分离出HPS[10]。由于在临床病料分离时,易被杂菌污染,在一定程度上阻碍了研究人员对副猪嗜血杆菌的研究。生产中,大量使用抗生素降低了该菌的分离率。
PCR技术用于临床检测,可以快速而准确地从病料中检出病原体,早在2001年,Oliveira S等[11]根据16S rDNA设计引物,并建立了HPS的PCR诊断方法,但HPS与吲哚放线杆菌16S rDNA的同源性很高[12]。本试验通过16S rDNA设计了一对特异性引物,可快速、准确的检出病原菌,避免了高同源性的缺点。
副猪嗜血杆菌具有明显的地方流行性,不同地方流行株的血清型有所不同。副猪嗜血杆菌的血清型众多,至少可将其血清型分为15个血清型,另外还有20%以上的菌株无法定型,我国流行的血清型以 1、4、5和13型为主[13]。血清型和毒力之间存在差异,不同的血清型之间很难产生交叉免疫保护[14-16]。故建议使用当地流行的分离株进行药物敏感性分析和疫苗的制备,对规模化猪场的生产用药和预防才具有实际意义。从本试验的药物敏感试验结果可看出,大部分分离菌株对喹诺酮类药物较敏感。此外,有研究者表明,金银花及其复方对副猪嗜血杆菌抑制作用明显[17]。不同地区分离菌株对药物的敏感程度有所差异,这于流行株的血清型以及猪场临床用药息息相关,使部分菌株对头孢类药物产生了耐药性。

