广西玉米穗腐病致病镰孢种群构成与毒素化学型分析
杜青,唐照磊,李石初,上官玲玲,李华娇,段灿星
广西玉米穗腐病致病镰孢种群构成与毒素化学型分析
杜青1,唐照磊1,李石初1,上官玲玲2,李华娇2,段灿星3
(1广西壮族自治区农业科学院玉米研究所,南宁 530007;2广西农业职业技术学院,南宁 530007;3中国农业科学院作物科学研究所/ 国家农作物基因资源与基因改良重大科学工程,北京 100081)
【】明确广西玉米穗腐病致病镰孢的种群构成及毒素化学型,为玉米穗腐病的综合防治、品种的合理布局和抗病育种提供重要指导和理论依据。从广西玉米主产区采集玉米穗腐病样本,经组织分离和单孢纯化共获得138个镰孢菌分离物,分别来自21个县(区)。利用形态学和分子生物学相结合的方法进行镰孢菌种的鉴定,构建系统发育树,利用产毒基因特异性引物进行毒素化学型检测。在138个镰孢菌分离物中,鉴定出10种镰孢菌,包括拟轮枝镰孢()、层出镰孢()、九州镰孢()、南方镰孢()、甘蔗镰孢()、藤仓镰孢()、亚洲镰孢()、轮纹镰孢()、变红镰孢()和禾谷镰孢(),分离频率依次为50.72%、12.32%、10.87%、8.70%、6.52%、3.62%、3.62%、1.45%、1.45%和0.72%。禾谷镰孢复合种(species complex,FGSC)由南方镰孢、亚洲镰孢和禾谷镰孢3个独立种组成。拟轮枝镰孢为优势致病菌,禾谷镰孢复合种、层出镰孢和九州镰孢为次优势致病菌,而甘蔗镰孢和轮纹镰孢则是国内首次报道为玉米穗腐病致病菌。拟轮枝镰孢、层出镰孢、甘蔗镰孢和藤仓镰孢检测到伏马毒素关键合成基因的菌株数分别为67、13、5、3,具有潜在的产伏马毒素能力,轮纹镰孢则未检测到。供试禾谷镰孢复合种、九州镰孢和变红镰孢菌株的毒素化学型有4种:NIV、15-ADON、NIV+15-ADON和DON+15-ADON。8个九州镰孢菌株、2个亚洲镰孢菌株、2个南方镰孢菌株和1个变红镰孢菌株携带NIV毒素化学型;2个南方镰孢菌株携带15-ADON毒素化学型;8个南方镰孢菌株、2个九州镰孢菌株、1个亚洲镰孢菌株和1个变红镰孢菌株携带NIV+15-ADON毒素化学型;只有1个禾谷镰孢菌株携带DON+15-ADON毒素化学型。未检测到3-ADON毒素化学型菌株。拟轮枝镰孢为广西玉米穗腐病优势致病菌,禾谷镰孢复合种、层出镰孢和九州镰孢为次优势致病菌。拟轮枝镰孢、层出镰孢、甘蔗镰孢、藤仓镰孢均检测到,广西禾谷镰孢复合种的主要毒素化学型为NIV和15-ADON,变红镰孢和部分九州镰孢的主要毒素化学型为NIV。广西玉米穗腐病镰孢菌种群构成与我国温带玉米相关研究结果存在差异,原因可能为镰孢菌种群适应广西热带和亚热带高温、高湿的玉米生长环境并因此导致毒素化学型的不同。
玉米;穗腐病;镰孢菌;分离频率;毒素化学型
0 引言
【研究意义】玉米穗腐病(maize ear rot)是玉米生产中的重要病害之一,在世界范围发生十分普遍,也是广西最常见的玉米真菌病害之一。镰孢菌(spp.)是玉米最普遍的致病真菌之一,引起的病害包括玉米苗枯病、茎腐病和穗腐病。玉米果穗感染镰孢菌后通常会导致产量损失和品质下降,更重要的是收获感染了镰孢菌的果穗,可能会导致真菌毒素的污染,危害人畜健康[1-5]。明确广西玉米穗腐病致病镰孢的种群构成及毒素化学型,可为玉米穗腐病的病害流行、综合防治、抗病育种等相关研究提供理论依据。【前人研究进展】国内外多数研究认为拟轮枝镰孢()和禾谷镰孢()是玉米穗腐病的优势种,但各地的镰孢菌种群组成和结构存在较大差异。我国春玉米区,禾谷镰孢复合种(species complex,FGSC)总分离频率最高,其次为拟轮枝镰孢、亚粘团镰孢()等[2],而黄淮海夏玉米区以拟轮枝镰孢最高,其次为禾谷镰孢[3]。周丹妮等[4]对重庆及周边地区的玉米穗腐病镰孢菌进行了序列分析鉴定,发现该地区禾谷镰孢复合种由南方镰孢()和亚洲镰孢()组成;Duan等[5]对我国约20个省份的玉米穗腐病镰孢菌进行了鉴定,拟轮枝镰孢和禾谷镰孢复合种为优势种,禾谷镰孢复合种中鉴定出3个独立种,分别为禾谷镰孢、南方镰孢和布氏镰孢()。镰孢菌种群的致病性比较复杂,特别是禾谷镰孢复合种和藤仓镰孢复合种(species complex,FFSC),常规形态学结合分子生物学技术有利于镰孢菌种群的鉴定,在镰孢菌种级水平上的系统发育学分析发现,基因序列可以较好地表现镰孢菌种之间的关系,并已成为镰孢种鉴定的重要工具[2-7]。已鉴定出40多种病原菌单独或复合侵染均可引发玉米穗腐病,其中,在大多数国家和地区,镰孢菌是玉米穗腐病的主要病原菌[8]。镰孢菌可引起两种类型的玉米穗腐病,分别为赤霉穗腐病(ear rot)和镰孢穗腐病(ear rot)[1],镰孢穗腐病由拟轮枝镰孢、层出镰孢()、亚粘团镰孢等引起,会导致伏马毒素(fumonisins)积累;赤霉穗腐病则主要由禾谷镰孢、黄色镰孢()、燕麦镰孢()等引起,会导致脱氧雪腐镰刀烯醇(deoxynivalenoe,DON)、雪腐镰刀烯醇(nivalenol,NIV)和玉米赤霉烯酮(zearalenone,ZEN)等真菌毒素污染[1,9]。伏马毒素是世界范围内最常见的玉米及玉米加工品的污染物,玉米相比其他作物更容易受到伏马毒素污染,在热带和亚热带环境下,拟轮枝镰孢被认为是镰孢穗腐病和伏马毒素污染的主要因素[1,9]。欧盟、美国和中国等地区和国家已制定了伏马毒素、单端孢霉烯族毒素等镰孢菌毒素在玉米等粮食作物及加工品中的限量标准[10]。2011和2012年甘肃省5个地区的225份玉米样品中,伏马毒素的污染率分别为30.5%和50.9%[11]。2012—2014年间,77%的埃塞俄比亚玉米籽粒样品中检测到伏马毒素,伏马毒素平均浓度为348 μg∙kg-1,部分样品超过欧盟限量标准[9]。【本研究切入点】玉米是广西最主要的粮食作物之一。广西热带、亚热带的高温、高湿气候特点导致玉米穗腐病发生非常普遍,然而该病害镰孢菌致病种群构成及毒素污染情况仍不明确。【拟解决的关键问题】于2016—2018年采集广西玉米穗腐病病样,利用形态学和分子生物学相结合的方法进行镰孢种鉴定,利用毒素合成基因特异性引物进行毒素化学型检测,为玉米穗腐病的综合防治、品种的合理布局和抗病育种提供重要指导和理论依据。
1 材料与方法
1.1 材料
病样:2016—2018年从广西玉米主产区的24个区(县)采集疑似感染镰孢菌的玉米病穗167份,将采集样品装在牛皮纸袋中带回实验室尽快进行籽粒带菌检测。
培养基:马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,琼脂粉和葡萄糖各20 g,蒸馏水1 L;马铃薯葡萄糖(potato dextrose,PD)液体培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 L;合成低营养琼脂(spezieller nahrstoffarmer agar,SNA)培养基:KH2PO41.0 g,KNO31.0 g,MgSO4∙7H2O 0.5 g,KCl 0.5 g,蔗糖0.2 g,葡萄糖0.5 g,琼脂20.0 g,蒸馏水1 L;康乃馨叶片(carnation leaf-piece agar,CLA)培养基:琼脂粉20 g,蒸馏水1 L,每个培养皿中灭菌康乃馨叶片4—5片。
常用仪器:BioRad S 1000 PCR扩增仪;Eppendorf 5424 R高速冷冻离心机;北京市六一仪器厂DYY-6C型电泳仪;BioRad GelDoc XR凝胶成像系统;Nikon E-CLIPSE CI-E生物显微镜。常用试剂:4S green plus无毒核酸染料,真菌基因组DNA快速抽提试剂盒,Taq PCR Master Mix(2×,blue dye)均购自生工生物工程(上海)股份有限公司;PCR引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 病原菌分离与鉴定 挑选果穗病健交界处的籽粒,在3%的次氯酸钠溶液中表面消毒1 min,无菌水冲洗两次,然后在PDA平板上培养5—6 d。菌落转移至PDA平板中进行纯化培养及单孢分离[12]。根据镰孢菌在PDA、SNA和CLA培养基上的形态特征和培养性状,参考《TheLaboratory Manual》[13]和《常见镰刀菌鉴定指南》[14]关于镰孢菌分类依据的描述进行形态学鉴定。
1.2.2 病原菌的分子生物学鉴定 将镰孢菌菌株接种到PD液体培养基中,4—7 d后,利用真菌DNA快速提取试剂盒从纱布过滤后的冻干菌丝中提取DNA,将DNA溶解于100 μL TE buffer。种级特异性引物(表1)用于镰孢菌种群的初步鉴定,PCR反应体系及PCR反应程序参照周丹妮等[4]。
所有镰孢菌菌株采用基因序列比对方法进行鉴定[2-7]。EF1(5′-ATGGGTAAGGAGGACAAG AC-3′)和EF2(5′-GGAAGTACCAGTGATCATGTT -3′)引物对用来扩增基因部分序列,30 μL PCR反应体系:2×Taq Mix 15 μL,基因组DNA模板2 μL,10 μmol∙L-1上下游引物均为1 μL,ddH2O 11 μL。PCR反应条件:95℃预变性5 min,94℃变性1 min,53℃退火50 s,72℃延伸1 min,共35个循环,72℃延伸10 min,4℃保存扩增产物。PCR扩增产物送生工生物工程(上海)股份有限公司进行双向测序,Chromas软件查看测序ab1文件序列峰图,DNAman软件正反向序列比对拼接,结合峰图,获得可靠DNA序列,登录GenBank数据库进行BLAST序列比对,利用Mega 7.0软件ClustalW比对后采用neighbor-joining(NJ)统计方法1 000次自检构建系统发育树。
1.2.3 致病性鉴定 拟轮枝镰孢、层出镰孢、藤仓镰孢()、甘蔗镰孢()和轮纹镰孢()采用PD液体培养基培养孢子,制成浓度为2×106个孢子/mL的悬浮液,禾谷镰孢复合种、九州镰孢()和变红镰孢()采用SNA培养孢子,刮取孢子,制成浓度为1×105个孢子/mL的悬浮液。以清水作对照,分别于吐丝后10 d针刺果穗注射法[8]穿透苞叶接种2 mL孢子悬浮液至玉米果穗,乳熟后期剥开苞叶调查病害发生情况,取病健交界处的籽粒,于培养基上分离和纯化,观察再分离菌株与接种菌株的形态特征是否一致。
1.2.4 毒素合成基因的分子检测 利用Fum5F(5′-GTCGAGTTGTTGACCACTGCG-3′)和Fum5R(5′-CG TATCGTCAGCATGATGTAGC-3′)引物对检测拟轮枝镰孢、层出镰孢、甘蔗镰孢、藤仓镰孢和轮纹镰孢的伏马毒素关键合成基因,PCR反应体系和扩增程序参照Duan等[5]的方法进行。
对于禾谷镰孢、亚洲镰孢、南方镰孢、变红镰孢和九州镰孢,采用表2引物检测其毒素化学型。PCR反应体系、PCR程序参照马红霞等[15]的方法,并略有改动。
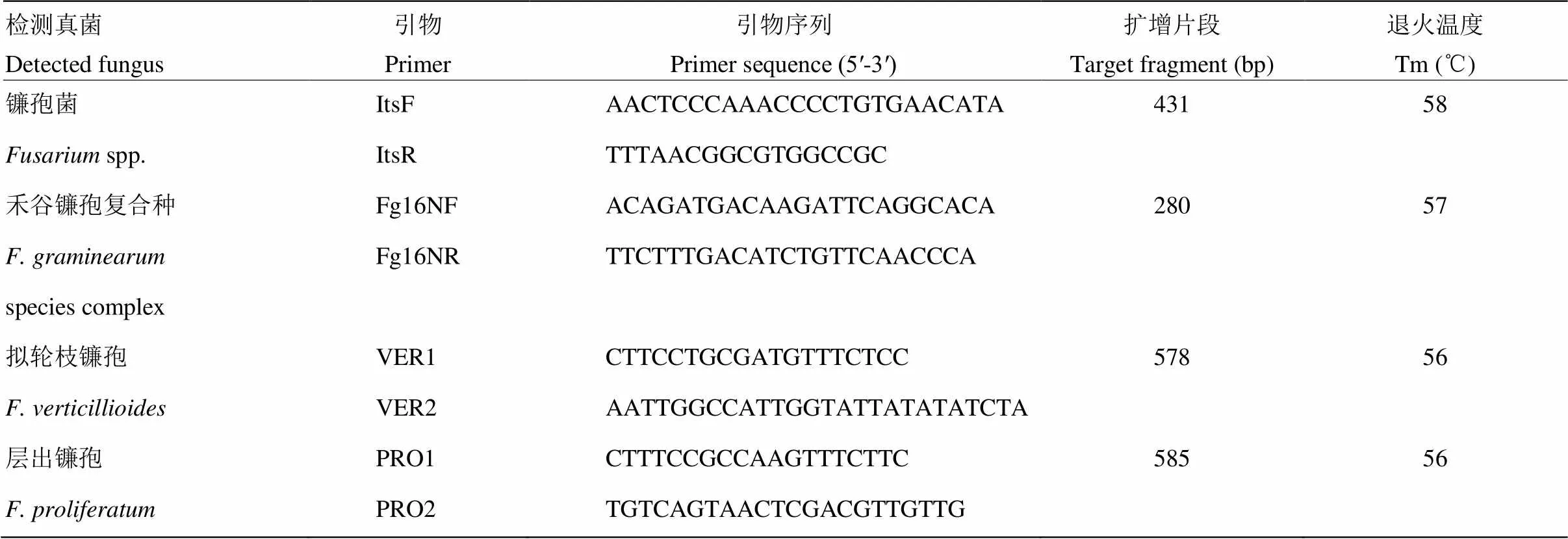
表1 镰孢菌种特异性鉴定引物

表2 毒素化学型检测所用引物
2 结果
2.1 玉米穗腐病样中镰孢菌的鉴定及分离频率
从广西24个县(区)采集的167份疑似镰孢菌引起的玉米穗腐病病样中,分离并鉴定出镰孢菌、青霉()、黄曲霉()、木霉()、丝核菌()等,本研究重点对镰孢菌进行种级鉴定,结果见表3。
经过单孢分离纯化共获得138个镰孢单孢分离物,分别来自广西21个主要玉米种植县(区),形态学结合分子生物学鉴定,共鉴定出10种致病镰孢。共分离到103个藤仓镰孢复合种分离物,包括拟轮枝镰孢(70个)、层出镰孢(17个)、甘蔗镰孢(9个)、藤仓镰孢(5个)和轮纹镰孢(2个),分离频率依次为50.72%、12.32%、6.52%、3.62%和1.45%。18个禾谷镰孢复合种分离物包括南方镰孢(12个)、亚洲镰孢(5个)和禾谷镰孢(1个),分离频率依次为8.70%、3.62%和0.72%。此外,还分离到九州镰孢(15个)和变红镰孢(2个),分离频率分别为10.87%和1.45%。不难发现,拟轮枝镰孢为广西玉米穗腐病优势致病镰孢,其次是层出镰孢和九州镰孢。禾谷镰孢复合种以南方镰孢分离频率最高,亦具有较强的致病力。拟轮枝镰孢、层出镰孢、九州镰孢和南方镰孢分离频率较高,在百色、河池和崇左市均有不同程度的分布。在南宁市的3个县(区)共获得到15个单孢分离物,14个为拟轮枝镰孢,只有来宾市武宣县等少数县(区)未分离到拟轮枝镰孢。
分别接种甘蔗镰孢和轮纹镰孢孢子悬浮液至玉米果穗,结果证明甘蔗镰孢和轮纹镰孢均能侵染玉米果穗(图1-e、1-E),发病症状与拟轮枝镰孢、层出镰孢和藤仓镰孢引起的穗腐病症状相似,通常造成果穗局部受害,极少数整穗腐烂,与禾谷镰孢复合种引起的紫红色病穗区别较大。取病健交界处的籽粒分离培养,小型分生孢子、大型分生孢子、小型分生孢子链产孢和复瓶梗假头状产孢(图1-a—d、A—D)等形态学特征与拟轮枝镰孢(孢子链更长,单瓶梗产孢为主)差异较大。甘蔗镰孢与层出镰孢、藤仓镰孢间差异相对较小。
2.2 TEF-1α系统发育树
形态学和特异性引物扩增初步鉴定后,所有菌株均采用引物延伸因子基因序列构建系统发育树,菌株编号采用“采集县份+序号”表示。将138个镰孢菌菌株进行BLAST序列比对,并下载参考菌株基因序列,138个菌株与参考菌株基因序列构建系统发育树,所有菌株均可划分到彼此独立的10个对应参考菌株的群组中。
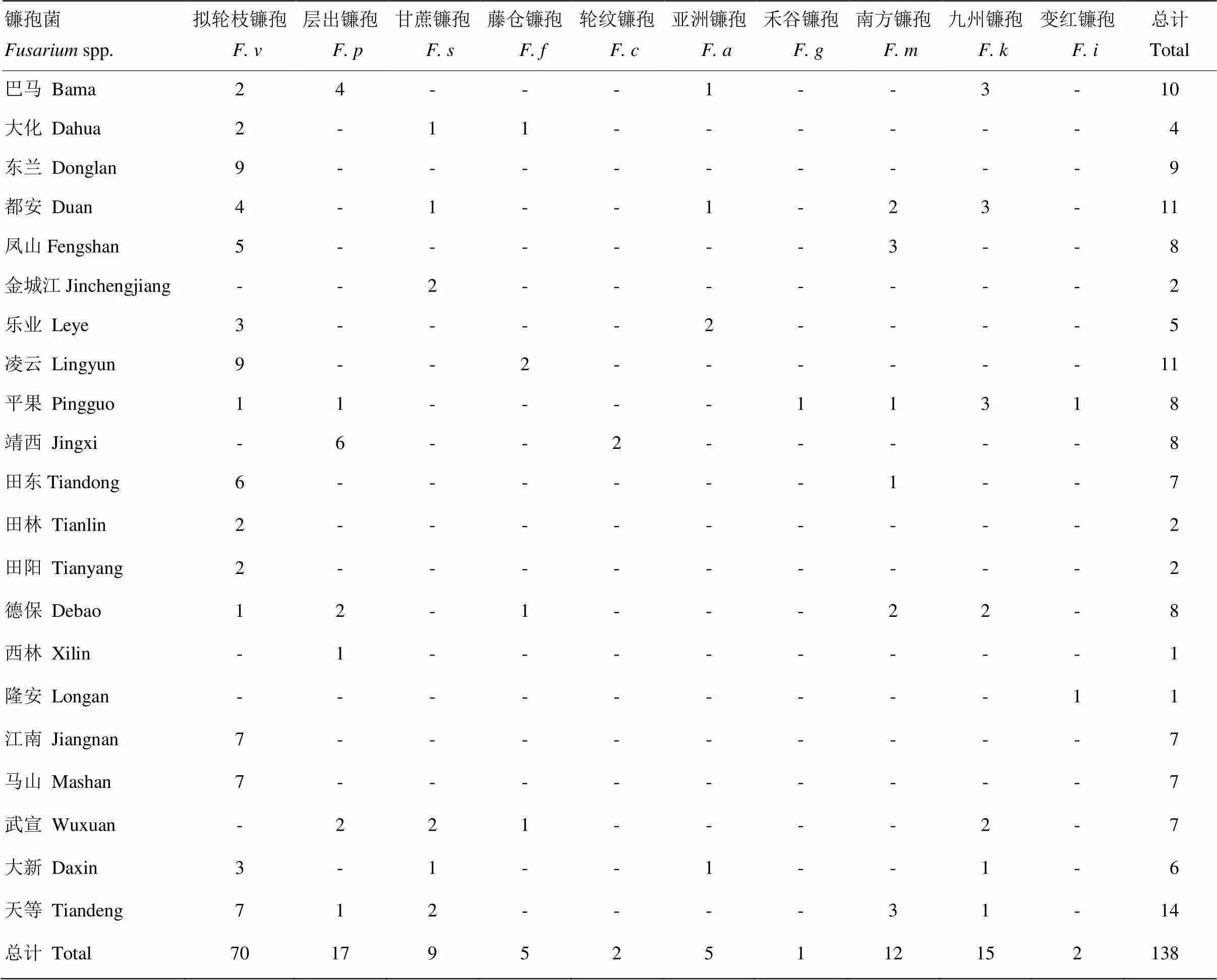
表3 广西21个县(区)镰孢菌的分离情况
=;=;=;=;=;=;=;=;=;=

a、A:小孢子microconidia;b、B:大孢子macroconidia;c、C:孢子链microconidia chain;d、D:产孢细胞conidiogenus cell;e、E:接种后病害症状symptom after inoculation。a—e:甘蔗镰孢F. sacchari;A—E:轮纹镰孢F. concentricum。a-b, A: scale bar=10 μm; c-d, B-D: scale bar=25 μm
采用部分镰孢菌与10个参考菌株的基因序列构建系统发育树(图2),禾谷镰孢群组自展值为90,亚洲镰孢群组自展值为83,其余8个群组的自展值均为98—99,高度相似,因此鉴定为与参考菌株相同的镰孢种。镰孢菌亦可分为两个大的进化群组,即藤仓镰孢复合种进化群组和禾谷镰孢复合种、九州镰孢与变红镰孢进化群组。藤仓镰孢复合种分为拟轮枝镰孢、层出镰孢、甘蔗镰孢、藤仓镰孢和轮纹镰孢5个群组,拟轮枝镰孢与其他4个复合种可以划分为2个亚群,藤仓镰孢和层出镰孢亲缘关系更近且位于彼此独立的群组。禾谷镰孢复合种分为禾谷镰孢、亚洲镰孢和南方镰孢3个群组。

图2 基于TEF-1α基因序列构建部分镰孢菌菌株的系统发育树
2.3 毒素化学型检测
对拟轮枝镰孢、藤仓镰孢、层出镰孢、甘蔗镰孢和轮纹镰孢所携带产伏马毒素合成关键基因进行PCR检测(图3-a),88个菌株能扩增出目标条带,占比85.43%,表明这88个菌株携带伏马毒素关键合成基因,具有潜在的产伏马毒素能力。拟轮枝镰孢、层出镰孢、甘蔗镰孢和藤仓镰孢检测到的菌株数分别为67、13、5和3。轮纹镰孢只有2个菌株,均来自百色市靖西市,未检测到该基因。
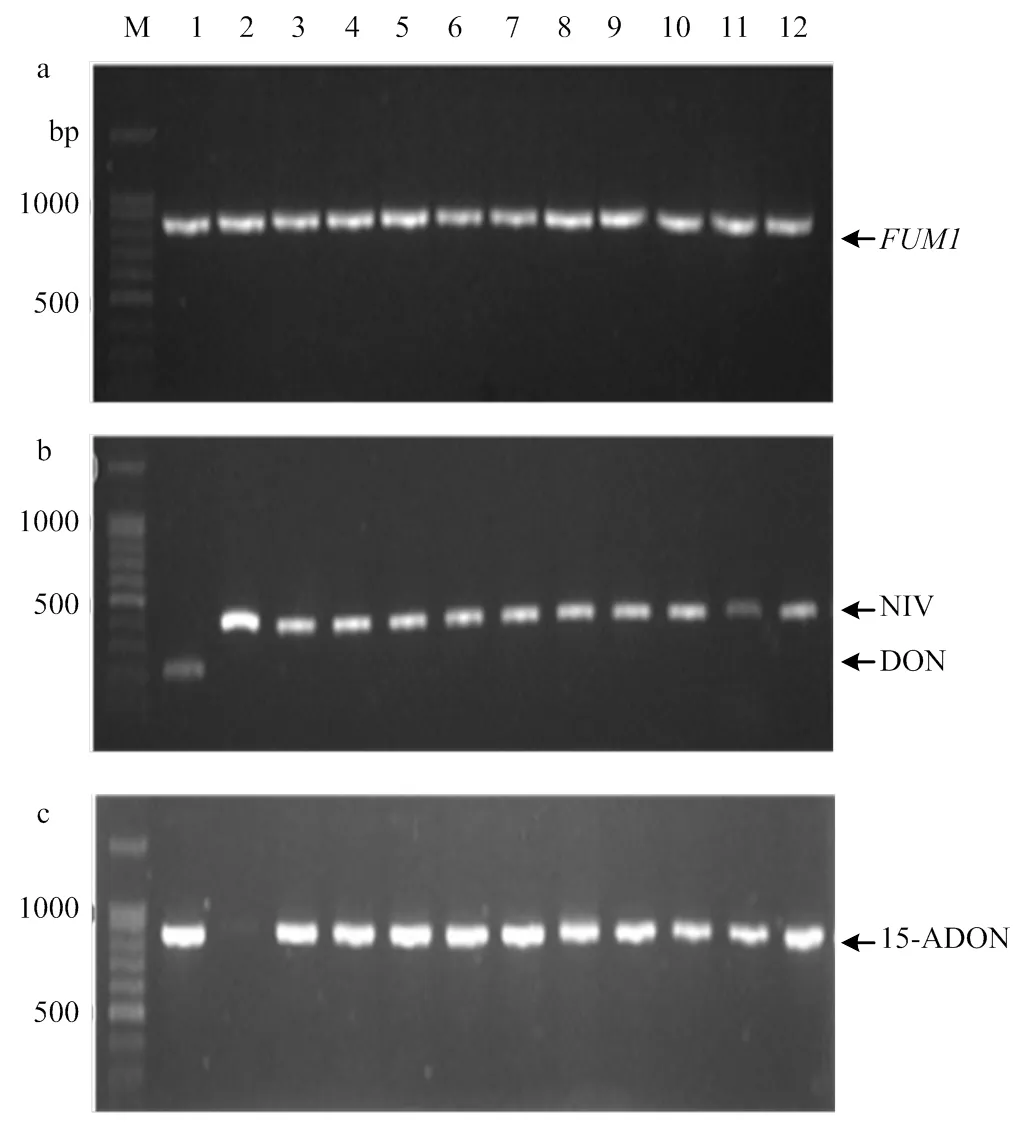
M:DNA Marker。a:F. verticillioides的FUM1检测FUM1 detection of F. verticillioides。b:FGSC的DON和NIV检测DON and NIV detection of FGSC;1:F. graminearum;2、3:F. asiaticum;4—12:F. meridionale。C:FGSC的15-ADON检测 15-ADON detection of FGSC;1:F. graminearum;2、3:F. asiaticum;4—12:F. meridionale
对南方镰孢、亚洲镰孢、亚洲镰孢、变红镰孢和九州镰孢进行毒素化学型检测,检测结果见表4。共检测出4种毒素化学型,即NIV、DON+15DON、15-ADON和NIV+15-ADON。利用引物对Tri13F/ Tri13R,可同时鉴定NIV(415 bp)和DON(234 bp)化学型(图3-b),35个菌株中,有25个菌株具有产NIV毒素潜力,分别为亚洲镰孢3个,南方镰孢10个,九州镰孢10个,变红镰孢2个。只有禾谷镰孢菌株Pingguo4具有产DON毒素潜力。利用引物对Tri315F/Tri315R可鉴定15-ADON(864 bp)(图3-c),35个菌株中,有15个菌株具有产15-ADON潜力,分别为禾谷镰孢1个,亚洲镰孢1个,南方镰孢10个,变红镰孢1个,九州镰孢2个。12个菌株同时具有产NIV和15-ADON潜力,其中亚洲镰孢1个,南方镰孢8个,九州镰孢2个,变红镰孢1个。
1个禾谷镰孢菌株具有产DON和15-ADON潜力;1个亚洲镰孢具有产NIV和15-ADON潜力,2个亚洲镰孢只具有产NIV潜力;8个南方镰孢具有产NIV和15-ADON潜力,2个只具有产NIV潜力,2个只具有产15-ADON潜力;2个九州镰孢具有产NIV和15-ADON潜力,8个九洲镰孢只具有产NIV潜力;1个变红镰孢具有产NIV和15-ADON潜力,1个只具有产NIV潜力。所有菌株均未检测到3-ADON。结果表明,NIV是禾谷镰孢复合种、九州镰孢和变红镰孢最主要的潜在毒素化学型,NIV和15-ADON是广西玉米穗腐病禾谷镰孢复合种最主要的潜在毒素化学型(表4)。
3 讨论
在世界范围内,由于栽培制度、气候特点的差异,各地区玉米穗腐病的优势病原菌并不完全一致,我国多以拟轮枝镰孢或禾谷镰孢复合种为优势致病菌[16]。然而,广西地区由于其特殊的生态环境,该地区玉米穗腐病的致病镰孢种群构成具有一定独特性。本研究结果显示,除拟轮枝镰孢外,层出镰孢、九州镰孢和南方镰孢分离频率也较高,而禾谷镰孢分离频率较低,这与我国其他生态区优势镰孢菌构成存在较大的差异。本研究并未分离到亚粘团镰孢,亚粘团镰孢在冷凉地区更常见[13],我国陕西、内蒙古、黑龙江、吉林、辽宁、河北、甘肃等地区玉米染病籽粒上分离到该镰孢菌[2,16],而分离到形态学上与亚粘团镰孢相似的甘蔗镰孢和轮纹镰孢[12]。甘蔗镰孢和轮纹镰孢过去曾被记录为亚粘团镰孢,本研究还将所有菌株序列与亚粘团镰孢如AF160289.1(菌株NRRL22016)等构建系统发育树,结果表明甘蔗镰孢、轮纹镰孢与亚粘团镰孢三者位于独立的群组。Hsuan等[17]从马来西亚玉米腐烂籽粒中分离到甘蔗镰孢。本研究经柯赫氏法则验证,接种甘蔗镰孢和轮纹镰孢均能导致玉米穗腐病的发生,再分离菌株与接种菌株的形态学特征一致,本研究为国内首次报道甘蔗镰孢和轮纹镰孢是玉米穗腐病的致病菌。甘蔗镰孢分布于印度、菲律宾等热带地区[18],可以引起甘蔗鞘腐病、枯萎病[12],甘蔗镰孢和轮纹镰孢可能与广东和广西香蕉冠腐病相关[19]。

表4 镰孢菌菌株的毒素化学型检测
拟轮枝镰孢能在不同环境条件下引起玉米穗腐病的发生和伏马毒素积累[9,11,20-23]。除了2个轮纹镰孢菌株,其余4个藤仓镰孢复合种均不同程度地检测到,共在88个菌株中检测到了该基因,其中以优势拟轮枝镰孢检出率最高,作为伏马毒素合成的关键基因,该基因的存在与否很大程度上决定着伏马毒素是否产生,Covarelli等[24]在分离的所有意大利拟轮枝镰孢中均能检测到,但部分菌株并未检测到伏马毒素;Duan等[5]研究结果显示,来自我国18个省(市)的82个拟轮枝镰孢菌株均能检测到,其中3个菌株未检测到伏马毒素;Glenn等[25]研究表明,部分拟轮枝镰孢菌不产生伏马毒素是由于的变异或伏马毒素合成基因的缺失,例如菌株NRRL25059缺失、、和。本研究所获得的3个拟轮枝镰孢分离物没有检测到,因此,为了明确拟轮枝镰孢等藤仓镰孢复合种能否产生伏马毒素,还需要进行毒素定量检测。与其他4个藤仓镰孢复合种不同,2个轮纹镰孢菌株均未检测出,表明这2个菌株不具有产伏马毒素的能力,事实上,轮纹镰孢主要产生白僵菌毒素和恩镰孢菌素[26]。
本研究中,禾谷镰孢复合种和九州镰孢为次优势镰孢菌,变红镰孢较少。广西禾谷镰孢复合种构成与我国东北地区和黄淮海地区差异较大,与我国西南地区的种群构成更为相近。秦子慧等[16]研究表明,我国禾谷镰孢分布广泛,南方镰孢主要分布于云南、贵州及陕西商洛等南方生态区;周丹妮等[4]研究表明,重庆及周边地区的禾谷镰孢复合种由南方镰孢和亚洲镰孢构成,其中南方镰孢为优势种。本研究中禾谷镰孢复合种由南方镰孢、亚洲镰孢和禾谷镰孢3个独立种构成。九州镰孢作为一个较新的种[27],近年来已被报道是玉米穗腐病致病菌[5],在本研究中分离频率较高,分布于广西不同区域的7个县。变红-木贼镰孢复合种(species complex,FIESC)至少包括变红镰孢和木贼镰孢2个种,其中变红镰孢主要分布于热带及亚热带地区[12],本研究共鉴定出2个变红镰孢菌株,分离自南宁市隆安县和百色市平果县的春季玉米病穗。
广西禾谷镰孢复合种毒素化学型研究结果与前人研究相吻合,不同之处可能是由于地理气候的不同导致适应该地区的禾谷镰孢复合种构成的差异,并因此导致产毒类型的不同。在Yang等[28]研究中,侵染四川、重庆大麦的亚洲镰孢,NIV产生菌所占比例高于80%,而Suga等[29]研究发现,日本的246个亚洲镰孢菌株,70%产生NIV,说明亚洲镰孢以产NIV为主。马红霞等[15]研究表明,我国北方春播区和黄淮海夏播区的禾谷镰孢复合种主要的毒素化学型为DON和15-ADON;Duan等[5]对我国东北、黄淮海和西南玉米生态区禾谷镰孢复合种的毒素化学型分析及毒素含量测定结果表明,禾谷镰孢的主要毒素化学型为15-ADON,南方镰孢是NIV型菌株,主要来源于西南玉米区,其中部分南方镰孢同时产生NIV和15-ADON;Zhou等[30]对重庆市及周边地区的研究结果类似。本研究中禾谷镰孢复合种产NIV和15-ADON菌株较多,是由于南方镰孢分离频率较高的缘故。Sampietro等[31]研究显示,在阿根廷温带和亚热带区检测到的单端孢霉烯族类毒素的化学型存在种的特异性,其中禾谷镰孢只产DON型(温带),南方镰孢和布氏镰孢为产NIV型(亚热带)。AOKI等[27]采用的九州镰孢菌株具有产NIV能力,Thrane等[32]研究发现九州镰孢具有产NIV和恩链霉素的能力,本研究中10个九州镰孢菌株具有产NIV的潜力。变红镰孢具有产白僵菌素、单端孢霉烯族类毒素能力[12],本研究中两个菌株均具有产NIV潜力,其中一个还具有产15-ADON潜力。
玉米穗腐病在广西各玉米主产市(县)均有不同程度的发生,高温、高湿、多雨的环境气候为病虫侵染玉米提供了良好的条件,穗腐病已成为玉米生产上的重要问题。笔者项目组近年来调查了广西玉米主产区穗腐病的自然发生情况并采集发病果穗,镰孢菌穗腐病在各玉米主产县份均有发生,以藤仓镰孢复合种引起的穗腐病数量更多,由禾谷镰孢复合种、九州镰孢引起的单端孢霉烯族毒素危害也不容忽视。穗腐病在偏冷凉山区危害重于平原地区。引起镰孢穗腐病的玉米穗部害虫在本地区主要有玉米螟、桃蛀螟和棉铃虫等,玉米螟和桃蛀螟发生率低于棉铃虫,但是引发可见穗腐病症状的概率却远高于棉铃虫,这是由于棉铃虫体型较大以危害花丝为主。在不同地点,害虫和镰孢菌种群对不同玉米品种果穗的影响并不一致,这是由于品种的抗性、栽培方式以及适宜镰孢菌生长的温度、湿度等多因素造成的。因此,在玉米品种选育过程中,需要选育兼抗玉米螟和不同镰孢菌的自交系和品种,以减少镰孢菌的感染,从而降低真菌毒素污染。
玉米穗腐病遗传抗性的利用将有利于减少玉米产量损失、农药施用量和真菌毒素污染,然而,广西本体玉米育种机构极为缺乏优异的抗穗腐病自交系,且不具有抗穗腐病接种鉴定技术。目前,我国在进行玉米品种和自交系的抗穗腐病鉴定过程中,普遍采用拟轮枝镰孢或禾谷镰孢进行接种鉴定,拟轮枝镰孢作为广西玉米穗腐病优势致病镰孢可以作为病原菌进行接种鉴定,但禾谷镰孢在广西分布极少,层出镰孢、九州镰孢和南方镰孢分布较多,致病性测定表明禾谷镰孢复合种中的南方镰孢对玉米果穗致病能力强,对人畜毒性更重,需要持续关注,因此,禾谷镰孢在广西地区不适宜作为抗穗腐病的接种体使用,应考虑采用致病能力强和产毒能力强的南方镰孢进行接种鉴定。除拟轮枝镰孢和南方镰孢外,抗源筛选还需兼顾层出镰孢和九州镰孢的抗性,以选择出更适应本区域的种质资源。
4 结论
广西21个县(区)的138个单孢分离物鉴定为10种镰孢菌,其中拟轮枝镰孢为优势致病菌,禾谷镰孢复合种、层出镰孢和九州镰孢为次优势致病菌,而甘蔗镰孢则是首次报道引起玉米穗腐病。拟轮枝镰孢、层出镰孢、甘蔗镰孢、藤仓镰孢均不同程度地检测到,广西禾谷镰孢复合种的主要毒素化学型为NIV和15-ADON,变红镰孢和部分九州镰孢的毒素化学型为NIV。广西地区玉米种质资源抗源筛选应主要考虑拟轮枝镰孢、层出镰孢、九州镰孢和南方镰孢的抗性,以选择出更适应本区域的种质资源。
[1] Mesterházy A, Lemmens M, Reid L M. Breeding for resistance to ear rots caused byspp. in maize—a review., 2012, 131(1): 1-19.
[2] 孙华, 张海剑, 马红霞, 石洁, 郭宁, 陈丹, 李坡. 春玉米区穗腐病病原菌组成、分布及禾谷镰孢复合种的鉴定. 植物病理学报,2018, 48(1): 8-15.
SUN H, ZHANG H J, MA H X, SHI J, GUO N, CHEN D, LI P. Composition and distribution of pathogens causing ear rot in spring maize region and identification ofspecies complex., 2018, 48(1): 8-15. (in Chinese)
[3] 孙华, 张海剑, 郭宁, 石洁, 陈丹, 马红霞. 黄淮海夏玉米主产区穗腐病病原菌的分离鉴定. 植物保护学报, 2017, 44(5): 796-802.
SUN H, ZHANG H J, GUO N, SHI J, CHEN D, MA H X. Isolation and identification of pathogens causing maize ear rot inHuang- Huai-Hai summer corn region., 2017, 44(5): 796-802. (in Chinese)
[4] 周丹妮, 王晓鸣, 李丹丹, 杨洋, 陈国康, 段灿星. 重庆及周边地区玉米穗腐病致病镰孢菌的分离与鉴定. 植物保护学报, 2016, 43(5): 782-788.
ZhOU D N, WANG X M, LI D D, YANG Y, CHEN G K, DUAN C X. Isolation and identification ofspecies causing maize ear rot in Chongqing and its vicinity., 2016, 43(5): 782-788. (in Chinese)
[5] Duan C X, Qin Z H, Yang Z H, Li W X, Sun S L, Zhu Z D, Wang X M. Identification of pathogenicspp. causing maize ear rot and potential mycotoxin production in China., 2016, 8(6): 186.
[6] KRISTENSEN R, TROP M, KOSIAK B, HOLST-JENSEN A. Phylogeny and toxigenic potential is correlated inspecies as revealed by partial translation elongation factor 1 alpha gene sequences., 2005, 109(2): 173-186.
[7] 孙华, 丁梦军, 张家齐, 石洁, 郭宁, 李坡. 河北省玉米穗腐病病原菌鉴定及潜在产伏马毒素镰孢菌系统发育分析. 植物病理学报, 2019, 49(2): 151-159.
SUN H, DING M J, ZHANG J Q, SHI J, GUO N, LI P. Identification of pathogens causing maize ear rot and the phylogenetic analysis of fumonisins-producingspecies in Hebei province., 2019, 49(2): 151-159. (in Chinese)
[8] 段灿星, 王晓鸣, 宋凤景, 孙素丽, 周丹妮, 朱振东. 玉米抗穗腐病研究进展. 中国农业科学, 2015, 48(11): 2152-2164.
DUAN C X, WANG X M, SONG F J, Sun S L, ZHOU D N, ZHU Z D. Advances in research on maize resistance to ear rot., 2015, 48(11): 2152-2164. (in Chinese)
[9] TSEHAYE H, BRURBERG M B, SUNDHEIM L, ASSEFA D, TRONSMO A, TRONSMO A M. Natural occurrence ofspecies and fumonisin on maize grains in Ethiopia. EuropeanPlant, 2017, 147: 141-155.
[10] 尚艳娥, 杨卫民. CAC、欧盟、美国与中国粮食中真菌毒素限量标准的差异分析. 食品科学技术学报, 2019, 37(1): 10-15.
SHANG Y E, YANG W M. Variation analysis of cereals mycotox limit standards of CAC, EU, USA, and China., 2019, 37(1): 10-15. (in Chinese)
[11] 郭聪聪, 朱维芳, 付萌, 庞民好, 刘颖超, 董金皋. 甘肃省玉米籽粒中镰孢菌分离频率及伏马毒素含量监测. 植物保护学报, 2015, 42(6): 942-948.
GUO C C, ZHU W F, FU M, PANG M H, LIU Y C, DONG J G. Occurrence ofspecies and fumonisins associated with maize kernels from Gansu Province., 2015, 42(6): 942-948. (in Chinese)
[12] 董汉松. 植病研究法. 北京: 中国农业出版社, 2012.
DONG H S.Beijing: China Agriculture Press, 2012. (in Chinese)
[13] Leslie J F, Summerell B A.. Blackwell Publishing, 2006.
[14] 王拱辰, 郑重, 叶琪明, 章初龙. 常见镰刀菌鉴定指南. 北京: 中国农业科技出版社, 1996.
Wang G C, ZHENG Z, YE Q M, ZHANG C L.. Beijing: China Agricultural Science and Technology Press, 1996. (in Chinese)
[15] 马红霞, 孙华, 郭宁, 张海剑, 石洁, 常佳迎. 禾谷镰孢复合种毒素化学型及遗传多样性分析. 中国农业科学, 2018, 51(1): 82-95.
MA H X, SUN H, GUO N, ZHANG H J, SHI J, CHANG J Y. Analysis of toxigenic chemotype and genetic diversity of thespecies complex., 2018, 51(1): 82-95. (in Chinese)
[16] 秦子惠, 任旭, 江凯, 武小菲, 杨知还, 王晓鸣. 我国玉米穗腐病致病镰孢种群及禾谷镰孢复合种的鉴定. 植物保护学报, 2014, 41(5): 589-596.
QIN Z H, REN X, JIANG K, WU X F, YANG Z H, WANG X M. Identification ofspecies andspecies complex causing maize ear rot in China., 2014, 41(5): 589-596. (in Chinese)
[17] HSUAN H M, SALLEH B, ZAKARIA L. Molecular identification ofspecies inspecies complex from rice, sugarcane and maize from Peninsular Malaysia., 2011, 12: 6722-6732.
[18] LESLIE J F, SUMMERELL B A, BULLOCK S, DOE F J. Description ofand neotypification of its anamorph., 2005, 97(3): 718-724.
[19] ZENG L S, ZHAO Z H, Lü S, XI Z J, LI M H, XI P G, JIANG Z D. Thespecies isolated from banana and their phylogenetic relationships., 2015, 32(4): 617-632.
[20] SUNDHEIM L, TSEHAYE H. Fumonisin in Zambia and neighboring countries in a changing climate//DANIELS J A.. Nova Science Publishers, 2015, 39: 69-84.
[21] NCUBE E, FLETT B C, WAALWIJK C, VILJOEN A.spp. and levels of fumonisins in maize produced by subsistence farmers in South Africa., 2011, 107(1/2): Article 367.
[22] REYES-VELÁZQUEZ W P, FIGUEROA-GÓMEZ R M, BARBERIS M, REYNOSO M M, ROJO F G, CHULZE S N, TORRES A M.species (section) occurrence and natural incidence of beauvericin, fusaproliferin and fumonisins in maize hybrids harvested in Mexico., 2011, 27: 187-194.
[23] ABBAS H K, CARTWRIGHT R D, XIE W P, SHIER T. Aflatoxin and fumonisin contamination of corn (maize,) hybrids in Arkansas., 2006, 25: 1-9.
[24] COVARELLI L, STIFANO S, BECCARI G, RAGGI L, LATTANZIO V M T, AABERTINI E. Characterization ofstrains isolated from maize in Italy: Fumonisin production, pathogenicity and genetic variability, 2012, 31(1): 17-24.
[25] GLENN A E, ZITOMER N C, ZIMERI A M, WILLIAMS L D, RILEY R T, PROCTOR R H. Transformation-mediated complementationof agene cluster deletion inrestores both fumonisin production and pathogenicityon maize seedlings., 2008, 21(1): 87-97.
[26] RAJMOHAN N, GIANFAGNA T J, MECA G, MORETTI A, ZHANG N. Molecular identification and mycotoxin production of-associated fusaria isolated from two geographic locations in the United States. European, 2011, 131: 631-642.
[27] Aoki T, O’DONNELL K.sp. nov. from Japan., 1998, 39(1): 1-6.
[28] YANG L, VAN DER LEE T, YANG X, YU D, WAALWIJK C.populations on chinese barley show a dramatic gradient in mycotoxin profiles., 2008, 98(6): 719-727.
[29] SUGA H, KARUGIA G W, WARD T, TOMIMURA G K, NAKAJIMA T, MIYASAKA A, KOIZUMI S, KAGEYAMA K, HYAKUMACHI M. Molecular characterization of thespecies complex in Japan., 2008, 98(2): 159-166.
[30] ZHOU D N, WANG X M, CHEN G K, SUN S L, YANG Y, ZhU Z D, DUAN C X.The majorspecies causing maize ear and kernel rot and their toxigenicity in Chongqing, China., 2018, 10(2): 90.
[31] SAMPIETRO D A, MARIN P, IGLESIAS J, PRESELLO D A, VATTUONE M A, CATALAN C A, GONZALEZ JAEN M T. Amolecularbasedstrategy forrapid diagnosis oftoxigenicspecies associatedtocerealgrainsfrom Argentina.,2010, 114(1):74-81.
[32] THRANE U, Adler A, CLASEN P E, GALVANO F, LANGSETH W, LEW H, LOGRIECO A, NIELSEN K F, RITIENI A. Diversity in metabolite production by,, and., 2004, 95(3): 257-266.
Composition ofSpecies Causing Maize Ear Rot and Analysis of Toxigenic Chemotype in Guangxi
DU Qing1, TANG ZhaoLei1, LI ShiChu1, SHANGGUAN LingLing2, LI HuaJiao2, DUAN CanXing3
(1Institute of maize research, Guangxi Academy of Agricultural Sciences, Nanning 530007;2Guangxi Agricultural Vocational and Technical College, Nanning 530007;3Institute of Crop Sciences, Chinese Academy of Agricultural Sciences/National Key Facility of Crop Gene Resources and Genetic Improvement, Beijing 100081)
【】The objective of this study is to clarify the composition and toxigenic chemotype ofspecies causing maize ear rot in Guangxi, and to provide important guidance and theoretical basis for comprehensive control of maize ear rot and reasonable distribution of varieties and resistance breeding.【】The diseased ear samples were collected from main maize producing areas in Guangxi between 2016 and 2018, a total of 138 isolates from 21 counties (districts) were obtained by tissue separation and single-spore purification.species were identified and determined according to morphological characteristics and molecular methods. The phylogenetic tree was constructed based ongene sequences, and specific primers were used to detect toxigenic chemotype.【】A total of 10species were identified and confirmed among 138 isolates, including,,,,,,,,and, with the isolation frequencies of 50.72%, 12.32%, 10.87%, 8.70%, 6.52%, 3.62%, 3.62%, 1.45%, 1.45% and 0.72%, respectively.species complex (FGSC) containedthree independent species, i.e.,and.was the predominant pathogen, FGSC,andwere the secondary predominant pathogens.were the first reported to be the pathogen of maize ear rot in China. The key generesponsible for the biosynthesis of fumonisins was detected among 67, 13, 5and 3strains, respectively, which indicated the potential ability of producing fumonisins.was not detected in thestrains. Four toxigenic chemotypes including NIV, 15-ADON, NIV+15-ADON and DON+15-ADON were detected among FGSC,andstrains. Strains containing NIV chemotype included 8, 2, 2, and 1. Strains containing 15-ADONchemotype included 2. The NIV+15-ADONchemotype was detected among 821and 1strains. Only 1strain carried DON+15-ADON chemotype. The 3-ADON chemotype was not detected among these strains.【】is the predominant pathogen of maize ear rot in Guangxi.FGSC,andare the secondary predominant species.was detected among,,andThe main toxigenic chemtype of FGSC in Guangxi is NIV+15-ADON, while NIV is the main toxigenic chemotype ofand some.The population composition ofspecies causing maize ear rot in Guangxi is different from equivalent study of temperate zone in China, which may be due to the fact thatspecies adapt to the high temperature and humidity growth environment in tropical and subtropical Guangxi and thus leads to the differences of toxigenic chemotypes.
maize; ear rot;spp.; isolation frequency; toxigenic chemotype
10.3864/j.issn.0578-1752.2019.11.005
2019-02-19;
2019-03-21
国家重点研发计划(2018YFD0200705)、农作物种质资源保护与利用专项(2018NWB036-12)、广西科技重大专项(桂科AA17204050-2)、广西农业科学院玉米研究所科技发展基金(桂玉科2017003)
杜青,E-mail:duq82@163.com。通信作者段灿星,E-mail:duancanxing@caas.cn
(责任编辑 岳梅)

