棉花CRVW的克隆与抗黄萎病功能分析
王秋莹,王伟巧,张艳,王国宁,吴立强,张桂寅,马峙英,杨君,王省芬
棉花的克隆与抗黄萎病功能分析
王秋莹,王伟巧,张艳,王国宁,吴立强,张桂寅,马峙英,杨君,王省芬
(河北农业大学农学院/教育部华北作物种质资源研究与利用重点实验室,河北保定 071001)
【】黄萎病(Verticillium wilt)是棉花生产上的重要病害,严重影响棉花的产量和品质。棉花基因组测序工作的完成为抗病基因挖掘提供了重要的信息资源。通过对一个尚未有功能注释的陆地棉基因(cotton resistance to Verticillium wilt)进行克隆与抗病功能验证,为棉花基因组信息完善、抗病机制解析和分子育种等方面奠定基础。根据参考基因组序列设计引物,同源克隆陆地棉()农大601(ND601)中的开放读码框(open reading frame,ORF)。利用在线工具ProtParam预测蛋白氨基酸组成、分子量、理论等电点、不稳定指数和总平均亲水性等性质;应用PSIPRED v3.3预测蛋白二级结构;在线工具ProtComp v. 9.0进行亚细胞定位预测;PlantCARE在线软件分析顺式作用元件。构建与绿色荧光蛋白基因融合表达载体,通过基因枪介导法转化洋葱表皮细胞,观察的表达位置。利用qRT-PCR检测在棉花不同组织、黄萎病菌胁迫条件下不同抗、感品种间,以及水杨酸(salicylic acid,SA)诱导处理条件下的表达模式。构建沉默载体,应用病毒诱导的基因沉默(virus-induced gene silencing,VIGS)技术进一步验证该基因在棉花中的抗病功能。检测沉默后一些与植物抗病调控相关标志基因的表达变化,分析其介导的抗病通路。从陆地棉品种ND601中克隆到的ORF,其全长780 bp,编码259个氨基酸残基,分子量约为30.2 kD,理论等电点9.59;蛋白二级结构含69.50%不规则卷曲、17.76% α-螺旋、11.20%延伸链和1.54% β-卷曲。综合生物信息学预测和荧光观察结果,显示CRVW主要存在于植物细胞膜和细胞质。在棉花根、茎和叶中都有表达,但在根中的表达量最高。的ORF上游序列()中包括响应乙烯(ethylene)、SA、生长素(auxin)和脱落酸(abscisic acid)等4种激素信号的顺式作用元件。另外,还包括一些与伤害、防御、胁迫、病菌、干旱和低温等相关的顺式作用元件。SA喷洒处理后,显著上调表达。黄萎病菌胁迫后,在抗病品种ND601和感病品种中棉所8号(CCRI8)中均显著上调表达,但在感病品种中上调表达的发生时间明显滞后。黄萎病菌处理20 d后,沉默组棉苗表现出比对照(CK)组更明显的黄化、萎蔫和落叶等黄萎病病症。进一步统计分析显示,沉默组病指显著高于CK组,表明沉默显著降低了棉苗对黄萎病菌的抗性。沉默后,棉苗中SA含量显著降低;(isochorismate synthase 1)、(enhanced disease susceptibility 1)、(phytoalexin deficient 4)、(nonexpresser of PR gene 1)和(pathogenesis-related protein 1)等与SA积累和信号调控相关的标志基因均发生显著下调表达。CRVW定位于细胞质和细胞膜,主要在棉花根部表达,可能通过SA信号通道参与棉花抗黄萎病反应过程。
棉花;黄萎病;CRVW;克隆;病毒诱导的基因沉默;抗性
0 引言
【研究意义】棉花是重要的纤维作物和油料作物,也是关系国计民生的重要战略物资。在生产上,黄萎病(Verticillium wilt)对棉花产量和品质危害严重,药剂难于防治。实践表明,培育和种植抗病品种是防治该病的有效途径[1]。因此,筛选和鉴定抗病基因,不仅有利于棉花抗黄萎病机制的解析,还能为棉花分子育种提供候选基因。【前人研究进展】黄萎病是由大丽轮枝菌()引起的土传真菌维管束病害[2]。组织结构抗性和生理生化抗性被认为在棉花抗黄萎病过程中发挥重要作用[3-5]。随着分子生物学的发展,越来越多的抗性基因获得鉴定,使得在分子水平解析棉花黄萎病抗性机制有了长足的发展。在组织结构抗性方面,棉花主要通过提高木质素积累和改变细胞壁组成增强对黄萎病菌的抗性,其中一些重要参与基因包括:与果胶代谢相关的(pectin methylesterase inhibitor)[6]、与木质素合成相关的(laccase)[7]和[8]、与细胞壁组成相关的(hybrid proline-rich protein)[9]等。在生理生化抗性方面,棉花能够通过(polyamine oxidase)调控对黄萎病菌具有抑制活性的精胺(spermine)和植保素(camalexin)的积累[10],依赖(enhanced disease susceptibility 1)调控水杨酸(salicylic acid,SA)信号通路、引发活性氧爆发(reactive oxygen species,ROS)和酚类物质积累等[11]。由南京农业大学等单位完成的陆地棉()TM-1基因组scaffold总长度为2.4 Gb,包含70 478个编码蛋白基因,通过与其他植物基因组进行比对,其中66 434个基因获得了注释[12]。相对于其他已测序植物,棉花基因组较大,基因多倍化明显,并且生长周期长,以至于通过棉花遗传转化大规模分析基因功能明显滞后于拟南芥、烟草、水稻等植物[12]。病毒诱导的基因沉默(virus-induced gene silencing,VIGS)技术避免植物转化,能够在侵染植物当代对目标基因进行功能分析[13]。因此,VIGS技术一经建立,即成为植物基因功能分析的强有力工具,得到了广泛的应用[14]。目前,该技术已经成功应用于棉花生长发育、抗病反应、代谢调控等功能基因研究[15-17]。棉花基因组研究已进入功能基因组时代,快速鉴定目标基因功能已成为未来重要的研究内容之一。【本研究切入点】河北农业大学棉花品种创新与产业化团队前期利用RNA-Seq技术构建了黄萎病菌侵染处理的海岛棉()和陆地棉表达谱[11, 18],发现其中一个无功能注释的基因表达受黄萎病菌显著诱导,可能参与棉花抗黄萎病菌反应过程,故将其命名为(cotton resistance to Verticillium Wilt)。【拟解决的关键问题】本研究通过对进行克隆、生物信息学分析、亚细胞定位、组织表达特异性分析、SA诱导和黄萎病菌胁迫处理后的表达模式分析、以及抗病功能鉴定等方面的研究,为进一步揭示其抗病机制奠定基础。
1 材料与方法
试验于2017—2019年在河北农业大学教育部华北作物种质资源研究与利用重点实验室进行。
1.1 试验材料
陆地棉抗病品种农大601(ND601)和感病品种中棉所8号(CCRI8)由河北农业大学棉花品种创新与产业化团队提供,种植于光照周期16 h(光照)/8 h(黑暗),温度25℃,相对湿度60%—70%的植物生长室中。
试验所用黄萎病菌为临西2-1,由河北农业大学棉花品种创新与产业化团队分离鉴定并继代保存于PDA(potato dextrose agar)培养基[19]。
植物亚细胞定位载体pCamE由河北农业大学棉花品种创新与产业化团队构建并保存[20]。棉花VIGS载体pTRV1和pTRV2由清华大学刘玉乐教授馈赠[13]。沉默对照载体pTRV2-CLA1(cloroplastos alterados 1 gene)和农杆菌GV3101由河北农业大学棉花品种创新与产业化团队保存。
EASYspin Plus植物RNA提取试剂盒购自北京艾德莱生物科技有限公司;EasyScript®First-Strand cDNA Synthesis SuperMix购自北京北京全式金生物技术有限公司;2×PhantaTMMaster Mix购自南京诺唯赞生物科技有限公司;pGM-T载体、T4 DNA连接酶、2×Taq PCR Master Mix、大肠杆菌DH5α感受态细胞、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒购自天根生化科技有限公司;DNA Marker、PrimeScriptTMRT reagent Kit with gDNA Eraser和EraserSYBR®TM试剂盒购自宝生物工程有限公司。
引物合成和测序工作由生工生物工程股份有限公司完成。
1.2 基因克隆
按照ZHANG等[18]的方法将ND601培养于MS培养基(murashige and skoog medium)上。取约14日龄的棉苗,按照EASYspin Plus植物RNA提取试剂盒说明书进行总RNA提取。依据EasyScript®First- Strand cDNA Synthesis SuperMix试剂盒说明书合成cDNA。根据已测序陆地棉TM-1编号为Gh_A06G1566的基因上下游序列设计扩增引物CRVW-F(5- GATTCTTTGATTTTCAAGAGGTG-3)和CRVW-R(5-CGATTAAAAGTAACAAATTATCGT-3)。目的基因PCR扩增体系(20 μL)为1 μL cDNA、1 μL CRVW-F、1 μLCRVW-R、10 μL 2×PhantaTMMaster Mix和7 μL去离子水。扩增程序为94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。1%琼脂糖凝胶电泳检测后,按照琼脂糖凝胶DNA回收试剂盒操作说明对目的片段进行回收,与pGM-T载体过夜连接(16℃)后,通过热激法转化大肠杆菌DH5α感受态细胞,菌落PCR筛选阳性克隆并送测序。
1.3 生物信息学分析
基因序列处理软件为BioEdit 7.0.4(http://www. mbio.ncsu.edu/bioedit/bioedit.html);陆地棉TM-1基因组序列信息和RNA-seq数据来源于CottonFGD网站(https://cottonfgd.org/);使用在线工具ProtParam(http://web.expasy.org/protparam)预测蛋白氨基酸组成、分子量、理论等电点、不稳定指数和总平均亲水性等性质;应用PSIPRED v3.3(www.psipred.net)预测蛋白二级结构;应用ProtComp v. 9.0(http://www. softberry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc)预测亚细胞定位;应用PlantCARE在线软件(http://bioinformatics.psb.ugent. be/webtools/plantcare/html/)预测分析顺式作用元件。
1.4 亚细胞定位载体构建与荧光观察
利用引物CRVW-SF(5-ATGCAACAA ATCAAAGATTCATGG-3,下划线处为Ⅰ酶切位点)和CRVW-SR(5-TTTCCACCCTAAA ACCTTAAGC-3,下划线处为Ⅰ酶切位点)扩增的ORF(去除终止密码子),并插入植物表达载体pCamE多克隆位点,由CaMV 35S启动子驱动,与编码绿色荧光蛋白(green fluorescent protein,gfp)基因融合表达。洋葱上皮细胞的制备、基因枪转化和荧光观察等操作参照YANG等[21]方法。
1.5 荧光定量PCR分析
按照EASYspin Plus植物RNA提取试剂盒说明书对棉苗组织进行总RNA提取。根据PrimeScript™ RT reagent Kit with gDNA Eraser试剂盒所提供方法合成cDNA。以棉花(catalytic subunit of protein phosphatase 2A)作为内参(PP2A1-F:5-GATCCTTG TGGAGGAGTGGA-3;PP2A1-R:5-GCGAAACAGTT CGACGAGAT-3)[22]。表达检测引物设计为qCRVW-F(5-TCCCGCTCCTCCTTCGATTT-3)和qCRVW-R(5-TGCATTTCAGCCTCTGGGATT-3)。棉花SA合成和信号通路标志基因检测引物按照SUN等[23]研究报道进行合成。荧光定量PCR(real-time quantitative polymerase chain reaction,qRT-PCR)反应体系为cDNA模版1.0mL、正反向引物各0.8mL(10 μmol·L-1)、2×SYBR mix 10 μL和7.4 μL灭菌双蒸水。使用Bio-Rad CFX96 Real-Time PCR Detection System进行荧光定量检测,具体程序为95℃ 15 s;95℃ 10 s,58℃ 10 s,72℃ 15 s,40个循环。采用2-ΔCt法进行相对定量分析。3次生物学重复检测。
1.6 SA诱导处理
参照YANG等[9]的方法,配制100 μmol·L-1的SA溶液,用喷雾器均匀喷洒于7日龄棉苗子叶,并以透明罩覆盖保湿。分别于处理后6、12、24和36 h后取子叶,-80℃保存备用。以喷洒蒸馏水组作为对照。每个时间点取3株棉苗混样,共重复3次。
1.7 黄萎病菌胁迫处理
按照YANG等[9]的方法制备浓度为1×107cfu/mL的黄萎病菌孢子悬浮液。采用“六棱塑料钵定量 接种法”对棉苗进行接菌处理[24],接种菌液体积为钵体的1/10。按5级标准统计病情,并计算病情指数[9]。
1.8 棉花VIGS
设计引物CRVW-VF(5-TTCCCGCTCC TCCTTCGATT-3,下划线处为RⅠ酶切位点)和CRVW-VR(5-AACCTCCACAAACCCTTG CC-3,下划线处为Ⅰ酶切位点)。通过PCR扩增400 bp的片段并插入pTRV2多克隆位点RⅠ和Ⅰ间。利用冻融法将构建好的载体转入农杆菌GV3101[25]。农杆菌介导的棉花VIGS操作按照GAO等[26]方法进行。
1.9 SA含量测定
通过对约15日龄的棉苗进行接菌处理,在0、12和24 hpi(hours post inoculation)时,收集3棵长势一致的棉苗第一片和第二片真叶进行混样,作为一个生物学重复,每个处理共采集3个生物学重复。采集的组织于液氮中研磨,按照Verberne等[27]方法提取SA,应用Agilent HPLC 1200 Series检测SA(流动相为甲醇﹕水﹕乙酸=80﹕19﹕1,流速为1 mL·min-1,上样量为20 μL,检测波长302 nm)。根据标准曲线计算SA含量。
1.10 数据分析
应用Graphpad Prism®6.02软件进行统计分析并作图。基因在不同时间和不同样本内的相对表达量进行两因素方差分析(Two-way ANOVA)和Sidak-test(<0.05)检测。
2 结果
2.1 CRVW克隆与生物信息学分析
提取陆地棉ND601总RNA(图1),反转录后的cDNA作为模板,利用引物CRVW-F和CRVW-R进行PCR扩增,产物经电泳检测显示约为800 bp(图1)。PCR产物经胶回收后与T载体连接,转化大肠杆菌并提取质粒。测序后,目的基因ORF全长780 bp,与参考基因组TM-1编号为Gh_A06G1566的序列相似性100%,编码蛋白含259个氨基酸残基,尚无法预测明显的功能域,为putative uncharacterizedprotein。后续研究表明该基因/蛋白与棉花黄萎病抗性相关,故命名为CRVW(cotton resistance to Verticillium wilt)。
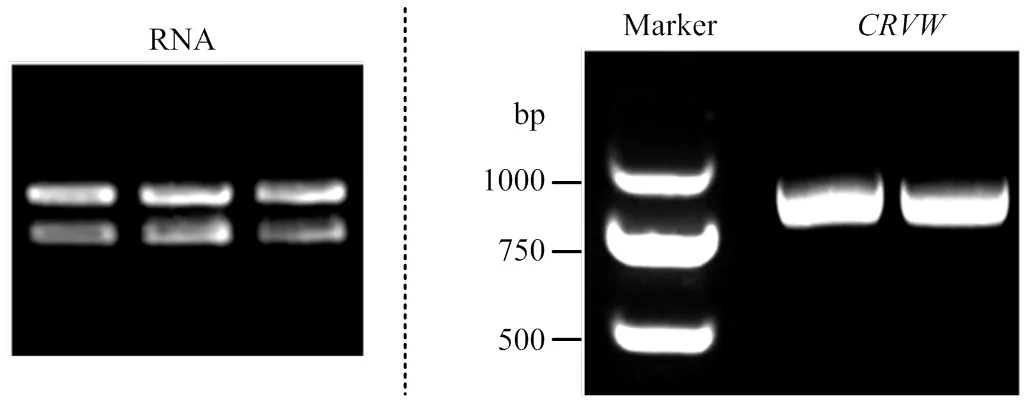
图1 棉苗RNA提取与CRVW的PCR扩增
经预测,CRVW分子量约为30.2 kD,理论等电点9.59,分子式C1332H2061N383O395S14;在组成蛋白的20种氨基酸中,丝氨酸(Ser)所占比例最高(12.0%),而组氨酸(His)所占的比例最低(0.8%);含32个负电荷氨基酸残基,42个正电荷氨基酸残基;不稳定指数为61.41,属于不稳定蛋白;总平均亲水性-0.975,属于疏水蛋白。二级结构预测显示CRVW含有69.50%不规则卷曲、17.76% α螺旋、11.20%延伸链和1.54% β-折叠。
2.2 CRVW亚细胞定位
ProtComp v. 9.0在线工具预测显示,CRVW最有可能位于细胞膜(基于Neural Nets算法)和细胞质(基于Pentamers算法)。为进一步确定CRVW在细胞中的位置,将其与GFP蛋白进行融合表达。荧光显微观察显示,单独表达GFP时,荧光信号存在于在细胞核、细胞质和细胞膜中;而对于CRVW与GFP融合表达的细胞,荧光主要出现在细胞膜和细胞质(图2)。综合生物信息学预测和荧光显微观察结果,表明CRVW主要存在于植物细胞膜和细胞质。
2.3 CRVW的组织表达特异性
已有RNA-seq数据显示,在棉花根、茎和叶中均有表达,且叶中最高。为进一步明确的组织表达情况,利用qPCR技术对该基因在陆地棉ND601根、茎和叶中的表达进行了检测。结果显示,在以上3种组织中均有表达,但在根中的表达量最高,大约是茎中的10倍和叶中的4倍(图3)。RNA-seq和qPCR检测结果均确认在棉花根、茎和叶中都有表达,但存在组织表达差异。
2.4 CRVW受SA诱导表达
从已测序棉花TM-1基因组调取ORF上游2 000 bp序列(染色体A06:100117602—100119601)作为潜在的启动子,命名为。预测分析显示,含有响应4种激素信号的顺式作用元件,包括乙烯(ethylene,ET)、SA、生长素(auxin)和脱落酸(abscisic acid,ABA)。另外,还包括一些与伤害、防御、胁迫、病菌、干旱和低温等相关的作用元件(表1)。根据TM-1上游序列设计引物,对抗病品种ND601和感病品种CCRI8中上游序列进行同源克隆,并未发现抗感品种在所含顺式作用元件的位置和数量上存在差异(结果未显示)。
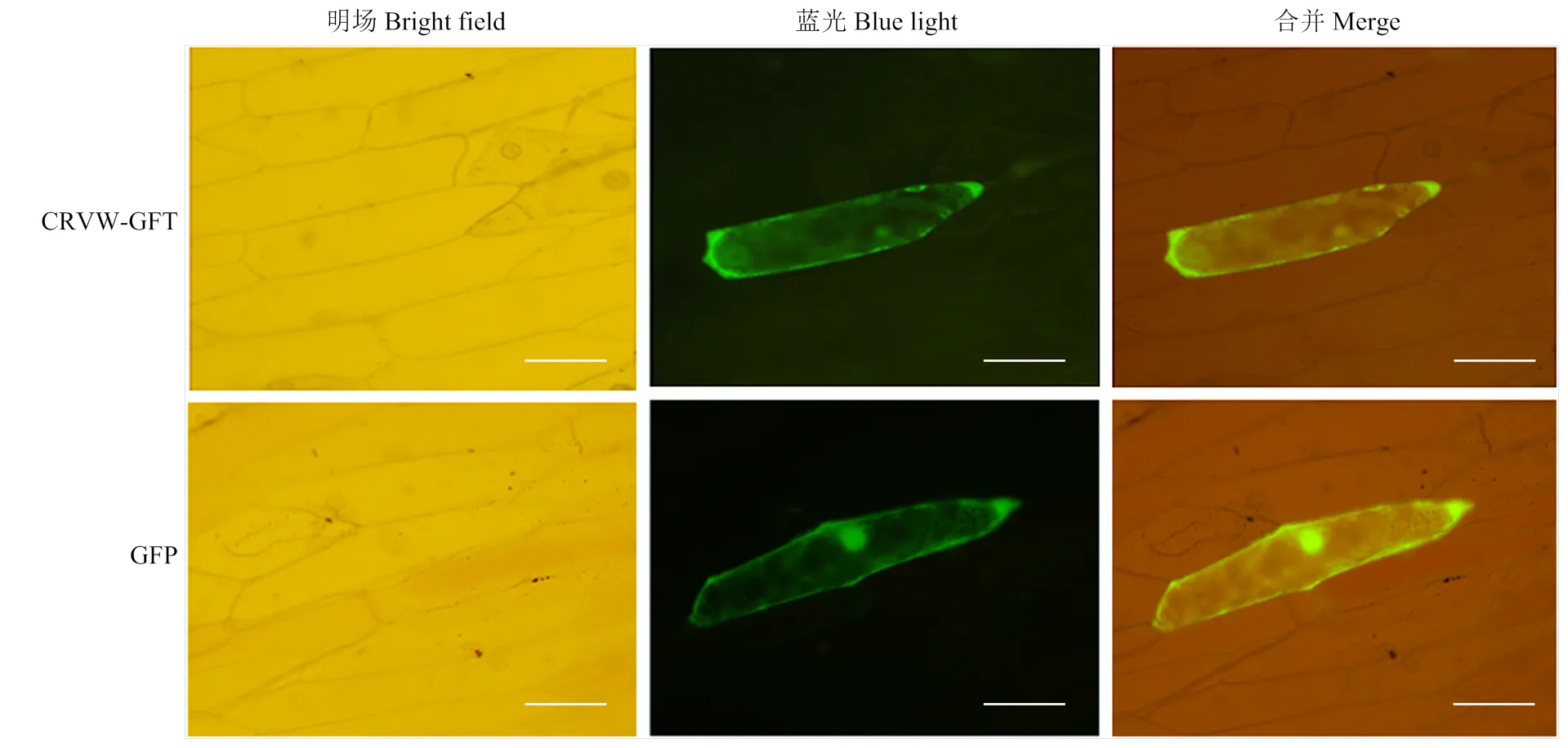
图2 CRVW在洋葱表皮细胞中的亚细胞定位
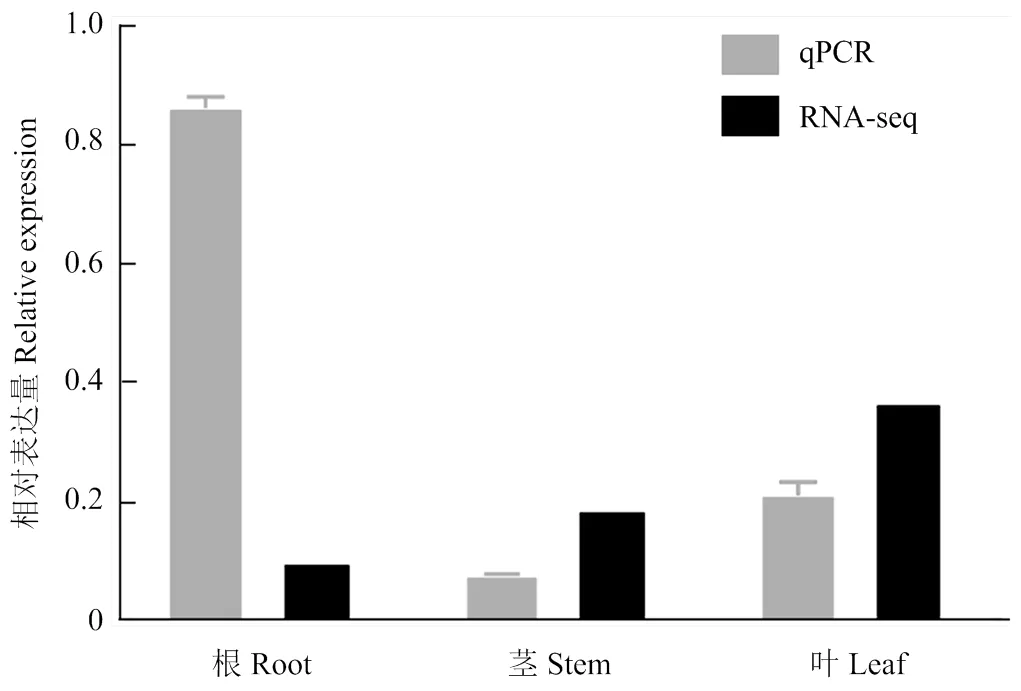
图3 棉花不同组织中CRVW的表达分析
进一步对棉苗进行SA诱导处理,结果显示,与对照相比,在所有4个时间点的表达量均发生显著上调(图4),表明受SA信号通路调控。
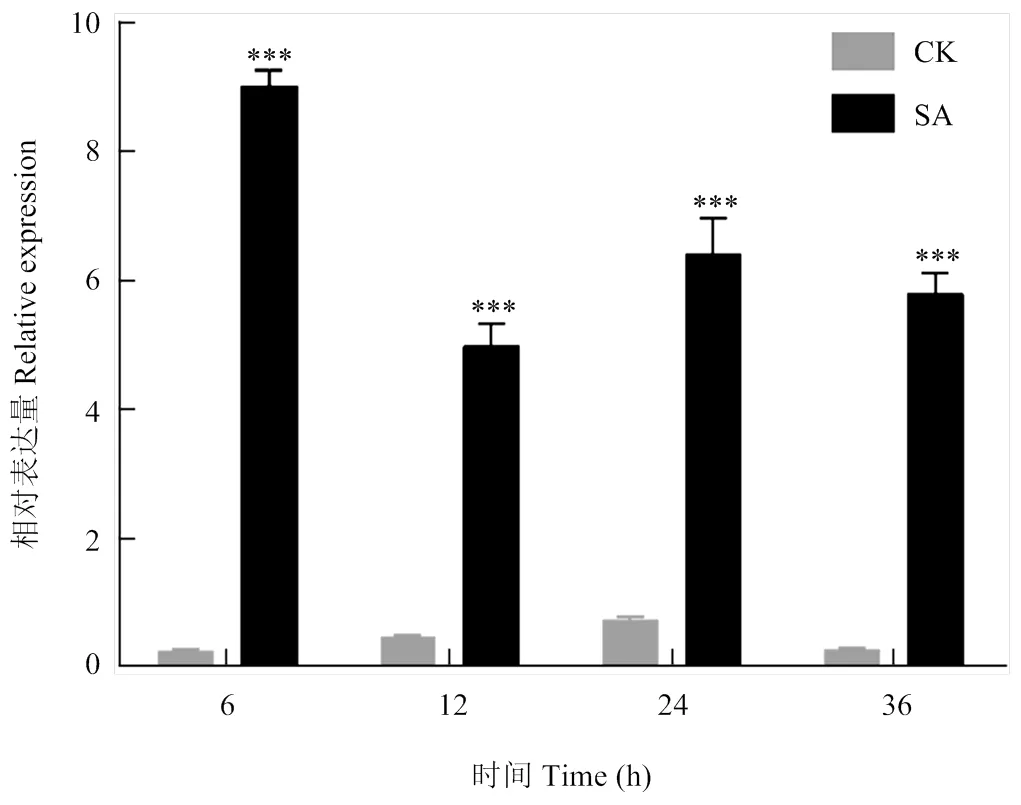
CK:对照组;SA:水杨酸处理组;***表示差异在P<0.001水平上具有显著性。下同
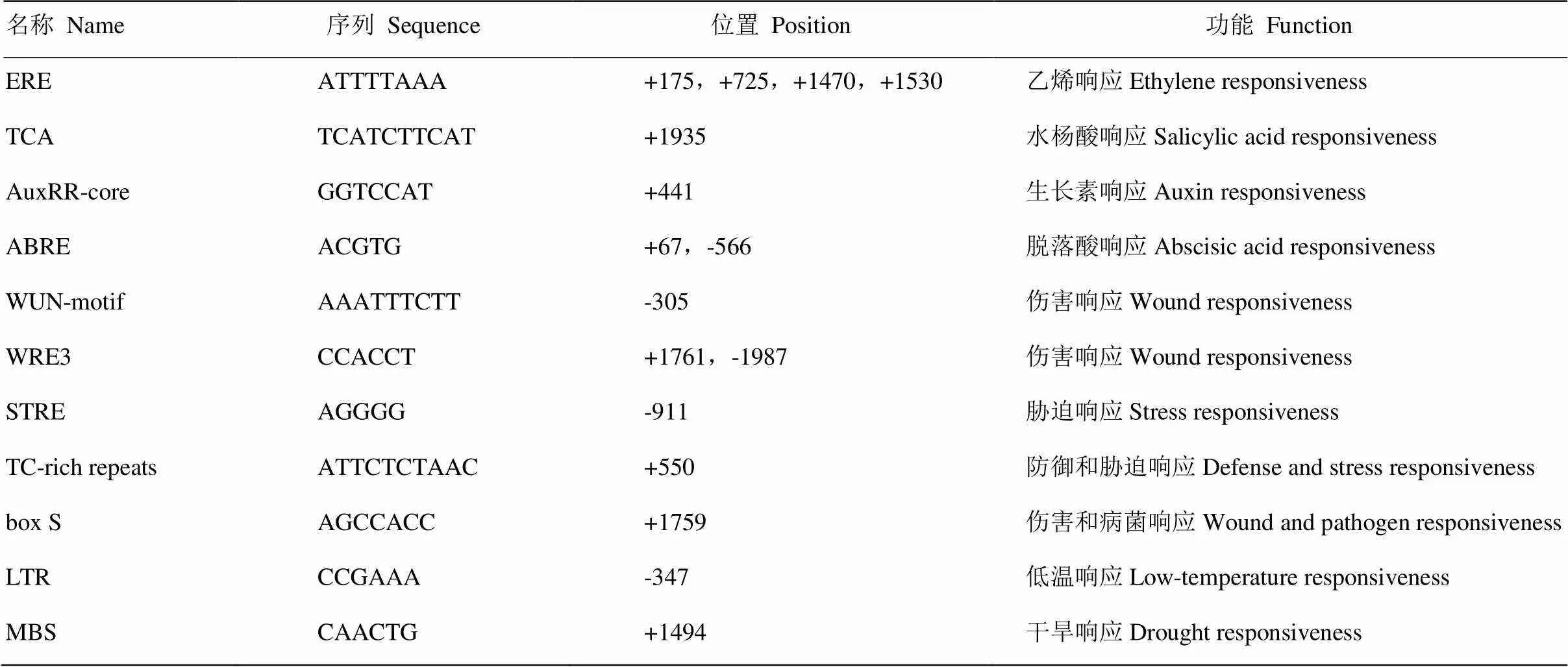
表1 CRVW-P中的顺式作用元件预测
2.5 CRVW受黄萎病菌诱导显著上调表达
以抗病品种ND601和感病品种CCRI8根组织为分析对象,利用qPCR检测在黄萎病菌胁迫下的表达模式。黄萎病菌胁迫后,在抗病品种中显著上调表达(与同时间水处理对照相比)(图5)。而对于感病品种CCRI8,在黄萎病菌胁迫后的6和12 hpi,的表达水平未发生显著变化,直到24 hpi其表达才发生显著上调(图6)。由此可见,黄萎病菌胁迫处理后,不管是抗病品种还是感病品种,均发生显著上调表达,但其在抗病品种中发生响应的时间早于感病品种。
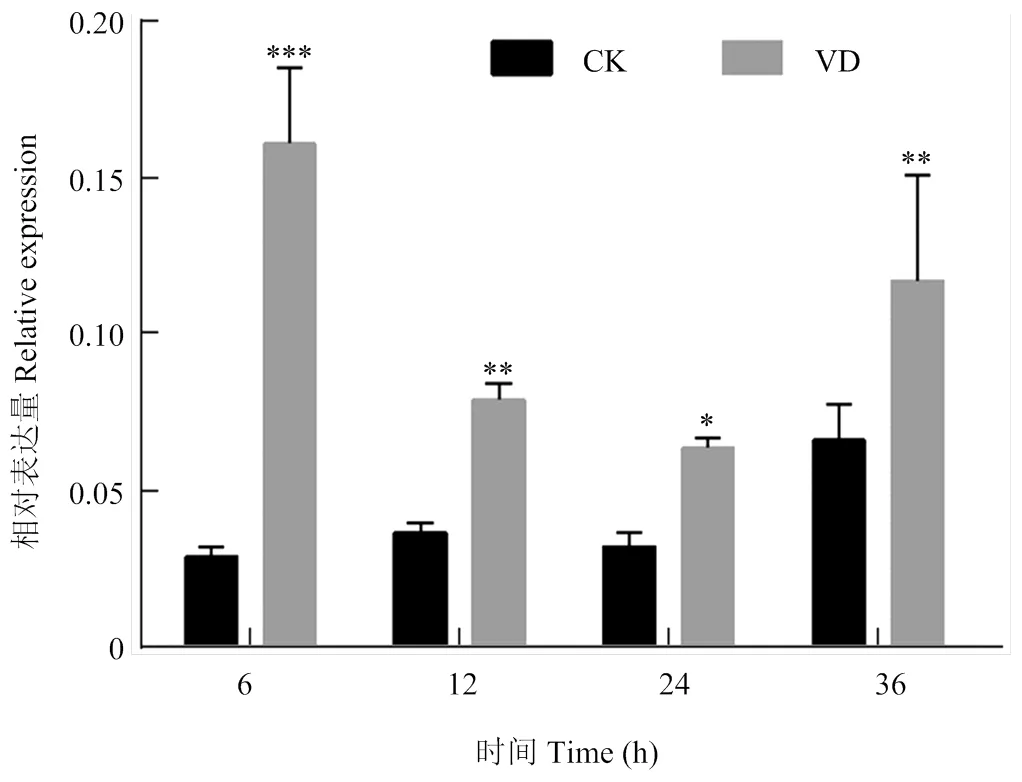
VD:大丽轮枝菌处理组;CK:对照组;*表示差异在P<0.05水平上具有显著性;**表示差异在P<0.01水平上具有显著性。下同
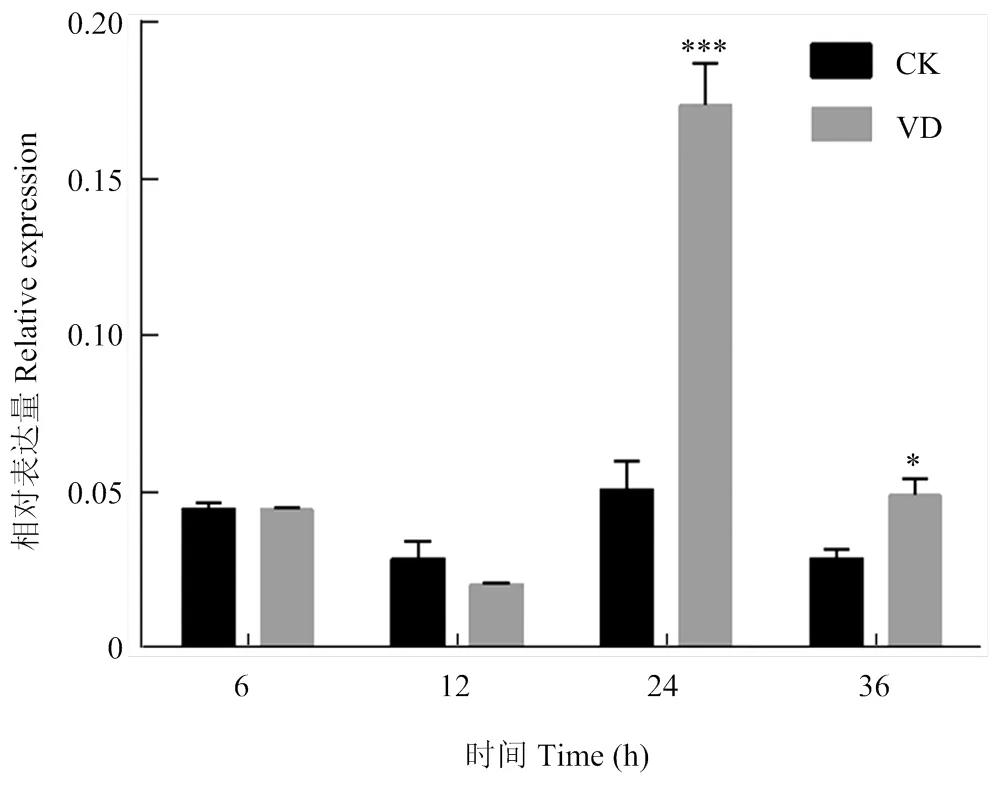
VD:大丽轮枝菌处理组;CK:对照组
2.6 沉默CRVW显著降低棉花黄萎病抗性
对尚未长出真叶的棉苗进行VIGS处理,以沉默(cloroplastos alterados 1)作为技术对照。在VIGS操作7 d后,发生沉默并表现为新生真叶白化(图7-A),表明技术体系成功建立。同时对沉默情况通过qRT-PCR确认,并进行黄萎病菌胁迫处理。在接菌处理20 d后,野生(wild type,WT)组(既无VIGS处理也未接菌)生长正常;CK组(VIGS处理中注射pTRV2空载体,同时接菌处理)表现为叶片黄化和植株萎蔫;沉默组(注射携带序列片段的pTRV2载体,同时接菌处理)表现出比CK组更明显的黄化、萎蔫和落叶等黄萎病病症(图7-B)。病指统计分析显示,沉默组病指显著高于CK组(图7-C),进一步表明沉默显著降低了棉苗对黄萎病菌的抗性。
2.7 沉默CRVW导致SA合成和信号通路相关基因表达显著降低
在黄萎病菌侵染后的12和24 hpi,对照棉苗中SA含量显著增加(与0 hpi对照相比)。而对于被沉默的棉苗,其体内SA含量仅在12 hpi显著增加(与0 hpi沉默棉苗相比)。与对照相比,在0、12和24 hpi 3个时间点,沉默棉苗中SA含量均出现显著降低(图8),约为对照的1/2。为进一步确认是否参与SA信号通路,对与SA合成和信号通路相关的5个标志基因进行表达检测。结果显示,(isochorismate synthase 1)、(enhanced disease susceptibility 1)(phytoalexin deficient 4)(nonexpresser of PR gene 1)和(pathogenesis-related protein 1)在沉默组中的表达均显著降低,特别是在12 hpi,这些基因在沉默组中的表达比对照降低得最为明显(图9)。以上结果表明的沉默能够显著影响SA的积累,降低SA信号通路相关基因的表达。
3 讨论
3.1 CRVW是潜在重要的棉花抗黄萎病基因
高通量转录组测序(RNA-seq)技术为棉花抗病基因挖掘提供了新的平台。应用该技术,大量潜在的与黄萎病菌胁迫相关的棉花基因被发现[11,18,28]。棉花基因组测序的完成更是为克隆这些基因提供了极大地便利[12],使得鉴定这些基因功能成为科研工作者重要的研究内容。最初,河北农业大学棉花品种创新与产业化团队从棉花受黄萎病菌胁迫处理后的RNA-aeq数据中发现,为一个差异表达基因,但无功能注释[11,18]。本研究通过qRT-PCR对该基因的表达进行了分析,确认受黄萎病菌诱导后显著上调表达,且其在抗病品种中表达变化早于感病品种(图5和图6),表明参与棉花和黄萎病菌间的互作。通过VIGS技术对进行沉默,发现棉花对黄萎病的抗性显著降低(图7),进一步证明参与棉花对黄萎病菌的抗病过程。本研究虽然成功克隆了(图1),但其编码蛋白无明显的功能域。因此,目前还无法通过生物信息学对其进行注释。亚细胞定位和组织表达特异性分析明确了CRVW在棉花组织中的分布(图2和图3),为进一步注释其生理生化功能提供了依据。
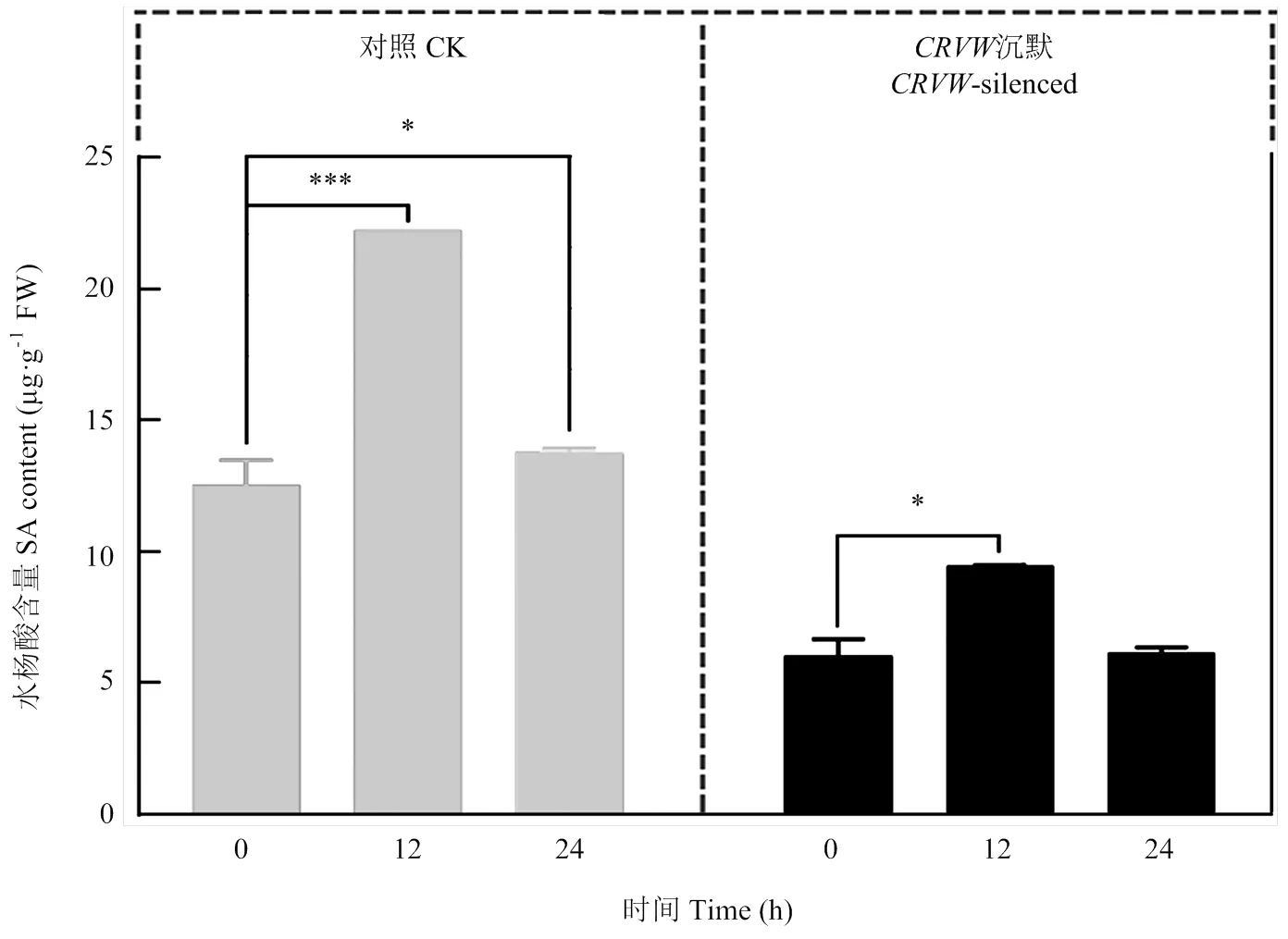
图8 黄萎病菌侵染后棉苗体内水杨酸的积累

图9 黄萎病菌胁迫后SA合成和信号通路相关基因在对照和CRVW沉默棉苗中的表达分析
3.2 CRVW通过SA信号通路参与棉花对黄萎病菌的抗性
植物抵御病原菌侵染是一个复杂的免疫过程,激素是调控该过程的重要信号分子[29]。在已知的植物激素中,SA、茉莉酸(jasmonic acid,JA)和ET是参与免疫反应最为核心的成员[29]。在中存在与ET、SA、auxin和ABA等激素信号响应相关的的顺式作用元件(表1),表明可能通过以上4种激素信号通路参与棉花的生长发育和抗逆反应。棉花被黄萎病菌侵染后,体内SA会发生显著积累[11]。SA信号通路上的标志性基因发生沉默后,棉花对黄萎病的抗性也会显著降低[11],表明SA在棉花抗黄萎病过程中发挥重要的调控功能。病原菌诱导的SA合成主要经异分支酸合酶(isochorismate synthase,ICS)途径,发生在叶绿体中[30]。另外,与SA积累相关的重要标志基因有和[31]。是SA信号通路的重要调节基因。NPR1接收到SA信号后会由多聚体(oligomer)变为单体(monomer),从胞质进入细胞核,与TGA(TGACG motif-binding factor)互作,进而调节相关抗病基因的表达,特别是病程相关蛋白PR1的积累[32]。本研究检测了SA诱导后的表达情况,发现SA能够诱导显著上调表达(图4)。沉默后,棉苗体内SA含量显著降低(图8),、、、和等5个与SA积累和信号调控相关的标志基因均发生了显著下调表达(图9)。据此,推测可能通过SA信号通路参与棉花对黄萎病菌的抗性。
3.3 植物未知功能基因研究展望
目前,在蛋白家族数据库(Pfam)中未知功能结构域蛋白家族约占26.5%[33],意味着在植物界存在数量巨大的未知功能基因。大量组学数据分析都表明,这些未知功能基因在植物生长发育和逆境胁迫过程中发挥重要作用。因此,对这些基因功能的研究将有助于在全新层面上透彻地了解生物体复杂的生命活动机制[34]。本文对进行了表达模式分析,并证明其参与了棉花对黄萎病胁迫的响应,但其具体的调控机制还需深入研究。为进一步完善的功能注释,解析CRVW蛋白三维构象、寻找其互作蛋白、明确其参与的信号通路等都将是未来重要的研究内容。
4 结论
棉花CRVW无明显结构域,且无生理生化功能注释。CRVW定位于细胞质和细胞膜,主要在棉花根部表达;可能通过SA信号通路参与棉花抗黄萎病,是一个潜在重要的抗病基因。
[1] 马存, 简桂良, 郑传临. 中国棉花抗枯、黄萎病育种50年. 中国农业科学, 2002, 35(5): 508-513.
MA C, JIAN G L, ZHENG C L. The advances in cotton breeding resistance to fusarium and Verticillium wilts in China during past fifty years., 2002, 35(5): 508-513. (in Chinese)
[2] KLOSTERMAN S J, ATALLAH Z K, VALLAD G E, SUBBARAO K V. Diversity, pathogenicity, and management of Verticillium species., 2009, 47: 39-62.
[3] XU L, ZHU L F, TU L L, LIU L L, YUAN D J, JIN L, LONG L, ZHANG X L. Lignin metabolism has a central role in the resistance of cotton to the wilt fungusas revealed by RNA-Seq-dependent transcriptional analysis and histochemistry., 2011, 62(15): 5607-5621.
[4] FRADIN E F, THOMMA B P. Physiology and molecular aspects of Verticillium wilt diseases caused byand., 2006, 7(2): 71-86.
[5] 潘家驹, 张天真, 蒯本科, 郭小平, 王谥. 棉花黄萎病抗性遗传研究. 南京农业大学学报, 1994, 17(3): 8-18.
PAN J J, ZHANG T Z, JING B K, GUO X P, WANG S. Studies on the inheritance of resistance toin cotton., 1994, 17(3): 8-18. (in Chinese)
[6] LIU N N, SUN Y, PEI Y K, ZHANG X Y, WANG P, LI X C, LI F G, HOU Y X. A pectin methylesterase inhibitor enhances resistance to Verticillium wilt., 2018, 176(3): 2202-2220.
[7] HU Q, MIN L, YANG X Y, JIN S X, ZHANG L, LI Y Y, MA Y Z, QI X W, LI D Q, LIU H B, LINDSEY K, ZHU L F, ZHANG X L. Laccase GhLac1 modulates broad-spectrum biotic stress tolerance via manipulating phenylpropanoid pathway and jasmonic acid synthesis., 2018, 176(2): 1808-1823.
[8] ZHANG Y, WU L Z, WANG X F, CHEN B, ZHAO J, CHEN J, LI Z K, YANG J, WU L Q, WU J H, ZHANG G Y, MA Z Y. The cotton laccase gene GhLAC15 enhances Verticillium wilt resistance via an increase in defence-induced lignification and lignin components in the cell walls of plants., 2019, 20(3), 309-322.
[9] YANG J, ZHANG Y, WANG X F, WANG W Q, LI Z K, WU J H, WANG G N, WU L Q, ZHANG G Y, MA Z Y. HyPRP1 performs a role in negatively regulating cotton resistance tovia the thickening of cell walls and ROS accumulation., 2018, 18(1): 339.
[10] MO H J, WANG X F, ZHANG Y, ZHANG G Y, ZHANG J F, MA Z Y. Cotton polyamine oxidase is required for spermine and camalexin signalling in the defence response to., 2015, 83(6): 962-975.
[11] ZHANG Y, WANG X F, RONG W, YANG J, LI Z K, WU L Q, ZHANG G Y, MA Z Y. Histochemical analyses reveal that stronger intrinsic defenses inthan inare associated with resistance to., 2017, 30(12): 984-996.
[12] ZHANG T Z, HU Y, JIANG W K, FANG L, GUAN X Y, CHEN J D, ZHANG J B, SASKI C A, SCHEFFLER B E, STELLY D M, HULSE-KEMP A M, WAN Q, LIU B L, LIU C X, WANG S, PAN M Q, WANG Y K, WANG D W, YE W X, CHANG L J, ZHANG W P, SONG Q X, KIRKBRIDE R C, CHEN X Y, DENNIS E, LLEWELLYN D J, PETERSON D G, THAXTON P, JONES D C, WANG Q, XU X Y, ZHANG H, WU H T, ZHOU L, MEI G F, CHEN S Q, TIAN Y, XIANG D, LI X H, DING J, ZUO Q Y, TAO L N, LIU Y C, LI J, LIN Y, HUI Y Y, CAO Z S, CAI C P, ZHU X F, JIANG Z, ZHOU B L, GUO W Z, LI R Q, CHEN Z J. Sequencing of allotetraploid cotton (L. acc. TM-1) provides a resource for fiber improvement., 2015, 33(5): 531-537.
[13] LIU Y, SCHIFF M, MARATHE R, DINESH-KUMAR S P. Tobacco Rar1, EDS1 and NPR1/NIM1 like genes are required for N-mediated resistance to tobacco mosaic virus., 2002, 30(4): 415-429.
[14] 姚丹青, 张微微, 原丽华, 潘俊松, 何欢乐, 蔡润. VIGS: 植物功能基因组学研究的革命. 分子植物育种, 2009, 7(1): 155-161.
YAO D Q, ZHANG W W, YUAN L H, PAN J S, HE H L, CAI R. VIGS: the revolution of plant function genomics research., 2009, 7(1): 155-161. (in Chinese)
[15] GAO X Q, WHEELER T, LI Z, KENERLEY C M, HE P, SHAN L B. Silencingandcompromises cotton resistance to Verticillium wilt., 2011, 66(2): 293-305.
[16] GAO W, LONG L, ZHU L F, XU L, GAO W H, SUN L Q, LIU L L, ZHANG X L. Proteomic and virus-induced gene silencing (VIGS) analyses reveal that gossypol, brassinosteroids, and jasmonic acid contribute to the resistance of cotton to., 2013, 12(12): 3690-3703.
[17] MA Z Y, HE S P, WANG X F, SUN J, ZHANG Y, ZHANG G, WU L, LI Z, LIU Z, SUN G, YAN Y, JIA Y, YANG J, PAN Z, GU Q, LI X, SUN Z, DAI P, LIU Z, GONG W, WU J, WANG M, LIU H, FENG K, KE H, WANG J, LAN H, WANG G, PENG J, WANG N, WANG L, PANG B, PENG Z, LI R, TIAN S, DU X. Resequencing a core collection of upland cotton identifies genomic variation and loci influencing fiber quality and yield., 2018, 50(6): 803-813.
[18] ZHANG Y, WANG X F, DING Z G, MA Q, ZHANG G R, ZHANG S L, LI Z K, WU L Q, ZHANG G Y, MA Z Y. Transcriptome profiling ofinoculated withprovides a resource for cotton improvement., 2013, 14: 637.
[19] 王国宁, 赵贵元, 岳晓伟, 李志坤, 张艳, 张桂寅, 吴立强, 王省芬, 马峙英. 河北省棉花黄萎病菌致病性与ISSR遗传分化. 棉花学报, 2012, 24(4): 348-357.
WANG G N, ZHAO G Y, YUE X W, LI Z K, ZHANG Y, ZHANG G Y, WU L Q, WANG X F, MA Z Y. Pathogenicity and ISSR genetic differentiation ofisolates from cotton growing areas of Hebei province. Cotton Science, 2012, 24(4): 348-357. (in Chinese)
[20] 吴立柱, 王省芬, 李喜焕, 马峙英. 通用型植物表达载体pCamE的构建及功能验证. 农业生物技术学报, 2014, 22(6): 661-671.
WU L Z, WANG X F, LI X H, MA Z Y. Construction and function identification of universal plant expression vector pCamE., 2014, 22(6): 661-671. (in Chinese)
[21] YANG J, JI L L, WANG X F, ZHANG Y, WU L Q, YANG Y, MA Z Y. Overexpression of 3-deoxy-7-phosphoheptulonate synthase gene fromenhancesresistance to Verticillium wilt., 2015, 34(8): 1429-1441.
[22] ARTICO S, NARDELI S M, BRILHANTE O, GROSSI-DE-SA M F, ALVES-FERREIRA M. Identification and evaluation of new reference genes infor accurate normalization of real-time quantitative RT-PCR data., 2010, 10: 49.
[23] SUN L Q, ZHU L F, XU L, YUAN D J, MIN L, ZHANG X L. Cotton cytochrome P450 CYP82D regulates systemic cell death by modulating the octadecanoid pathway., 2014, 5: 5372.
[24] 马峙英, 王省芬, 张桂寅, 李兴红, 刘叔倩, 吴立强, 刘占国, 孙济中, 刘金兰. 河北省棉花黄萎病菌致病性的研究. 棉花学报, 1997, 9(1): 15-20.
MA Z y, Wang X f, Zhang G y, LI X H, LIU S J, WU L Q, LIU Z G, SUN J Z, LIU J L. Study on pathogenicity ofin Hebei Province., 1997, 9(1): 15-20. (in Chinese)
[25] CHEN H, NELSON R S, SHERWOOD J L. Enhanced recovery of transformants ofafter freeze-thaw transformation and drug selection., 1994, 16(4): 664-668, 670.
[26] GAO X Q, BRITT R J, SHAN L B, HE P.-mediated virus-induced gene silencing assay in cotton., 2011(54): e2938.
[27] VERBERNE M C, BROUWER N, DELBIANCO F, LINTHORST H J M, BOL J F, VERPOORTE R. Method for the extraction of the volatile compound salicylic acid from tobacco leaf material., 2002, 13: 45-50.
[28] SUN Q, JIANG H Z, ZHU X Y, WANG W N, HE X H, SHI Y Z, YUAN Y L, DU X M, CAI Y F. Analysis of sea-island cotton and upland cotton in response toinfection by RNA sequencing., 2013, 14: 852.
[29] PIETERSE C M J, LEON-REYES A, VAN DER ENT S, VAN WEES S C M. Networking by small-molecule hormones in plant immunity., 2009, 5(5): 308-316.
[30] WILDERMUTH M C, DEWDNEY J, WU G, AUSUBEL F M. Isochorismate synthase is required to synthesize salicylic acid for plant defence., 2001, 414(6863): 562-565.
[31] ZHENG X Y, ZHOU M, YOO H, PRUNEDAPAZ J L, SPIVEY N W, KAY S A, DONG X. Spatial and temporal regulation of biosynthesis of the plant immune signal salicylic acid., 2015, 112(30): 9166-9173.
[32] YASUOMI T D, STEVEN H S, KAROLINA P M, ZHONG L M, SONG J Q, WANG C, ZUO J R, DONG X N. Plant immunity requires conformational charges of NPR1 via S-nitrosylation and thioredoxins. 2008, 321(5891): 952-956.
[33] PUNTA M, COGGILL P C, EBERHARDT R Y, MISTRY J, TATE J, BOURSNELL C, PANG N, FORSLUND K, CERIC G, CLEMENTS J, HEGER A, HOLM L, SONNHAMMER E L, EDDY S R, BATEMAN A, FINN R D. The Pfam protein families database., 2012, 40(Database issue): D290- D301.
[34] 罗成科, 肖国举, 李明. 不同未知功能结构域蛋白家族(DUFs)基因在植物中的生物学功能. 植物生理学报, 2015, 51(2): 153-158.
LUO C K, XIAO G J, LI M. Biological functions of different domains of unknown function protein families (DUFs) genes in plants., 2015, 51(2): 153-158. (in Chinese)
Cloning and Functional Characterization of GeneInvolved in Cotton Resistance to Verticillium Wilt
WANG QiuYing, WANG WeiQiao, ZHANG Yan, WANG GuoNing, WU LiQiang, ZHANG GuiYin, MA ZhiYing, YANG Jun, WANG XingFen
(College of Agronomy, Hebei Agricultural University/North China Key Laboratory for Crop Germplasm Resources, Ministry of Education, Baoding 071001, Hebei)
【】Verticillium wilt is an important disease in cotton production, and it seriously affects the yield and quality of cotton. Genome sequences ofprovide valuable information resources for searching for resistance genes. In this study, an uncharacterized gene, designed as(cotton resistance to Verticillium wilt), was cloned and identified for disease resistance. The results will lay a foundation for upgrading cotton genomic information, further studying the resistance mechanism and molecular breeding. 【】 The open reading frame (ORF) ofwas cloned from upland cotton cultivar ND601 using the primers, which were designed according to the reference genome sequence. The online software ProtParam was used to predict protein properties, including amino acid composition, molecular weight, the theoretic isoelectric point, instability index and grand average of hydropathicity. PSIPRED v3.3 was used to predict the protein secondary structure. The prediction of protein subcellular localization and-acting elements in the promoter was performed using ProtComp v. 9.0 and PlantCARE, respectively. To elucidate the subcellular localization of the CRVW protein, the CRVW-GFP fusion construct was transformed into onion epidermal cells by particle bombardment. qRT-PCR was performed using normal cotton tissues and tissues that were treated with exogenous application of salicylic acid (SA) andstress. The function ofinvolving in cotton resistance towas further verified by the technology of virus-induced gene silencing (VIGS). To preliminarily analyze the disease resistance pathway mediated by, the expression of some marker genes related to plant disease resistance was assayed in-silenced plants.【】A 780 bp ORF ofwas successfully cloned fromND601.encodes a putative protein of 259 amino acids with a molecular mass of 30.2 kD and an isoelectric point of 9.59. The protein secondary structure of CRVW contains 69.50% random coil, 17.76% α-helical, 11.20% extension and 1.54% β-sheet. By bioinformatics prediction and fluorescence observation, we found that CRVW was mainly located in the cell membrane and cytoplasm.was expressed in the roots, stems and leaves of cotton, but the highest expression occurred in the roots. The upstream sequence ofORF () contains-acting elements in response to four kinds of hormones, including ethylene, SA, auxin and abscisic acid. Additionally,includes a few other elements relating to injury, defense, stress, disease, drought and low temperature. The expression ofwas significantly upregulated in the leaves sprayed with SA. After inoculated with,was dramatically upregulated both in resistant cultivar ND601 and susceptible cultivar CCRI8, but the upregulated expression in susceptible cultivar lagged behind in the resistant cultivar. After 20 days inoculated with,silenced cotton seedlings showed more clearly chlorosis, wilting and defoliating comparing to CK. Further statistical analysis showed thatsilenced cotton seedlings had higher disease index than the CK, suggesting that the silence ofsignificantly reduced the resistance of cotton seedling to. Endogenous SA content insilenced cotton seedlings was significantly lower than in CK. The expression of marker genes related to SA accumulation and signal regulation, including(isochorismate synthase 1),(enhanced disease susceptibility 1),(phytoalexin deficient 4)(nonexpresser of PR gene 1) and(pathogenesis- related protein 1), were significantly down-regulated after silencing.【】CRVW is located in the cytoplasm and the cell membrane, mainly expressed in cotton roots, and involved in the process of cotton resistance to Verticillium wilt, perhaps through SA-mediated defense pathway.
cotton; Verticillium wilt; CRVW; clone; virus-induced gene silencing; resistance
10.3864/j.issn.0578-1752.2019.11.002
2019-01-08;
2019-03-22
河北省自然科学基金(C2016204098)、河北省科技支撑计划(16226307D)
王秋莹,Tel:0312-7528415;E-mail:wangqiuying9308@163.com。通信作者杨君,Tel:0312-7528401;E-mail:yang22181@163.com。通信作者王省芬,Tel:0312-7528401;E-mail:cotton@mail.hebau.edu.cn
(责任编辑 李莉)

