异柠檬酸脱氢酶1基因R132H突变与胶质瘤相关性癫痫患者术后痫性再发的关系
曾凡涛 王新军 杨卓 王修成 袁小威
郑州大学第五附属医院神经外科(郑州450052)
胶质瘤是常见的神经系统肿瘤,常导致癫痫 的发生[1]。胶质瘤相关性癫痫患者不仅需要手术切除胶质瘤,还需手术切除瘤周致痫灶以控制癫痫发作[2]。尽管手术治疗在病灶及肿瘤致痫灶完全切除的情况下对癫痫有较好的控制,然而术后癫痫可能继续存在,癫痫再发严重影响了患者的恢复和生存质量[3]。与非胶质瘤相关性癫痫相比较,胶质瘤相关性癫痫对抗癫痫药物的反应性较差,预后不良[4]。已有研究表明,异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)基因突变类型中最常见的为R132H 型突变(编码蛋白的氨基酸由精氨酸突变为组氨酸),此种类型突变占所有IDH1 突变类型的90%左右[5]。突变主要存在于Ⅱ、Ⅲ级及继发性胶质母细胞瘤(Ⅳ级)中,且对患者的预后有重要影响[6]。研究[7-10]表明,在Ⅱ~Ⅳ级胶质瘤相关性癫痫患者中,突变与患者术前癫痫发作有密切关联。但该突变与患者术后痫性再发的关系却较少报道。为此,本研究通过免疫组化法检测胶质瘤相关性癫痫患者肿瘤组织中IDH1 R132H 突变情况,并探讨该突变与患者术后痫性再发的关系。
1 资料与方法
1.1 一般资料 选取2012年3月至2017年3月于郑州大学第五附属医院手术治疗的90 例胶质瘤相关性癫痫患者。男49 例,女41 例,年龄21~68岁,平均(50.2 ± 17.5)岁。WHO 分级:Ⅱ级27 例,Ⅲ级18 例,Ⅳ级45 例。颞叶肿瘤35 例,非颞叶肿瘤55 例。入选标准:(1)术前CT/MRI 检查提示颅内占位、术后病理学检查明确诊断为胶质瘤;(2)根据临床症状、脑电图(EEG)、2010年国际抗癫痫联盟(ILAE)标准确诊为癫痫,术中皮层脑电图定位显示癫痫灶与肿瘤部位大致相同;(3)首次接受手术治疗;(4)未接受任何放化疗,但术后均服用1种或1 种以上一线抗癫痫药物治疗。排除标准:(1)精神心理异常者;(2)因颅内感染、颅脑创伤、脑血管疾病及大脑发育异常等可能诱发癫痫发作的病史;(3)术后随访期内因各种并发症死亡的患者。
1.2 资料收集 对患者随访至术后1年,中途无失访患者。根据患者术前病情、术后恢复情况,重新调整患者抗痫药的使用并记录其服药数量。肿瘤累及部位、肿瘤切除范围及术后肿瘤是否复发由CT/MRI 检查获得。对手术切除的标本行常规石蜡包埋等处理。入选标本及相关临床信息均已获患者家属及医院伦理委员会同意。
1.3 主要试剂与仪器 mIDH1 R132H 单克隆抗体型号1L-226(日本株式会社免疫生物研究所);二抗反应增强液型号PV-9000、二抗增强酶标山羊抗小鼠/兔IgG 聚合物及DAB 显色液型号ZLI-9019(北京中杉金桥生物技术有限公司);荧光显微镜购自日本Nikon 公司。
1.4 IDH1 R132H 突变检测及评判 将包埋标本以3 μm 厚连续切片,置于防脱剂预处理后的载玻片上。滴加mIDH1 R132H 抗体(稀释比为1∶100)于4 ℃冰箱孵育过夜;PBS 缓冲液清洗,后添加反应增强液、增强酶标山羊抗小鼠/兔IgG 复合物,DAB 显色液镜下显色观察;苏木素复染、清水返蓝后中性树胶封片,镜下观察。以PBS 缓冲液代替一抗作对照。肿瘤细胞胞质内有棕黄色或黄褐色颗粒为阳性。由两名病理医师采用双盲法阅片和双评分半定量法进行评分,光镜下随机观察8个高倍镜视野,记录4 个高倍视野(× 400)中染色阳性百分率,以阳性细胞超过10%为IDH1 R132H突变阳性。
1.5 统计学方法 运用生物统计学软件IBM SPSS 25.0 对数据进行处理与分析。对数据行KS 正态性检验,定量资料用表示,两组间定量资料行t检验;计数资料行卡方或Fisher 确切概率法检验;采用Cox 回归模型对术后痫性再发行多因素分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 胶质瘤相关性癫痫患者肿瘤组织IDH1 R132H 突变情况 对90 例患者的肿瘤组织行mIDH1 R132H 突变检测,可见不同程度棕黄色或黄褐色的阳性信号表达(图1),其中突变型32 例,野生型58 例,总体突变率为35.6%。突变型患者平均年龄为(37.1 ± 11.6)岁,野生型为(57.2 ±11.6)岁,两者间比较差异有统计学意义(t=11.547,P<0.001)。突变主要发生在Ⅱ、Ⅲ级胶质瘤中;肿瘤组织病理分型中突变以弥漫性星形细胞瘤和间变性星形细胞瘤居多;此外,该突变在胶质瘤术后复发患者及术后服用较多数量抗癫痫药患者中所占比例大,且差异均有统计学意义(P<0.05),见表1。
2.2 胶质瘤相关性癫痫患者术后癫痫再发的相关因素分析 对所有患者随访至术后1年,对其行Engle 分级评分,以此作为术后癫痫有无再发的分组依据,将EngleⅠ级视为术后癫痫未发作,其余视为癫痫再发。其中,痫性再发38 例,痫性未发52 例,再发率42.2%(38/90)。未发组中突变率为15.4%,再发组中突变率为63.2%,两者间差异有统计学意义(χ2=21.869,P<0.001)。对术后癫痫再发行单因素分析,结果显示肿瘤组织WHO 分级、肿瘤位于颞叶、肿瘤及致痫灶镜下全切、肿瘤术后复发、患者术后服用抗痫药数量以及IDH1 R132H突变与术后痫性再发有关(P<0.05),见表2。将上述因素纳入Cox 回归模型中行多因素分析显示:肿瘤位于颞叶、肿瘤术后复发以及IDH1 R132H 突变是患者术后痫性再发的独立危险因素,而肿瘤及致痫灶镜下全切则为其独立保护因素,见表3。
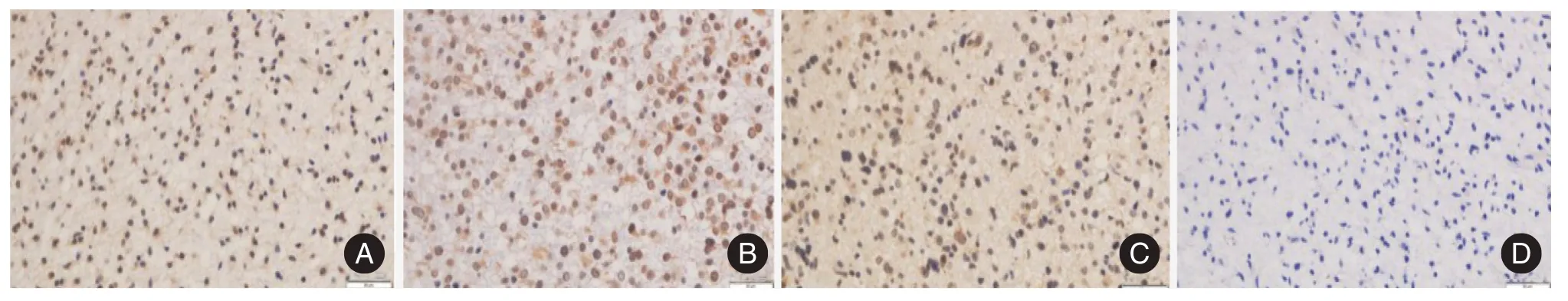
图1 胶质瘤组织中IDH1 R132H 型突变的表达(×400)Fig.1 Expression of IDH1 R132H type mutation in glioma tissues(×400)
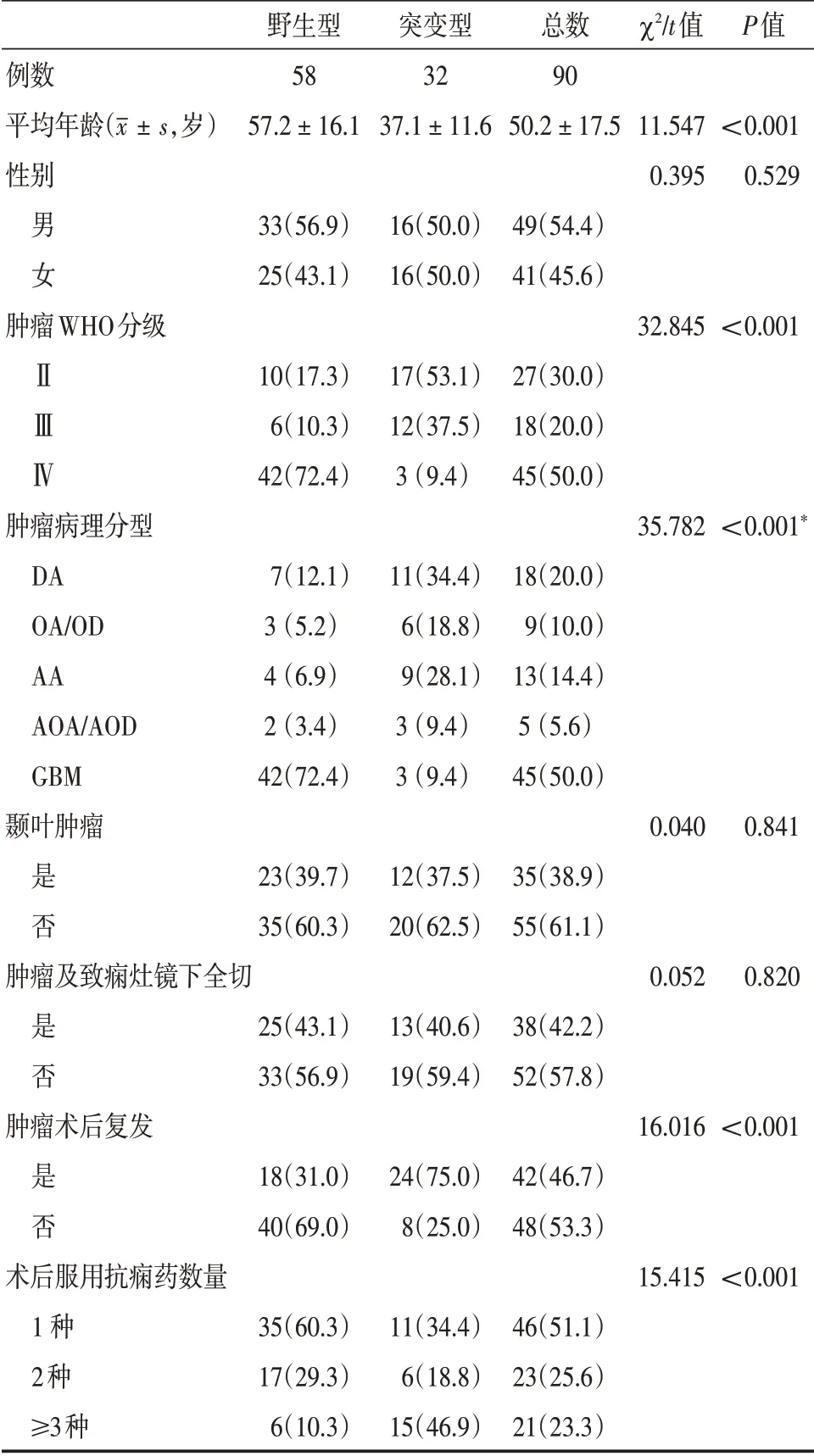
表1 患者基本临床特征及IDH1 R132H 突变情况Tab.1 Basic clinical characteristics of patients and IDH1 R132H mutation 例(%)
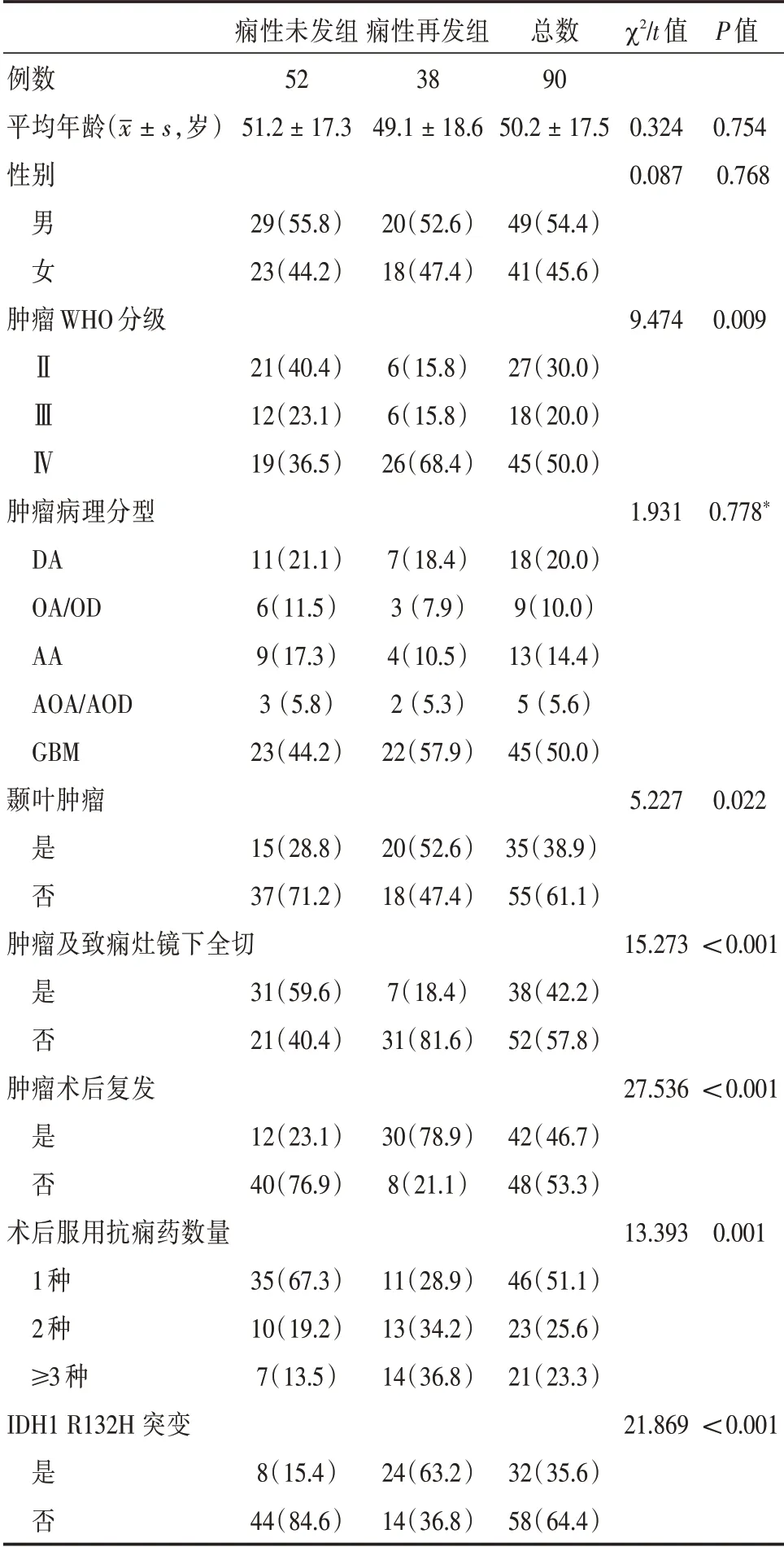
表2 影响患者术后1年内痫性再发的单因素分析Tab.2 Univariate analysis of patients with epileptic recurrence within 1 year after surgery 例(%)
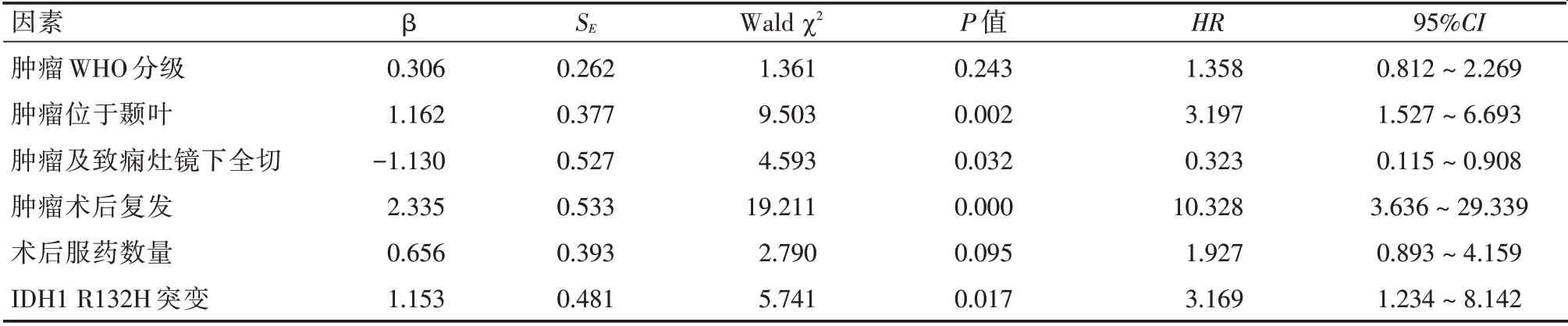
表3 影响患者术后1年内痫性再发的Cox 多因素回归分析Tab.3 Cox multivariate regression analysis of patients with epileptic recurrence within 1 year after surgery
3 讨论
本研究显示胶质瘤相关性癫痫患者肿瘤组织中IDH1 R132H 突变率为35.6%,且突变型患者平均年龄较野生型小;突变主要发生在Ⅱ、Ⅲ级胶质瘤中,分别为63.0%(17/27)和66.7%(12/18);不同组织病理分型中突变也存有一定的差异性,以弥漫性星形细胞瘤和间变性星形细胞瘤居多。以上研究结果与先前国内外研究报道基本相一致[8,11]。术后肿瘤复发患者突变概率较大,达57.1%(24/42)。可能的原因是IDH1 R132H 突变型胶质瘤血管内皮生长因子(VEGF)含量较高,而该突变破坏其本身亲和力,与底物结合能力减弱的同时也与IDH1 野生型竞争底物,阻断IDH1 活性,最终促使肿瘤复发和增殖[12]。此外,突变在患者术后服用抗癫痫药数量间也存有明显差异,服用抗痫药数量≥3 种的患者肿瘤组织IDH1 R132H突变较高,这与国外研究[13]结论相一致。据此笔者推测突变促使肿瘤复发和增殖,而胶质瘤的增殖可能形成癫痫病灶复合体[14],引发脑组织异常放电,导致术后癫痫频繁发作,从而需服用较多数量(≥3 种)的抗痫药物对癫痫进行控制。
已有研究表明[15],大约有86%的患者癫痫再发于术后1年内,且易形成难治性癫痫,因此本研究选择对患者随访至术后1年。有研究[16-17]显示肿瘤位于颞叶及肿瘤术后复发是影响患者术后痫性再发的独立危险因素,本组研究结论与其相一致。肿瘤及致痫灶镜下全切则为其独立保护因素,这也与已有的研究[2]结论相符合。本研究显示IDH1 R132H 突变为患者术后痫性再发的独立危险因素。在目前少量已报道的文献中,国内有学者对低级别胶质瘤患者中IDH1 突变与术后6 个月内痫性再发的关系进行了研究,结果显示IDH1突变对患者术后痫性再发无影响[18],这与本研究结论相反。笔者推测胶质瘤中IDH1 R132H 突变有可能是在患者手术半年后对癫痫再发产生了重要影响,也有可能仅仅是IDH1 R132H 型突变对患者术后痫性再发产生了影响,而其他类型突变则对其无影响,这都需要本研究组后期做进一步的研究加以验证。国外也有学者对胶质瘤IDH1 R132H 突变与术后癫痫再发频率间的关系进行了研究,结果显示术后1年内该突变在痫性未发作患者及痫性发作频率较高患者(平均>1 次/月)间差异有统计学意义,术后痫性发作频率较高的肿瘤患者(平均>1 次/月)IDH1 R132H 突变率较高,且该突变是其独立危险因素[13],本研究所得结论与其有相似之处。到目前为止,有关胶质瘤中IDH1 R132H 突变的潜在致痫机制现已有一定的研究,可能的原因是IDH1 突变细胞产生2-羟基戊二酸(D2-HG)[19],D2-HG 在结构上与谷氨酸相似且能激活N-甲基-D-天冬氨酸(NMDA)受体[20],从而导致了术后癫痫再发。此外,外源性D2-HG 将培养的大鼠神经元放电率提高了4~6 倍,而D2-HG 的这种兴奋作用能选择性被NMDA 受体拮抗剂完全阻断[8],同时也揭示D2-HG 可能对瘤周组织具有重要致痫作用,这将为胶质瘤相关性癫痫患者手术切除瘤周组织进一步提供理论依据。
本组研究中经Cox 多因素回归分析显示,患者术后服用抗痫药的数量、不同肿瘤组织WHO 分级对患者术后1年内痫性再发的差异无统计学意义,为其混杂因素,这与已有研究结论[13,21]分别相一致。表1中显示胶质瘤IDH1 R132H 突变与以上两者有一定关联,据此笔者推测患者术后服用抗痫药的数量和不同肿瘤组织WHO 分级有可能是通过IDH1 R132H 突变间接对患者术后痫性再发产生了一定影响,但这需要后续更多的研究来证实。
综上所述,本研究分析了胶质瘤相关性癫痫患者肿瘤组织IDH1 R132H 突变及其对患者术后1年内痫性再发的影响,对该突变的潜在致痫作用有了进一步的了解。随访时间偏短及样本量有限是本研究的不足之处,后续将继续收集病例,延长随访时间,通过基因测序法进一步论证IDH1 突变对患者术后不同时间段内癫痫再发的影响。

