合肥市女性人乳头瘤病毒感染亚型分布及其与宫颈病变的相关性
高文捷 高冬梅 余小琴 徐元宏
1 安徽医科大学第一附属医院(合肥230022);2合肥市第一人民医院(合肥230061)
宫颈癌是全世界女性中最常见的恶性肿瘤之一,位居第四位,是导致女性死亡的重要疾病,世界卫生组织(WHO)数据显示[1],2015年全球约有27.9 万女性死于宫颈癌。相关报道表明[2-3],80%~85%的宫颈癌死亡发生在发展中国家,而作为发展中国家之一,中国宫颈癌的发病率和病死率呈上升趋势,2015年我国宫颈癌新发病例达9.89 万,死亡病例数达3.05 万。大量的流行病学和分子生物学研究表明,持续高危的人乳头瘤病毒(human papillomavirus,HPV)感染是宫颈癌及其癌前病变最主要的致病因素[4-5]。HPV 是一种无包膜病毒,由大约8 000 个碱基对组成的双链环状DNA 和正二十面体的蛋白质衣壳组成。它可以感染人类的表皮和黏膜上皮细胞,引起各种良性和恶性肿瘤。目前已经分离鉴定的HPV 亚型约有200 种,超过40 种与人类的泌尿生殖系统感染相关,其中许多型别与宫颈病变的发生密切相关。HPV 在全球范围内的感染具有普遍性,不同国家及地区的感染率及亚型分布不尽相同[6-7]。本文分析了合肥地区妇科患者HPV 亚型及其与宫颈病变的相关性,以了解本地区HPV 感染的现状,为本地区宫颈癌前筛查和预防提供临床及病理资料,进而为HPV 感染所致宫颈病变的防治提供更加科学的理论依据。
1 对象与方法
1.1 研究对象 2017年1月至2018年7月在合肥市第一人民医院妇科及相关科室就诊的患者,年龄17 ~71 岁,平均39.5 岁。筛选及排除标准:患者就诊时有不同程度的阴道分泌物增多、阴道不规则流血、宫颈慢性炎症等症状,但排除宫颈锥切和子宫次全切除术等患者。该项研究对2 535例患者进行了HPV-DNA 分型检测,同时行宫颈病理组织活检的患者共计230 例,并以病理结果作为诊断的金标准。本研究符合人体试验伦理学标准,并通过医院伦理委员会的批准。
1.2 标本采集
1.2.1 样本采集 HPV 检测样本由临床医生采集,所有患者采集前3 d 均无性交及阴道用药史,非月经期。宫颈刷插入患者的子宫颈旋转3 ~5 周,然后将刷头放入细胞保存液中送检。
1.2.2 病理活检 宫颈病理组织活检标本由阴道镜医师对可疑病变部位消毒后用活检钳咬取一定量标本送病理检查。对宫颈细胞学为高级别鳞状上皮内病变(HSIL),或图像不充分,或怀疑有颈管病变,或病变向颈管内延伸者,刮取宫颈管内膜和黏液送病理检查。若未观察到异常,则常规取移行带第3、6、9、12点4处送检。
1.3 检测方法与判断标准
1.3.1 HPV-DNA 分型检测 采用PCR 反向点杂交技术,其原理是针对HPV 基因组晚期区LI 区设计特异引物和28 型探针,PCR 产物和条带上的特异性探针杂交。通过杂交和洗膜,将靶标中的特异性片段会和特异性探针结合,最后进行显色和结果分析,以检测HPV 的基因型。本方法一次可检测28 种型别的基因型,其中高危型15 种(16、18、31、33、35、39、41、51、52、56、58、59、68、73、82),疑似高危型3 种(26、53、66),低危型10 种。
1.3.2 检测结果判断标准 两个质控点显示阳性,其他均为阴性则判读为阴性;两质控点显示阳性,其余点≥1 个则判读为阳性,同时根据HPV 亚型分布图判断HPV 的型别。
1.4 病理活检 送检标本经常规的病理制片、HE染色、盲法阅片做出诊断。其结果可分为:(1)宫颈良性病变(炎症或息肉);(2)低级别鳞状上皮内病变(LSIL),主要包括轻度不典型增生(CIN1)和HPV 感染引起的细胞学改变;(3)HSIL,主要包括中度不典型增生(CIN2)和重度不典型增生(CIN3);(4)鳞癌(SCC)。LSIL 及以上判定为病理组织学阳性,并以此为金标准。
1.5 统计学方法 运用SPSS 19.0 统计软件进行分析,组间率的差异运用卡方检验进行比较,P<0.05 表示差异有统计学意义。
2 结果
2.1 HPV 感染类型和感染型别分布情况 纳入研究的2 535 例患者中,筛查结果为阳性的共734 例,HPV 感染率为29.0%,28 种型别均有检出,检出率位居前五位的基因型别依次为HPV16、HPV52、HPV58、HPV53 和HPV33。单一感染514 例,占感染总数的70.0%;多重感染者220 例,占感染总数的30.0%,最多者检出7 种型别感染同时存在。高危HPV 感染率为22.4%,检出率前五位的基因型别依次为HPV16、HPV52、HPV58、HPV33、HPV51;疑似高危型HPV 感染率为3.3%,检出率最高的为53 型;低危型感染率为9.3%,检出率居前五位的基因型别依次为HPV44、HPV42、HPV81、HPV61、HPV43。高危型的感染率明显高于疑似高危型和低危型,三者比较差异有统计学意义(χ2=37.75,P<0.01)。分析发现,无论是在单一感染还是多重感染患者中,HPV16、HPV58、HPV52 三种型别均排在前三位,见表1。
2.2 HPV 单型别感染和多重感染与宫颈病变的相关性 在2 535 例就诊患者中,按照诊疗指南行阴道镜下组织病理学活检者共计230 例,其中HPV 检测阳性患者149 例,占64.8%;单型别感染者99 例,占43.0%;多重感染者50 例,占21.8%。依据组织病理结果将其分为两组:即良性病变/LSIL 组,共计141 例;HSIL/SCC 组,共计89 例。宫颈良性病变/LSIL 组中HPV 的阳性率为50.4%(71/141),宫颈HSIL/SCC 组HPV 阳性率为87.6%(78/89),两组感染率差异有统计学意义(χ2=33.247,P=0.000)。宫颈良性病变/LSIL 组的单型别HPV 感染率为29.1%(41/141),HSIL/SCC 组的单型别感染率为65.2%(58/89),两组间差异有统计学意义(χ2=28.988,P=0.000)。在宫颈良性病变/LSIL 组中多重HPV 感染比率为21.3%(30/141),HSIL/SCC 组中多重HPV 感染比率为22.4%(20/89),两组间差异无统计学意义(χ2=0.046,P=0.831)。两组间HPV 感染分布情况见表2。
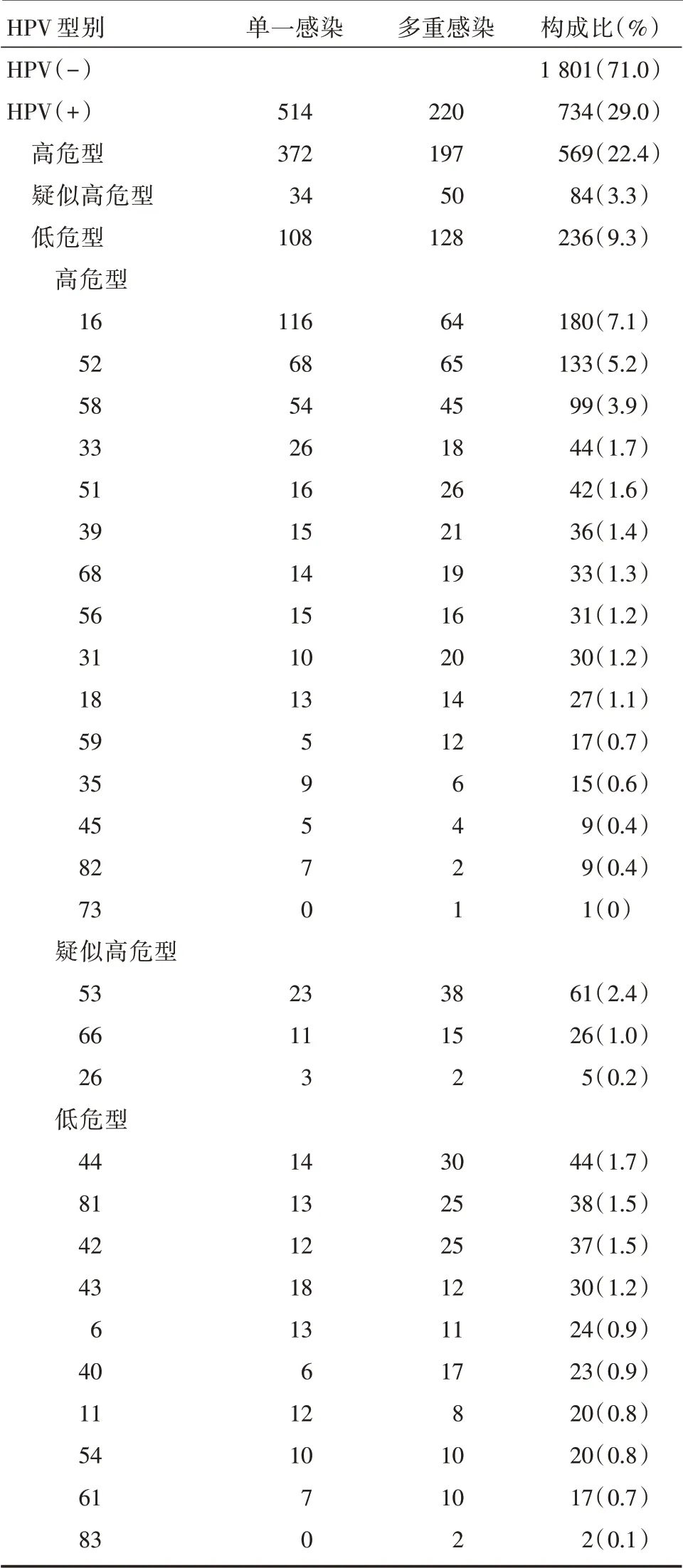
表1 HPV 感染率和感染型别分布Tab.1 Distribution of HPV subtypes and infection rate
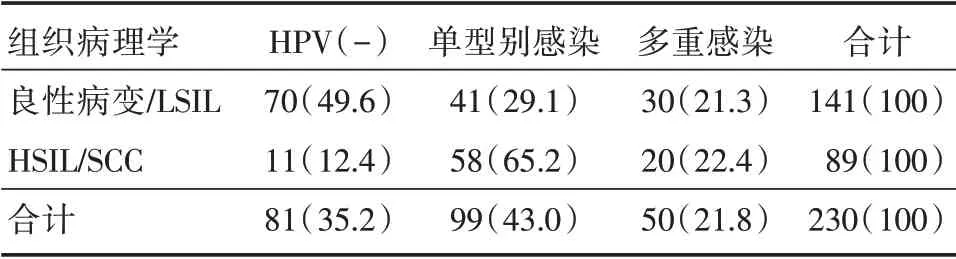
表2 HPV 单型别感染和多重感染与宫颈病变的关系Tab.2 Relationship between HPV infection mode and cervical lesions 例(%)
2.3 HPV 亚型在不同宫颈病变中的分布情况在行组织病理学检查的231 例HPV(+)患者中共检测出24 种亚型,检出率居前五位者依次为HPV16、HPV58、HPV52、HPV33、HPV18,且均为高危型,其在宫颈病变组织的亚型分布情况见表3。HPV16型在LSIL、HSIL及SCC患者中占的比例依次为13.6%、28.7%、83.3%,可以推断,随着宫颈病变程度的加重HPV16 型所占比例随之增高。HSIL/SCC患者分组中,HPV16型占37.5%(42/112)、HPV58 型占11.6%(13/112)、HPV52 型占8.9%(10/112)。分析不同宫颈病变中HPV 亚型的分布情况,HPV16 型与HPV58 型、HPV52 型比较差异均有统计学意义(χ2=3.257、6.917,P<0.05);HPV52型和HPV58 型之间比较差异无统计学意义(χ2=0.529,P=0.467)。
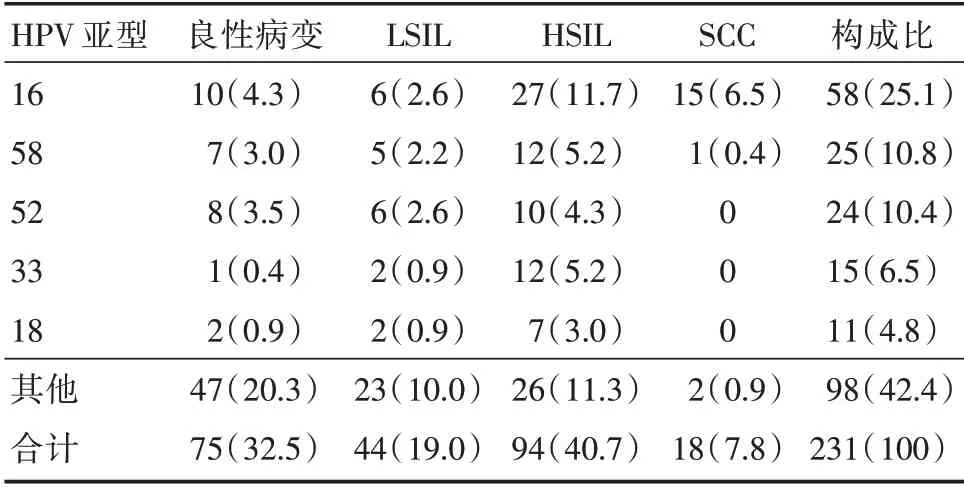
表3 HPV 亚型在不同宫颈病变中的分布Tab.3 Distribution of HPV subtypes in different cervicallesions 例(%)
3 讨论
WHO 关于宫颈癌的诊断标准中明确提出必须有HPV 的感染,宫颈癌患者几乎均能检测到HPV感染的存在[8-9]。约90%的女性在性生活开始后会发生至少一次HPV病毒的感染,但绝大多数患者均为无症状的一过性感染,超过80%的HPV感染病毒可在6 ~24个月内被机体清除掉。2012年美国宫颈癌筛查指南提出,HPV检测可用于未明确意义的不典型鳞状上皮细胞的分流诊断。建议30 ~65 岁的女性每5年选择一次细胞学和HPV 联合检测,HPV基因分型在宫颈癌筛查中的临床价值得到了充分肯定。研究证实,同一型别的HPV持续感染与宫颈上皮内瘤变和宫颈癌的发病率密切相关。
据文献[10]报道,HPV 在亚洲的感染率介于1.6% ~14.2%之间,我国普通妇女的感染率为15.71%。本研究显示合肥地区筛查人群中HPV 的感染率为29.0%,感染率明显高于上述研究。分析其原因可能有以下两点:(1)岑尧等[10]做该项研究时间较早,近两年随着人们经济生活水平的提高,人们对宫颈癌筛查预防认识的不断加深,接受HPV 检测筛查的人数明显增加;(2)该研究的主要对象来自门诊就诊患者,其中大部分患者具有相应的临床症状。本地区感染率高于深圳(2014-2016年:11.02%)、武汉(2014-2015年:17.68%),低于成都(2009-2014年:31.50%)、北京(2010-2012年:36.98%)、上海(2011-2015年:31.84%)等地区的报道[7,11]。究其原因,首先可能是监测的时间段不一致;其次与研究的样本量(深圳:10 624 例;北京31 091 例)、使用试剂及检测方法不同有关。有报道显示[2,7],高危型别在西方国家主要以HPV16、HPV18 型最常见,我国以HPV16、HPV58、HPV52、HPV18 和HPV39 型最为常见,本研究HPV亚型检出率居前五位者依次为HPV16、HPV52、HPV58、HPV53 和HPV33 型,与上述的文献报道并不完全一致。合肥地区最常见的HPV 基因亚型与成都、北京、辽宁、天津、浙江等城市报道相吻合,以HPV16 型最为常见,而深圳、上海、广州、武汉等城市以HPV52 型最为常见[7,11]。HPV 感染型别差异的原因可能与地域相关,我国幅员辽阔,不同地区的人群由于生活方式、气候环境及种族基因易感性的不同,会导致同一个国家不同地区的HPV流行型别稍有差异。值得注意的是,此次研究发现,该地区疑似高危HPV53 型的感染率高于其他几种高危型别,位居第四位,且在宫颈病变的人群中,其感染率位居第六位,远远高于其他几种高危型别。因此HPV53 型是否对宫颈病变的发展以及组织分化发挥作用有待进一步研究。
本研究发现,宫颈上皮内瘤变和宫颈癌患者中均存在较高比例的HPV 感染。宫颈HSIL/SCC组与良性病变/LSIL 组相比,前者的感染率明显高于后者,且在单型别感染模式上前者的感染率亦显著高于后者。以上研究结果印证了HPV 感染与宫颈癌前病变和宫颈癌密切相关,但在多重感染模式上二者比较差异并无统计学意义。研究结果同时揭示,导致宫颈病变的关键因素是感染HPV 的型别而不是病毒型别种类的多少,即并不是感染的型别越多宫颈发生病变的可能性越大。据报道[12],高危型HPV 单一感染可以使宫颈鳞癌的患病风险增加19.9 倍,而多重感染使该风险增加至31.8 倍;当HPV16 与其他型别混合感染时,可大大增加宫颈病变的风险。本研究结果与上述观点不一致,可能是因为研究中未将低危型和高危型分开考虑的原因,也不排除是因为标本量不足而不能体现其中的差别。
通过对不同宫颈病变中感染HPV 亚型的分析得出,HPV16 型在各级别宫颈病变类型中几乎均位居第一位,随着病变程度的加重其感染率也随之升高。在HSIL/SCC组中,HPV16型所占比例明显高于HPV58 型和HPV52 型,由此推测HPV16 型在宫颈高级别上皮内瘤变和宫颈癌的发病中起着至关重要的作用,这与相关研究结论是一致的[5,13]。本研究发现,无论是在普通筛查人群中还是在HSIL/SCC 病变人群中,除了HPV16 型之外,该地区HPV 感染的其他主要型别为HPV58 和HPV52,该结论在中国女性HPV 感染型别分布的相关汇总分析中均被证实[14]。本研究尚存在一些不足:首先该研究局限于单个中心;其次存在样本量相对不足的情况。下一步将利用新技术新方法开展HPV 在宫颈病变中的应用研究,注重多中心的合作,加大样本量,从而使研究结论更具有代表性。
综上所述,发生宫颈病变的关键因素是感染的HPV 型别而不是感染的HPV 亚型的数目。合肥地区普通人群常见的HPV 感染型别依次为HPV16、HPV52、HPV58、HPV53 和HPV33 型,在发生宫颈病变的人群中HPV 感染型别位居前三位的依次是HPV16、HPV58 和HPV52 型,无论普通人群还是宫颈病变患者中HPV16、HPV58 和HPV52 三种型别均占很大比例。目前,宫颈癌最理想且最有效的预防措施是注射HPV 疫苗[15],近年来国内上市的二价疫苗(针对HPV16、18 型)和四价疫苗(针对HPV16、18、6、11 型)都不包括HPV52 和HPV58 型,因此,这两种疫苗的使用不能涵盖该地区常见的HPV 感染类型。近期我国批准的九价HPV 疫苗(针对HPV6、11、16、18、31、33、45、52、58型)覆盖了本地区常见的HPV 感染型别。通过研究分析本地区HPV 流行的主要型别,有助于研制个体化的HPV 预防疫苗,进而提高免疫效果,最终实现降低宫颈癌发病率的目标。期望相关结论能够对合肥地区的宫颈癌防治和疫苗制备提供一定的临床参考价值。

