基于超声波辅助的燕麦多酚提取及稳定性研究*
李佳运 李 楠*
(运城学院生命科学系,山西运城 044000)
燕麦(Avena sativa L.)是禾本科燕麦属一年生草本植物,主要在山西、河北、内蒙古等地种植。近些年,随着人们保健意识的增强,燕麦因其独特的营养和保健功能越来越受到重视。燕麦含有较多的抗氧化物质,如多酚、植酸、维生素E、蒽酰胺等,具有降血压、降血糖、预防心血管疾病等功效。有研究表明,燕麦多酚具有较强的清除DPPH自由基能力,且可以抑制低密度脂蛋白氧化。谷物多酚与蔬菜水果多酚组成不同,两者在体内可以通过协同作用增强生物活性。
近年来对燕麦多酚的分离纯化及其抗氧化活性研究较多,而对燕麦多酚的稳定性研究较少。多酚是分子内含有一个或多个羟基与一个或几个苯环相联的一类植物化合物的总称。燕麦多酚应用于食品加工或贮藏等过程中容易受到温度、pH、光照等影响而降解,抗氧化活性降低。本文以燕麦为原料,采用超声波辅助有机溶剂浸提的方法优化燕麦多酚的提取工艺,并研究燕麦多酚的稳定性,旨在为提高燕麦多酚的提取、稳定性及其开发利用价值提供理论依据和方法参考。
1 材料与方法
1.1 材料与试剂
燕麦,产自山西省朔州市山阴县,经粉碎机粉碎过60 目筛,将燕麦粉与无水石油醚按1∶2 的比例装入磨口三角瓶中,脱脂处理48 h,干燥箱干燥至无结块粉末,备用。
没食子酸,国药集团化学试剂有限公司;无水乙醇、Folin 试剂、碳酸钠、盐酸、氢氧化钠,均为分析纯。
1.2 仪器与设备
UV-5500 PC 型紫外分光光度计,上海元析仪器有限公司;数显式恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;FA 1604 型电子天平,上海舜宇恒平科学仪器有限公司;PHS-3E 型酸度计,上海佑科仪器仪表有限公司;数控超声波清洗器,南京垒君达超声电子设备有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 试验设计
1.3.1 单因素试验
分别选取料液比(1∶10、1∶15、1∶20、1∶25、1∶30)、提取温度(20 ℃、30 ℃、40、50 ℃、60 ℃)、提取时间(10 min、20 min、30 min、40 min、50 min)、乙醇体积浓度(40%、50%、60%、70%、80%)为影响因素进行燕麦多酚的提取,计算得率。
1.3.2 响应面试验
以单因素试验为基础,应用Box-Benhnken 中心组合实验设计,采用3 因素3 水平进行响应面试验。因素水平编码见表1。
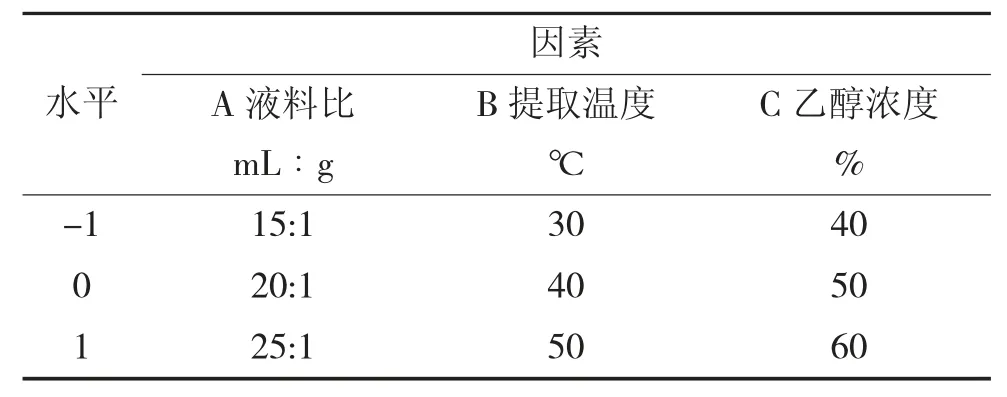
表1 响应面因素水平编码
1.4 多酚含量测定
1.4.1 标准曲线制作
参考王红的方法,采用福林酚法测定多酚含量。分别移取0.0 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL、6.0 mL 浓度为100 μg/mL 的没食子酸溶液于50 mL 棕色容量瓶,加入3 mL 稀释10 倍的Folin 试剂,再加入9 mL 10%Na2CO3溶液,蒸馏水定容,摇匀,避光反应30 min,以蒸馏水做对照,在波长760 nm 处测定吸光值3 次并取平均值。以吸光值为纵坐标,没食子酸质量浓度(μg/mL)为横坐标绘制标准曲线,得回归方程:y=0.048 7x-0.012 1,相关系数R2=0.993 7。
1.4.2 样品多酚含量测定
反应体系中多酚提取液加入量为5 mL,其余步骤和标准曲线一致。样品中多酚含量的计算公式如下:
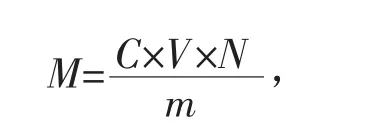
式中:M——多酚含量,μg/g;
V——提取液体积,mL;
C——没食子酸质量浓度,μg/mL;
m——样品质量,g;
N——稀释倍数。
1.5 燕麦多酚的稳定性试验
1.5.1 温度对多酚稳定性的影响
将燕麦多酚提取液分别置于4 ℃、25 ℃、50 ℃、75 ℃、100 ℃下避光恒温处理,每隔1 h 用福林酚法测定多酚含量计算保留率(保留率=处理后的吸光值/处理前的吸光值),比较温度对多酚稳定性的影响。
1.5.2 pH 对多酚稳定性的影响
参考冯婧的方法,并稍作修改。用稀氢氧化钠和稀盐酸调节去离子水pH 分别为3、5、7、9、11,以不同pH 去离子水:多酚提取液=10:1 的比例加入多酚提取液,室温黑暗处理,每隔1 h 测定多酚含量计算保留率,比较不同pH 对多酚稳定性的影响。
1.5.3 光照对多酚稳定性的影响
取2 份相同的多酚提取液,1 份密封室内自然光照处理,1 份密封避光处理,每隔1 h 测定多酚含量计算保留率,研究光照对多酚稳定性的影响。
2 结果与分析
2.1 单因素试验结果
2.1.1 液料比对多酚得率的影响
当提取温度40 ℃,乙醇体积浓度60%,提取时间30 min 时,不同液料比对多酚得率的影响结果见下页图1。
由图1 可知,随着提取溶剂比例的增加,多酚得率增大,当液料比为20∶1 时,增大趋势逐渐趋于平缓,液料比过大会造成原料浪费,还会使碳水化合物、果胶、蛋白质等醇溶性成分溶出。综合考虑生产成本和提取效果,选取液料比为15∶1、20∶1、25∶1 进行响应面试验。
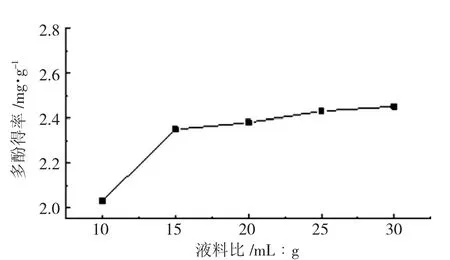
图1 液料比对多酚得率的影响
2.1.2 提取温度对多酚得率的影响
设定液料比20∶1,乙醇体积浓度60%,提取时间30 min,不同提取温度对多酚得率的影响结果见图2。

图2 提取温度对多酚得率的影响
由图2 可知,随着温度的升高,燕麦多酚得率先升高后降低,原因可能是当温度升高,分子间运动增加,溶剂的黏度降低,多酚的渗透、溶解、扩散速率增快,使多酚更易于从燕麦中溶出。当温度达到40 ℃后,蛋白质、维生素等大分子溶出,影响多酚得率,因此,选取提取温度为30 ℃、40 ℃、50 ℃进行响应面试验。
2.1.3 提取时间对多酚得率的影响
当液料比20:1,乙醇体积浓度60%,提取温度40 ℃,不同提取时间对多酚得率的影响结果见图3。
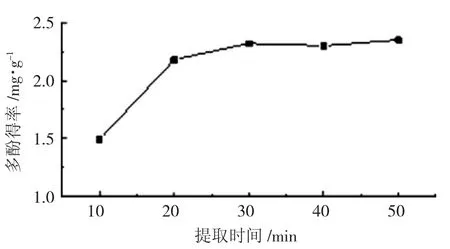
图3 提取时间对多酚得率的影响
由图3 可知,提取前20 min 多酚得率增加较多,超过20 min 上升缓慢,30 min 后逐渐趋于平稳,原因可能是提取30 min 时多酚在提取溶剂中的溶解度已经达到最大值,所以在进行响应面试验时固定提取时间为30 min。
2.1.4 乙醇体积浓度对多酚得率的影响
当液料比20:1,提取时间30 min,提取温度40 ℃,乙醇体积浓度对多酚得率的影响见图4。
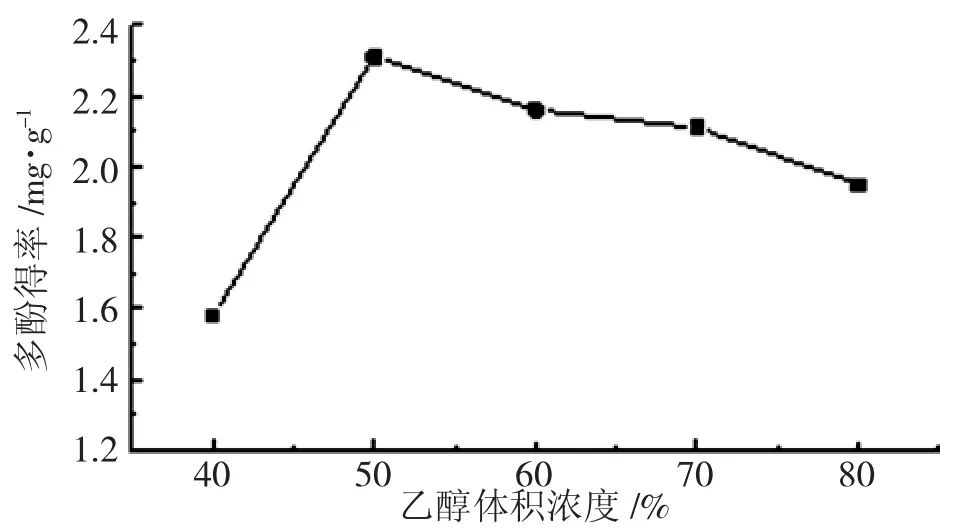
图4 乙醇体积浓度对多酚得率的影响
由图4 可知,得率随乙醇体积浓度的增加先升高后降低,当乙醇体积浓度为50%时,多酚得率为2.31 mg/g。乙醇体积浓度会影响溶剂的极性,从而影响活性物质的溶出能力。适当增加乙醇体积浓度会增高多酚得率,但是过高会破坏氢键,导致多酚得率下降,所以选取乙醇体积浓度为40%、50%、60%进行响应面试验。
2.2 响应面设计及结果分析
在单因素试验基础上进行3 因素3 水平响应面试验。试验设计共17 个试验点,其中12 个析因点,5 个零点,零点位于区域的中心,重复5 次,用以估算试验误差,试验设计及结果见表2。

表2 响应面设计及结果

续表2
用Design-Expert 软件对表2 中数据进行多元回归拟合,得到燕麦多酚得率与液料比A,提取温度B,乙醇体积浓度C 的二次回归方程:Y=48.16 A+0.03 B+0.08 C+0.17 AB-0.24 AC+4.18 ×10-4BC-398.56 A2-7.14×10-4B2-8.34×10-4C2-3.55
由表3 可知,模型的P 值小于0.01,说明模型极显著。校正系数R2=0.978 3,说明多酚得率与3 个影响因子之间的拟合状态良好,多酚得率的变化97.83%是由所选因子影响的,失拟误差(P=0.2594)不显著。3 个因素对多酚得率影响的大小顺序为:提取温度>乙醇体积浓度>液料比。方差分析结果表明,一次项中提取温度B,交互项AC、BC,二次项A2、B2、C2对结果影响极显著;一次项乙醇体积浓度C 和交互项AB 对结果影响显著,其余不显著。
由响应面试验得出的最佳工艺条件为液料比16.39∶1(mL∶g),提取温度45.29 ℃,乙醇体积浓度54%,此时多酚得率预测值为2.341 mg/g,考虑实际条件,将工艺参数修为液料比16∶1(mL∶g),提取温度45 ℃,乙醇体积浓度54%,在此条件下做3 次平行试验,多酚得率为2.36 mg/g,说明该模型可以应用于实际生产。
2.3 燕麦多酚稳定性结果
2.3.1 温度对多酚稳定性的影响
温度对多酚稳定的影响结果见图5。
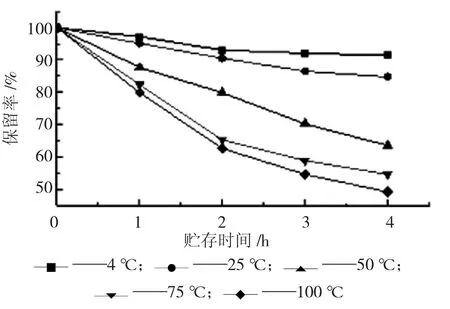
图5 温度对多酚稳定性的影响
由图5 可知,多酚保留率在不同温度下均随着时间的延长而降低。温度为4 ℃~25 ℃时,随着时间的延长多酚含量下降缓慢,在25 ℃贮存4 h 后,多酚保留率为84.7%。当温度超过75 ℃,贮存时间4 h 时,保留率约为50%,原因可能是高温破坏了多酚结构,使多酚氧化降解,所以燕麦多酚应保存在阴凉干燥处。
2.3.2 pH 对多酚稳定性的影响
pH 对多酚稳定性的影响结果见下页图6。
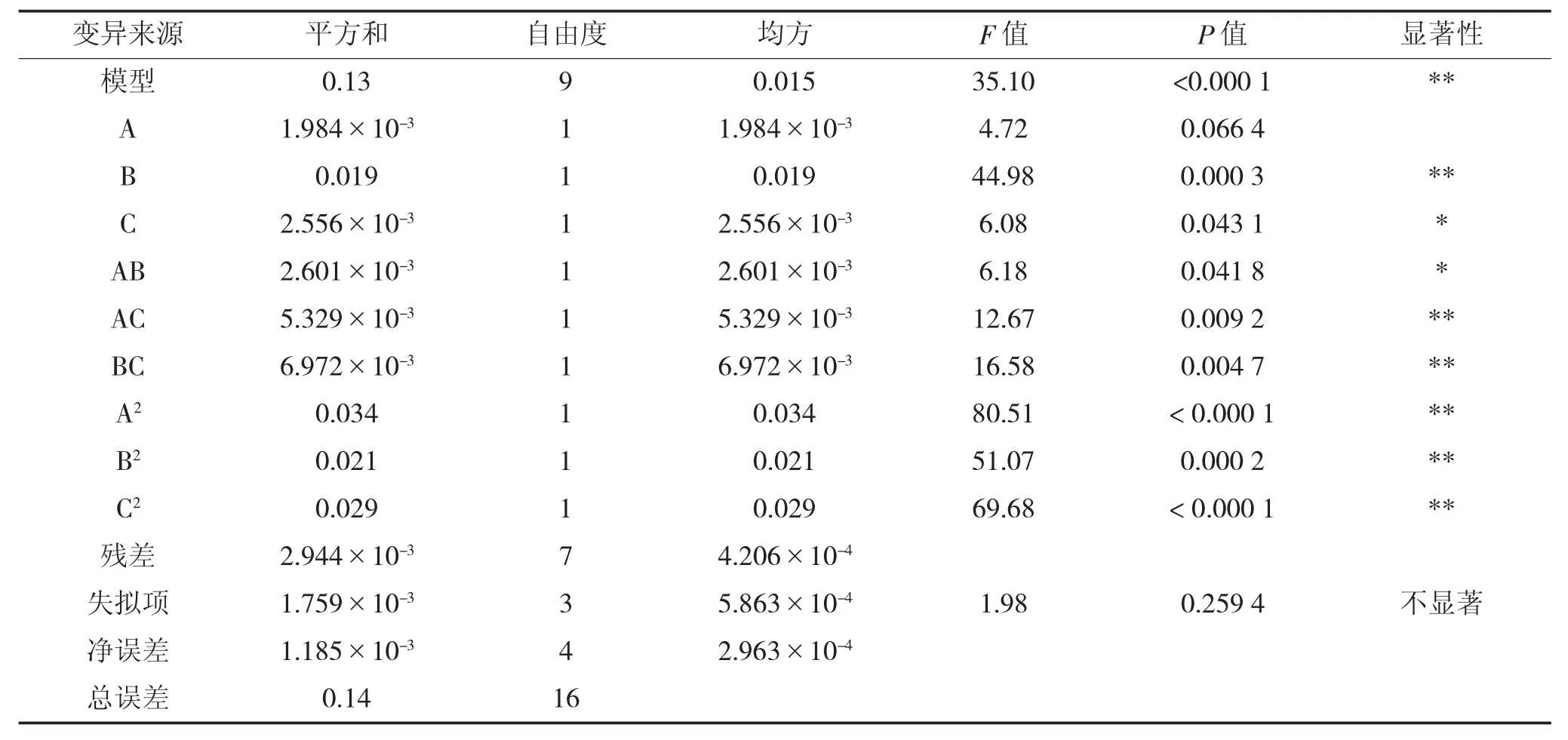
表3 回归模型方差分析
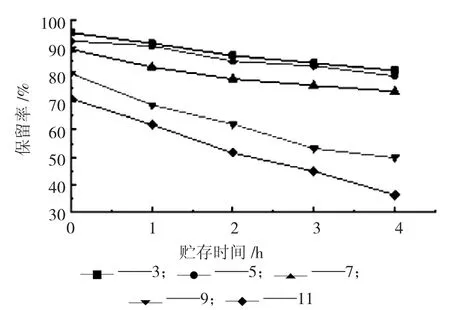
图6 pH 对多酚稳定性的影响
如图6 所示,多酚保留率受pH 影响较大。当pH<7 时,多酚较为稳定,随着时间延长多酚保留率较高;过高的pH 会影响多酚的稳定性,使保留率下降,当pH=11 时,贮存4 h 后,多酚的保留率为36.3%,多酚含量降低,可能是因为酚类化合物中含量酚羟基,呈弱酸性,当处于碱性溶液中时,结构破坏,多酚含量降低。燕麦多酚在偏酸性条件下较为稳定。
2.3.3 光照对多酚稳定性的影响
光照对多酚稳定性的影响结果见图7。

图7 光照对多酚稳定性的影响
由图7 可知,在室内自然光照或避光条件下,随着贮存时间的延长,燕麦多酚的保留率均下降。避光条件下多酚保留率更高,原因可能是多酚在光照条件下被氧化,结构遭到破坏,多酚降解,含量降低。所以燕麦多酚应避光保存。
3 结论
本研究采用乙醇为提取溶剂,多酚得率为评价指标,经3 因素3 水平响应面试验设计得到燕麦多酚的最佳提取工艺条件为:液料比16:1(mL:g),提取温度45 ℃,乙醇体积浓度54%,此条件下多酚得率为2.36 mg/g。稳定性试验结果表明,燕麦多酚应贮存在阴凉避光处,在酸性条件下较为稳定。

