高尿酸血症患者血清胱抑素C、β2微球蛋白和炎症因子水平变化及意义
陈慧,华文进
(无锡市第三人民医院,江苏无锡214041)
高尿酸血症是由体内嘌呤代谢紊乱引起的肾脏排泄过少或血尿酸异常增多所致,属于慢性低度炎症性疾病,在其发生与病理发展过程中均有炎症因子的参与[1,2]。白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白1(MCP-1)是常见的炎症因子,可反映机体的炎性水平。高尿酸血症可直接损害肾功能,尿酸盐结晶在肾小管间质或肾髓质、集合管沉积造成肾损伤而引起痛风性肾病[3,4]。近期研究发现,胱抑素C(Cys C)、β2微球蛋白(β2-MG)可早期发现肾损害。但是,由于肾脏病变缺乏典型体征与症状,早期尿素氮、肌酐、尿常规基本上正常,如不引起典型痛风发作,临床并不重视这些指标的早期检测。为了进一步提高临床对高尿酸血症肾损害的重视,我们观察了高尿酸血症尚未发生痛风患者血清Cys C、β2-MG及炎症因子水平变化,以期临床普及这些指标的检测,以便早期发现肾损害并给予积极的治疗措施。
1 资料与方法
1.1 临床资料 收集2017年1月~2018年2月无锡市第三人民医院接诊的高尿酸血症患者及健康查体者。纳入标准:①高尿酸血症患者符合《中国肾脏疾病高尿酸血症诊治的实践指南(2017版)》[5]中的诊断标准(血尿酸女性>350.0 μmol/L、男性>420.0 μmol/L),健康体检者血尿酸男性为237.9~356.9 μmol/L,女性为178. 4~297.4 μmol;②年龄≥18岁;③自愿加入本次研究,并签署知情同意书;④认知功能正常。排除标准:①合并严重的肝、血液系统、脑血管疾病等原发性疾病;②急、慢性痛风性关节炎;③哺乳期或妊娠期妇女;④精神疾病;⑤因化疗、恶性肿瘤、药物等所致的继发性高尿酸血症;⑥近期使用肾毒性药物,泌尿系统感染;⑦听力障碍与语言交流障碍。共收集高尿酸血症52例(观察组)和体检健康者60例(对照组)。观察组男34例、女18例,年龄(51.48±9.86)岁,男性血尿酸为(469.24±23.2)μmol/L、女性为(406.13±18.1)μmol/L。对照组男36例、女16例,年龄(51.52±9.84)岁。本研究经医院医学伦理委员会批准,两组性别、年龄具有可比性。
1.2 血清Cys C、β2-MG、IL-6、TNF-α、MCP-1检测方法 分别抽取受试者空腹静脉血5 mL,以3 000 r/min离心5 min,分离血清,取上清液,置于-80 ℃冰箱冻存待检。采用免疫比浊法测定β2-MG、Cys C,仪器为德国罗氏DPP800全自动生化分析仪,试剂为ROCHE试剂盒配套试剂;采用酶联免疫吸附法检测炎症因子IL-6、TNF-α、MCP-1,仪器为美国Bio-Rad酶标仪,试剂盒均由上海西唐生物有限公司提供。正常参考值:Cys C 0.5~1.05 mg/L,β2-MG 0.8~2.2 mg/L,IL-6 2.68~6.16 pg/mL,TNF-α 4.10~8.80 pg/mL,MCP-1 23.27~82.73 pg/mL。

2 结果
2.1 两组血清Cys C、β2-MG、IL-6、TNF-α、MCP-1水平比较 见表1。
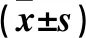
表1 两组血清Cys C、β2-MG、IL-6、TNF-α、MCP-1水平比较
2.2 观察组不同性别血清Cys C、β2-MG、IL-6、TNF-α、MCP-1水平比较 见表2。
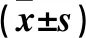
表2 观察组不同性别血清Cys C、β2-MG、IL-6、TNF-α、MCP-1水平比较
2.3 血尿酸与血清Cys C、β2-MG、IL-6、TNF-α、MCP-1水平的关系 血尿酸水平与Cys C、β2-MG、IL-6、TNF-α、MCP-1水平呈正相关(r分别为0.457、0.472、0.640、0.570、0.684,P均<0.05)。
3 讨论
尿酸是嘌呤核苷酸代谢的产物,人体内尿酸有80%源自细胞代谢,另外20%则源自食物。嘌呤代谢过程受到部分关键酶的严格调控,当此类关键酶活性变化或缺乏时会造成尿酸生成异常,包括黄嘌呤氧化酶、腺嘌呤磷酸核糖转移酶活性降低与活性过高的次黄嘌呤-鸟嘌呤磷酸核糖转移酶、磷酸核糖焦磷酸合成酶1等[6,7]。高尿酸属代谢性疾病,其对生活与工作的影响、对健康的损害不可低估,其诱发的痛风及相关的肾病,严重时可危及患者的生命安全。高尿酸血症病程迁延,对肾脏未被累及者,经及时、有效的防治,有良好的预后;一旦累及肾脏,或防治不当,则可能对患者的健康造成严重影响。但是,因其所致肾脏病变缺乏典型体征与症状,早期尿素氮、肌酐、尿常规基本上正常;而能反映早期肾小球滤过功能变化的指标内生肌酐清除率,因留取过程不易控制、操作繁琐,常不受重视;而当尿常规异常引起蛋白尿、血尿、脓尿时,多数患者的病情已经发展为晚期,预后极差[8]。因此,早期选择易检测的有效指标,并根据检查结果给予科学的防治措施对患者的预后尤为重要。
β2-MG为主要由淋巴细胞产生的小分子蛋白质,以游离的形式在胸腔积液、血、尿、脑脊液、腹腔积液等细胞外液中存在,可自由经过肾小球滤过膜,几乎全部在肾小管内被重吸收。β2-MG水平可反映肾小球滤过功能,与血肌酐相比敏感性更高,是评价肾小球疾病的重要指标。Cys C由所有机体有核细胞合成,属于半胱氨酸蛋白酶抑制族的阳离子多肽。其能自由经过肾小球滤过膜,与肾小球滤过率有关,在近端肾小管中可被完全吸收降解,是反映肾小球滤过率的理想内源性标志物。本研究中,对照组血清β2-MG、Cys C水平均低于观察组,提示高尿酸血症与肾功能损害关系密切。高尿酸是肾脏病进展的独立危险因素,其可直接引起肾损害。血尿酸水平升高会激活肾素-血管紧张素-醛固酮系统(RAAS)和造成血管内皮细胞增殖而降低一氧化氮(NO)含量。被激活的RAAS会引起肾小球高压、造成血管收缩而损伤肾脏;高尿酸可激活血管紧张素、肾素系统,造成平滑肌细胞增殖及肾血管硬化,进而引起肾损伤[9]。
MCP-1主要源自单核巨噬细胞,又称单核细胞激活与趋化因子。其可趋化单核细胞在血管内皮黏附,在炎症反应与动脉硬化过程中起到关键性作用[10];另外,MCP-1还具有趋化记忆型T淋巴细胞、单核细胞、树突状细胞和NK细胞至组织损伤部位的作用。本研究中,观察组血清MCP-1水平高于对照组,提示MCP-1可能参与了尿酸诱导的氧化应激反应。高尿酸血症与内皮血管各炎性反应有密切的联系,随着其水平升高,抑制血管内皮功能的作用增强。尿酸能经转运体进入血管内皮,使炎症信号途径NF-κB被激活,致使MCP-1表达增加。此外,尿酸能作用于脂肪细胞,致使其组织中炎性因子MCP-1表达增加,诱发氧化应激反应,进而降低NO水平,可造成内皮紊乱进一步加重而损害血管[11,12]。
TNF-α主要依赖于TNF-R2、TNF-R1两种受体诱导炎症反应,能激活淋巴细胞和中性粒细胞,增加血管内皮细胞通透性,并对其他组织代谢活性进行调节,使其合成与释放[13,14]。TNF-α可作用于内皮细胞,致使内皮功能紊乱,损害血管。TNF-α可引起IL-6释放,增加其水平,并使黏附分子的表达增加,引起各种炎症反应和组织损伤。IL-6主要由纤维母细胞、巨噬或单核细胞、T和B淋巴细胞等多种细胞产生,具有多种生物学功能,是炎症反应的细胞因子网络中的中枢性调节因子之一,参与免疫调节反应,可诱导多种细胞分化(如单核细胞、B细胞、神经细胞等),诱导肝细胞合成急性相反应蛋白,发挥趋化单核细胞、中性粒细胞的作用,促进炎症反应[15,16]。本研究中,对照组血清IL-6、TNF-α均低于观察组,提示炎症反应参与了高尿酸血症的发生。尿酸可经尿酸盐转运蛋白1(URAT1)直接进入血管平滑肌(血管内皮细胞上)并使其增殖,使炎症信号途径如蛋白酶、核转录因子等激活,促进表皮生长因子和炎症因子释放,造成血管弹性、平滑肌细胞炎症反应降低。尿酸盐晶体可刺激滑膜细胞的增生、单核细胞募集等,激活炎症信号通路,增加IL-6、TNF-α表达。尿酸盐作为启动白细胞释放炎症因子的初始因素,能引起炎性损伤,并参与炎性损伤的发生与进展。
本研究结果显示,观察组男性患者血清β2-MG、Cys C、IL-6、TNF-α、MCP-1水平均高于女性,提示男性患者并发肾损害的危险性更高;血尿酸水平与β2-MG、Cys C、IL-6、TNF-α、MCP-1水平呈正相关,提示可将β2-MG、Cys C、IL-6、TNF-α、MCP-1作为预测高尿酸血症肾损伤发生与进展的重要指标。因此,这些指标对于高尿酸血症患者应早期检测,有助于早期发现肾功能损害。

