肺炎链球菌自溶素研究进展
邵致远,游雪甫,杨信怡
肺炎链球菌(Streptococcus pneumoniae)是一种革兰阳性(G+)条件致病菌,常定植于人鼻咽部,近一半健康人携带此菌[1]。当人体免疫力降低,定植的肺炎链球菌可穿透黏膜等防御体系引起多种感染。临床上,肺炎链球菌是导致社区获得性肺炎、脑膜炎、中耳炎等的重要病原之一。易感人群包括儿童、老年人,及伴有其他基础疾病(如肿瘤、红斑狼疮)的青壮年患者[2]。据报道,每年死于这类病原菌感染的人数与死于结核病的人数大体相当[3]。
人体常见病原菌中,肺炎链球菌是少有的在生长进入稳定期后能观测到大量自溶的细菌[4]。与肺炎链球菌稳定期自溶现象直接相关的生物分子中,有一类称作自溶素(autolysin,Lyt)的蛋白最早引起人们关注。目前,在肺炎链球菌中已发现 LytA、LytB、LytC 三种自溶素,且生理功能各不相同。其中,肺炎链球菌所特有、自溶活性最强、研究最深入的是 LytA[5-6]。本文重点围绕三种自溶素的结构、功能及部分应用有关的进展进行综述,为进一步揭示细菌自溶现象的生物学本质,并为相关领域研究工作提供参考。
1 LytA
1.1 LytA 基因序列与蛋白结构
LytA 是一种 N-乙酰胞壁酰-L-丙氨酸水解酶,García 等[7]最早于 1986年测定其编码基因(lytA)并成功异源 表达、纯化该蛋白。LytA 含 318 个氨基酸残基,分子量为 37 kD,PI 值为 5。其 N 末端为酰胺酶结构域(amidase domain,AD),C 末端为胆碱结合结构域(choline binding domain,CBD),两者间有一段 6 个氨基酸残基(aa171-aa176)的连接片段。
研究者对不同血清型、不同临床来源肺炎链球菌的lytA序列进行对比发现,其基因保守性相对较高,多态性较低(0.11%~3.2%),近似管家基因。研究中用于对比的其他毒力因子基因如nanA、pspA等多态性则高达 30%[8]。进一步研究发现,许多肺炎链球菌噬菌体(Dp-1)具有的细胞壁裂解酶(Pal),与宿主 LytA 的一个或两个结构域存在高度相似性[9]。另外,实验室条件下,研究者也观察到噬菌体 DNA 和lytA之间有发生重组的可能。这一现象提示,肺炎链球菌在长期进化过程中,曾可能从特定噬菌体基因组中获得部分或全部lytA片段。
Morales 等[10]对不同肺炎链球菌菌株基因组进行分析,发现在基因空间分布上,lytA普遍与溶血素 A 编码基因plyA靠近(间距 11~19 kb),且在健康儿童的肺炎链球菌定植菌群中发现两基因的转录水平也相近,提示lytA和plyA有聚集于相同毒力岛,且功能存在协同的可能。而在毒力较低的缓症链球菌 SMG(Streptococcus mitisGroup)共生性菌群中,lytA-plyA存在非常显著的同步缺失(90%~100%),进一步暗示了lytA和plyA对于肺炎链球菌致病性的贡献,也勾勒出高致病性肺炎链球菌通过丢失该致病岛,从病原菌进化为共生菌的可能图景。
人们发现 LytA 必须与胆碱结合,发生同源二聚化才能发挥自溶活性。在细胞质中,lytA的翻译产物是 LytA 单体(E-form),呈低活性,只有当其结合胆碱,形成同源二聚体(C-form),并释放至胞外,才具有完全活性。该活性形式的二聚体结构最早由 Tomasz 和 Westphal 于 1971年证实[11]。其晶体结构如图1所示,两个 LytA 单体的 N 端球状酰胺酶结构域(Met1-Asn170,红色)通过六氨基酸残基接头(Gly171-Thr176,蓝色)连接至 C 端圆柱形 CBD(Gly177-Lys318,青色),单体依对称轴形成回旋镖二聚体结构,内角 85°,两臂长 10.6 nm,酰胺酶催化活性必需的 Zn2+(灰色球状)之间距离为 10.3 nm,C 端 CBD 中有 6 个依次排列的胆碱结合氨基酸残基位点,由特有的 β-发夹结
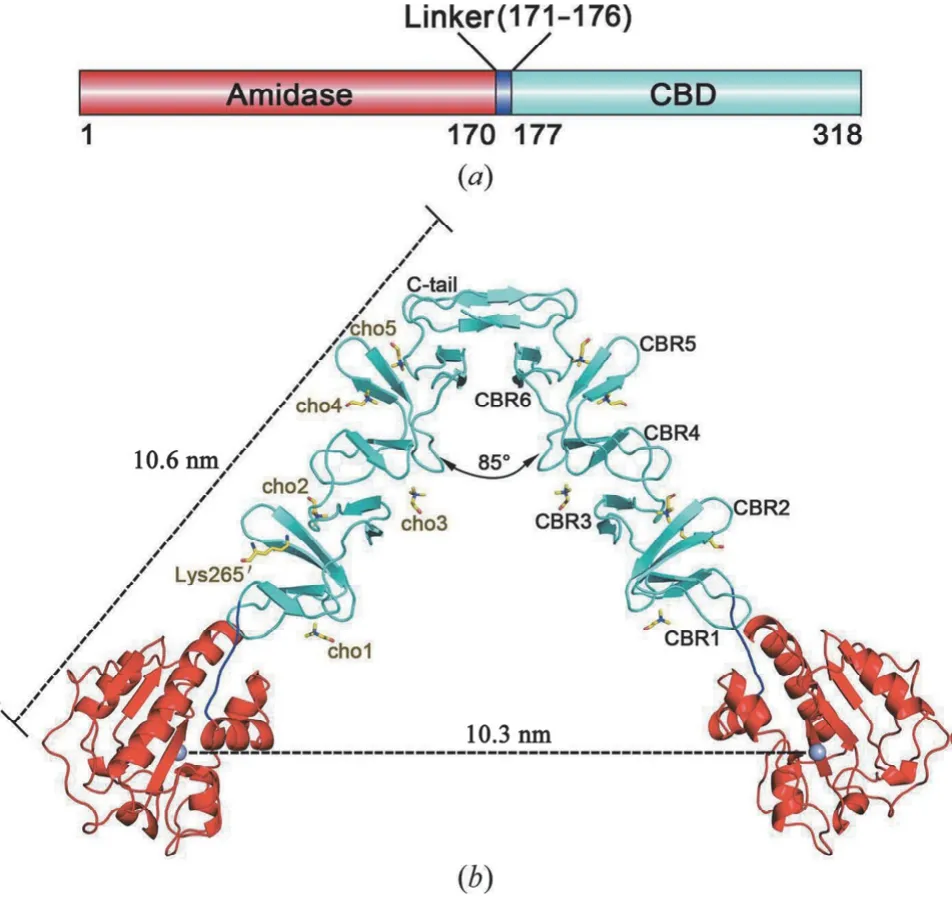
图1 LytA 二聚体的蛋白结构[12]
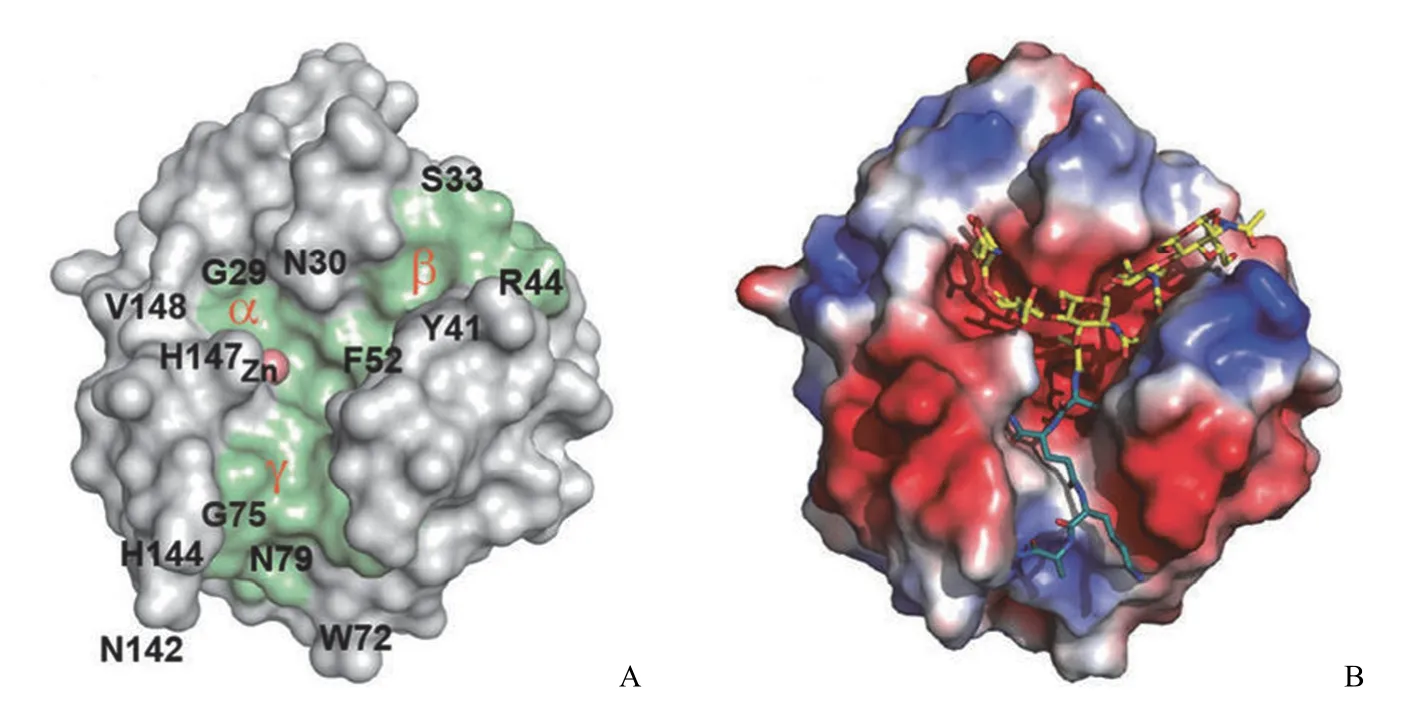
图2 LytA 酰胺酶结构域晶体结构[14]
构堆叠形成左手超螺旋,最后一个胆碱结合位点不参与胆碱结合,但对二聚化有重要贡献[13]。
有研究将 LytA 的 AD 结构域与多种其他细菌中的酰胺酶,诸如弗劳地枸橼酸杆菌的 AmpD、葡萄球菌的 AmiA、AmiE 进行比较发现,尽管这些酰胺酶的编码基因与lytA同源性很低(10%~20%),但蛋白三级结构却十分相似,尤以 AmiA 相似度最高,提示这些蛋白在不同种属细菌中可能具有相似的生理功能和底物选择性。
进一步研究显示,LytA N 末端球形 AD 晶体结构 (图2)中存在一个较舒展的 Y 形槽,由 3 条裂缝交汇组成,锌离子结合于该交汇处形成稳定的非共价结构。该 Y 形槽被认为是 LytA 结合并催化底物水解的活性区域。通过计算机拟合与实验手段结合,人们推测其能与 4~5 种含糖长链多肽紧密结合,并催化后者水解。通过点突变研究发现 Y 形槽内 His26、Glu87、His133、His147、Asp149 及 Y 形槽外的 His24、His54、Lys131 对 LytA 的酶催化活性均十分重要[14]。
1.2 LytA 诱导自溶机制及调控
作为一种 N-乙酰胞壁酰-L-丙氨酸水解酶,LytA 有 水解细胞壁肽聚糖层肽桥与双糖结构之间共价连接的活性(图3)。与大多数分泌至胞外起效的胆碱结合蛋白不同,LytA 没有分泌肽,属典型的胞内蛋白[15]。正常情况下,95% 的 LytA 存在于肺炎链球菌细胞质中,仅 5% 通过 CBD 结合于细胞壁脂磷壁酸(LTA)胆碱基团,因没有特定转运系统,LytA 只能通过裂解细菌释放至胞外。而这些 LytA 究竟以何种方式转移至胞外,机制尚不清楚[16]。
在肺炎链球菌的迟缓生长期至对数生长期,因某种目前未知的保护机制,结合于细胞壁上的 LytA 并不显示出裂解活性,即使人为提高胞外 LytA 浓度,细菌的对数期生长曲线仍与正常对照组一致。但当肺炎链球菌进入生长稳定期后,该保护机制失效,细菌开始缓慢裂解。此时如提高胞外 LytA 浓度,则细菌的自溶时间提前、自溶速度加快[17]。

图3 LytA 作用位点
关于 LytA 如何从对数生长期的无活性状态转变为稳定期的有活性状态,目前有两种主流假设。第一种假设认为,LTA 是 LytA 的抑制物,胞外 LytA 在与 LTA 的结合下不呈现活性。当细胞壁合成停止时,两者间的平衡关系遭破坏,LytA 脱离 LTA 而激活,自由接触其底物发挥作用,导致细胞自溶。第二种假设则基于 LytA 在细胞壁的物理定位,通过荧光小分子技术,研究者观察到胞外 LytA 主要结合于肽聚糖合成最活跃的赤道板,LytA 与新生肽聚糖的共定位提示其可能需要特定底物。LytA 在对数生长期间占据细胞壁而不诱导裂解[18],但当细菌细胞壁的合成停止、营养缺乏,或抗生素治疗时诱导裂解,由此人们假定结构完整、连接成片的成熟肽聚糖并不能作为 LytA 的底物。在细胞壁快速合成的对数期,肽聚糖单体不断被转肽至合成区域,LytA 也无法接触到开放的不完整的肽聚糖结构。但在肽聚糖合成停滞的稳定期,转肽停止,新生肽聚糖的结构暴露出来,才能为 LytA 提供正确的底物,从而开启最初的裂解进程[17]。
随着菌体的裂解,储存于细胞质中的 LytA 不断释放至环境中并逐渐积累,在整个稳定期期间,LytA 的细胞外部分占比缓慢增加至约 30%,释放的 LytA 又与邻近完整菌体的细胞壁结合,促发裂解级联反应。达到特定阈值浓度时,细菌自身调控 LytA 活性的平衡机制被打破,最终导致连锁 的自溶现象。目前,这一阈值浓度经间接证明约为 0.5 μg/ml 即 14 nmol/L 左右。
LytA 的活性调控与胆碱密切相关,细胞壁 LTA 中的胆碱基团介导 LytA 从低活性的E-form 转变为高活性的 C-form,在 LytA 的二聚化中扮演重要角色。但低浓度的游离胆碱(0.1% 及以上)却可通过抑制 LytA 活化的方式抑制肺炎链球菌的自溶。其抑制形式既可能是非竞争性抑制,即通过结合 LytA 的非活性部位使得作为中间络合物的 LytA-底物-胆碱结合物无法释放出产物,也可能是竞争性抑制,即通过竞争性结合 LytA 胆碱结构域的方式,使其失去与 LTA 结合的机会,从而无法定位到正确的底物位置。但究竟哪种抑制方式更接近真实的情况,目前尚无定论。另外,肺炎链球菌在生长过程中如采用含乙醇胺而无胆碱的培养基培养,LytA 的表达量下降,细菌不发生自溶[19]。这提示,胆碱也可能在 LytA 表达、翻译、修饰过程中发挥重要作用。
1.3 LytA 的其他功能
众所周知,补体系统是介导宿主免疫应答的关键组分,用于识别和清除各类病原菌。而 LytA 能有效帮助肺炎链球菌免疫逃逸。通过流式细胞术、ELISA 等手段,研究者观察到,与野生型菌株相比,LytA 缺陷菌株表面的补体 C3b 沉积有明显增加。同时,LytA 可以降低补体 C1q 和急性期蛋白与肺炎链球菌的结合,或直接降解 C3b 和 iC3b,从而减少细菌表面补体经典途径的活化。除直接影响补体系统,LytA 还可募集肺炎链球菌细胞壁的补体下调蛋白 C4BP 和 FH,利用补体系统自身的调节蛋白减少补体对于肺炎链球菌的识别与结合[20]。
除干扰宿主免疫系统,LytA 还能通过介导肺炎链球菌的荚膜脱落避免抗菌肽的杀伤作用。通常情况下,细菌产生荚膜以抵御抗生素与宿主免疫系统的攻击。但另一方面,荚膜使肺炎链球菌对宿主上皮细胞分泌的抗菌肽十分敏感。当抗菌肽存在时,LytA 可在数分钟内将菌体表面的荚膜清除,从而使细菌存活[21]。与经典的细菌自溶过程不同,在荚膜脱落期间,LytA 促进肺炎链球菌存活并且使细菌向周围侵袭,因此荚膜的脱落将显著增加肺炎链球菌对上皮细胞的侵袭。不少研究者曾一度困惑为何在作用于细胞壁的抗生素(如青霉素)对 LytA 产生巨大选择压力的情况下,LytA 仍保守地存在于几乎所有肺炎链球菌临床致病株中?现在看来,上述研究或可一定程度解释这一现象。
1.4 LytA 的应用前景
1.4.1 临床检测lytA仅存在于肺炎链球菌中,且基因序列具有高度保守性。这为临床上将其作为鉴定肺炎链球菌的潜在检测标志物提供了可能。例如有报道显示,用 PCR 法定性检测胸腔积液中的肺炎链球菌,相较其他标志基因(如plyA、psaA),lytA有更高灵敏度[22]。而采用lytA-qPCR 手段定量检测咽拭子与痰液标本中的肺炎链球菌,也显示出较高的灵敏度和特异性[23]。同时,LytA 在肺炎链球菌定植菌群的表面丰度与环境丰度,和处在快速侵袭扩张期的肺炎链球菌菌群相比存在很大的差异。这种差异可通过荧光定量 PCR 或 ELISA 等手段进行检测,从而区分一般性定植与侵袭性感染的可能[24]。
1.4.2 免疫预防 LytA 也可以作为特异性免疫的疫苗进行开发,因其广泛分布于所有血清型的肺炎链球菌表面,可以克服现有多糖疫苗的血清型局限,也可以克服多糖-蛋白结合疫苗不能产生免疫记忆的问题[25]。有动物实验证明,使用 LytA 免疫幼龄小鼠可以获得比荚膜多糖疫苗更好的免疫效果[26-27],是一种较理想的备选被动疫苗。
2 LytB 与 LytC
LytB(77 kD、PI 5)和 LytC(59 kD、PI ≈ 6)是另两种重要的肺炎链球菌自溶素,也属于胆碱结合蛋白家族,拥有细胞壁水解活性,但具体底物至今尚未完全明确。它们的一级结构与 LytA 相反,催化活性中心位于 C 末端,胆碱结合域位于 N 末端。另外,lytB与lytC并非肺炎链球菌专有,在轻型链球菌和口腔链球菌中能找到它们的高同源性基因。这些基因与lytB的同源性大致在 70%~90% 之间,与lytC的同源性大致在 70%~80% 之间。与lytA相比,lytB与lytC的基因保守性稍低,不同菌株之间,lytB的差异可达 10%,lytC可达6%。总体而言,目前关于这两个自溶素蛋白的研究尚不充分,研究者们利用与 LytA 相似的方法构建了缺陷菌株,借此研究了它们的生理功能。现认为,LytB 与肺炎链球菌特征性的大规模自溶无关,但 LytC 具有一定的间接关系[28]。
LytB 是一种存在于不同细菌中的 N-乙酰氨基葡萄糖苷酶,具有分泌肽序列,可以水解可溶性 N-乙酰葡糖胺(GlcNAc)寡聚体并显示出较弱的糖基转移酶活性,但这些酶活性在细菌生长、繁殖中的功能定位尚不清楚。不同于 LytA,在肺炎链球菌中,LytB 分布在远离赤道板的菌体两端,参与子代细胞的分离[29]与生物膜形成。典型的肺炎链球菌为双球菌或短链状排列,这些生长形式受 LytB 氨基葡萄糖苷酶的功能调控。敲除 LytB 基因,肺炎链球菌将呈约 100 个菌体长度的长链状排列,且对细菌的生物被膜形成产生负面影响。此外,与 LytA 近似,LytB 也能够介导肺炎链球菌对补体系统的逃避,但其所介导逃避方式的多样性则不及前者[30]。另外,敲除 LytB,肺炎链球菌定植于人鼻咽部的能力降低。
LytC 是一种胞壁水解酶,不同于 LytA 和 LytB,其最适活性温度为 30℃,而这恰好是上呼吸道中的生理温度。在肺炎链球菌肺炎感染模型中,LytC 缺陷菌株感染能力显著减弱。提示其是一种有助于肺炎链球菌定植于鼻咽部、引发肺炎的毒力因子[31]。此外,与野生型菌株相比,鼻内接种 LytC 突变菌株,引起的菌血症发生率降低,提示 LytC 对细菌从肺组织穿透毛细血管屏障,进入循环系统的过程中起重要作用[32]。
目前认为,作为毒力因子,LytB 和 LytC 具有累加或协同作用,均广泛参与到肺炎链球菌在宿主的免疫逃避、鼻咽定植、生物膜形成、上呼吸道感染等多个环节中[33]。另 外,最近有报道显示,LytB、LytC 都拥有结合 DNA 的能力,共聚焦激光扫描显微镜证实肺炎链球菌生物膜中细胞间 DNA-LytB、DNA-LytC 蛋白复合物的存在,提示二者与肺炎链球菌的胞间 DNA 交换存在一定联系[34]。
3 小结
肺炎链球菌保留lytA等自溶素基因的生物学本质,可能还是基于受调控的自溶能力能给细菌带来诸多的生物学竞争优势。从目前研究中获得的线索判断,Lyt 的相应功能,无论是促侵袭、定植,还是免疫逃避、DNA 交换,均利于肺炎链球菌在宿主-环境-病原多角关系中获得更多存活机会。可以推测,对于肺炎链球菌而言,大规模自溶可能是一种双刃剑式的平衡策略,利用自溶带来的侵袭、定植、免疫逃避、遗传物质交换与重组的能力,可帮助细菌自身低强度地扩张至宿主身体的其他位置。因丢失诸如lytA等基因而失去部分致病能力与大规模自溶能力的个体,则可能逐渐进化成致病力较弱的链球菌种群,与宿主形成相对稳定的共生关系,这对于种群总的生存与进化具有重要意义[10]。从 LytA、LytB、LytC 已知的功能判断,在肺炎链球菌的生长、繁殖、宿主侵袭等过程中,三个蛋白之间很可能存在复杂的联动和交互关系,如能结合它们的上下游基因功能,从整体的视角分析、探讨三者的生理、生化功能,或可为进一步揭示肺炎链球菌独特生存方式的秘密提供一把有效的钥匙。不过,LytB 和 LytC 的研究仍相对薄弱,目前虽已积累了较多基因功能方面的研究结果,但两种蛋白的细胞壁作用位点、底物特征、作用形式、调控与激活分子机制等尚待进一步阐明。此外,Lyt 在肺炎链球菌临床微生物学诊断、疫苗设计,甚至药用开发领域的潜在价值已开始获得关注,如有研究者以 LytA 重组蛋白为潜在抗菌生物制剂,评价其体外、体内条件下选择性杀灭肺炎链球菌的活性,发现其联用 β-内酰胺类药物可增强后者的杀菌效果,这样的研究或可为 Lyt 蛋白的药用探索提供一定的启发。鉴于肺炎链球菌中 Lyt 蛋白独特的结构和功能,以及在医药领域潜在的应用价值,相信未来人们对这类蛋白的研究将更加深入、系统地开展下去。

