FoxO1抑制剂细胞筛选模型的构建与应用
杨梦夏,张晋,杜郁,何维,王雪蕾,王丽,洪斌
糖代谢、脂质代谢是十分复杂的生理过程,与营养调节[1]、激素调节[2]和体内平衡[3]有关,而代谢受损是许多难治性慢性疾病如肥胖[4]、非酒精性脂肪肝[5]和 2 型糖尿病[3]的主要特征。目前的研究表明,转录因子人叉头框蛋白 O1(FoxO1)参与糖脂代谢并在相关疾病的发展中起到关键作用[6-8]。动物实验和临床研究均显示,在脂肪肝和胰岛素抵抗的病理状态下,肝细胞核内 FoxO1 表达明显增加,从而引起糖脂代谢紊乱[9-10]。而伴随体重减轻和胰岛素抵抗的改善,可使 FoxO1 表达趋于正常并向细胞核外转移失活[11]。研究还证明,阻断 FoxO1 的表达可显著改善动物的血糖、血脂异常及肝内的甘油三酯沉积[12-14]。因此调节 FoxO1 的表达或活性有望成为糖尿病、脂代谢紊乱等疾病药物发现的潜在靶标。
FoxO 是 Forkhead 蛋白家族的亚群之一,它在哺乳动物细胞中由 4 个不同的基因编码组成,分别为 FoxO1、FoxO3、FoxO4 和 FoxO6[15]。FoxO 家族广泛参与调节细胞活动如应激抵抗、代谢和细胞凋亡等[15]。FoxO 蛋白主要通过结合共有核心识别序列起转录激活的作用且其活性受到胰岛素和胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1)信号通路的调控[16-19]。FoxO1 是 FoxO 家族最早发现的成员[20],可以通过识别靶基因启动子区的胰岛素反应元件(insulin response element,IRE)继而调控下游靶基因的表达。FoxO1 是磷脂酰肌醇 3 激酶(PI3K)/蛋白激酶 B(Akt)的底物[21],在胰岛素信号调控中起重要作用。转录因子 FoxO1 通过与糖异生关键酶葡萄糖 6 磷酸酶(glucose 6 phosphatase,G6Pase)和磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase,PEPCK)基因启动子区的 IRE 结合,调节这两个基因的表达[22],从而影响糖异生的过程。微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTP)是一种转运蛋白,催化脂质转运到 apoB 分子上的,在极低密度脂蛋白(very lowdensity lipoprotein,VLDL)的组装与合成中起重要作用[23]。研究表明,MTP 是 FoxO1 的靶基因,FoxO1 介 导胰岛素依赖的肝 MTP 表达继而调控肝脏 VLDL 的产生。载脂蛋白 C-III(apolipoprotein C-III,apoC-III)是高密度脂蛋白(high-density lipoprotein,HDL)与富含甘油三酯(triglyceride,TG)颗粒(如VLDL、乳糜微粒等)进行成分交换的载脂蛋白。研究发现 FoxO1 可与 apoC-III 启动子上的 IRE 位点结合促进 apoC-III 的表达[23],从而引起富含 TG 颗粒的水解及清除障碍,导致血浆 VLDL、乳糜微粒的积聚,继而促进高脂血症的发展。
本研究将 FoxO1 靶基因结合位点 IRE 克隆至 pcDNA3.0,构建荧光素酶及绿色荧光蛋白双报告基因重组质粒 pc-IRE-LE,瞬时转染入 HEK293T 细胞中,经优化和评价最终建立适用于高通量筛选 FoxO1 抑制剂的细胞模型。通过筛选获得的阳性化合物可有效抑制报告基因的表达,并且能够调控 FoxO1 靶基因的表达,有望成为 FoxO1 抑制剂的新型先导化合物,为应用于糖脂代谢紊乱相关疾病的药物发现提供了实验依据。
1 材料与方法
1.1 材料
1.1.1 主要材料及试剂 真核细胞表达载体 pcDNA3.0 购自美国 Invitrogen 公司;克隆载体 pEASY Blunt zero、大肠杆菌 Trans5α、Trans110、TransT1、胶回收试剂盒、质粒提取试剂盒和逆转录试剂盒 TransScript First-Strand cDNA Synthesis SuperMix 均购自北京全式金生物技术有限公司;限制性内切酶(HindIII、BglII、XbaI)、T4 DNA 连接酶购自美国 New England BioLabs 公司;引 物合成由美国 Invitrogen 公司完成;细胞株 HEK293T、HepG2 为本室保存;DMEM 培养基、 无糖 DMEM 培养基、葡萄糖、胎牛血清、0.25% 胰酶均购自美国 Gibco 公司;FoxO1 抑制剂 AS1842856 购自美国 Selleck 公司;MTT 溶液购自北京索莱宝科技有限公司;转染级质粒提取试剂盒、萤火虫荧光素酶试剂盒购自美国 Promega 公司;转染试剂 LipofectamineTM3000 购自美国 Invitrogen 公司;总 RNA 提取试剂盒 Mag-Bind®Total RNA Kit 购自美国 Omega 公司;荧光定量 PCR 试剂盒 FastStart Universal SYBR Green PCR Master 购自瑞士 Roche 公司。
1.1.2 仪器 Veriti 96 Well Thermal Cycler 型PCR 仪为美国 Applied Biosystems 公司产品;EPS 301 型电泳仪为瑞典 Amersham Biosciences 公司产品;Gel Doc XR 凝胶成像系统为美国 Bio-Rad 公司产品;Victor X5 型多标记微孔板检测仪为美国 PerkinElmer 公司产品;HERAcell 150 型 CO2培养箱和 Heraeus Fresco 17 centrifuge 台式高速冷冻离心机为美国 Thermo Scientific 公司产品;CKX41 型倒置显微镜和 IX71 型荧光显微镜为日本 Olympus 公司产品;CFX96 型实时荧光定量 PCR 仪为美国 Bio-Rad 公司产品;MLS-3020 型高压灭菌锅为日本 Sanyo 公司产品;DYY-6C 型水平电泳槽为北京市六一仪器厂产品。
1.2 方法
1.2.1 pc-IRE-LE 双报告基因表达载体的构 建 将萤火虫荧光素酶报告基因序列(GenBank No:KM359772,141-1790 bp)以及绿色荧光蛋白序列(Beyotime:D2707,677-1393 bp)用自我剪切肽 P2A[24]序列(GenBank No:KM359772,1791-1856 bp)连接,两端加上酶切位点HindIII 和XbaI,委托生工生物工程(上海)股份有限公司进行全基因合成,获得含有合成融合基因序列的酶切重组质粒 pBluescript II SK-LE。双酶切获得目的片段及待连接的真核表达载体 pcDNA3.0 经琼脂糖凝胶电泳分离后,采用胶回收试剂盒对其纯化提取,用 T4 DNA 连接酶于 16 ℃ 连接过夜。将连接产物转化入大肠杆菌 DH5α 感受态细胞,于含浓度 100 μg/ml 氨苄青霉素的 LB 培养基平皿上选择培养。挑取单克隆,扩增并提取质粒,用内切酶酶切鉴定。正确的重组质粒命名为 pc-LE。设计的重组报告基因的调控序列为 5 个串联排列的 IRE[25]序列 5 ×(5' TTGTTTTG 3'),其下游连接基本启动子(minimal promoter,minP;GenBank No:KM359772,78-108 bp)序列。并在整个片段的 5'末端和 3' 末端分别设计了BglII 和HindIII 酶切位点。退火形成双链的 5 × IRE 和 minP 片段,用上述方法酶切连入重组质粒 pc-LE。在此过程中将只含 minP 的序列也按照同样方式操作,作为实验的阴性对照。
1.2.2 HEK293T 细胞系的培养及重组质粒的转染 将冻存的 HEK293T 细胞株从液氮罐取出,细胞经常规复苏及传代,培养基为 90% DMEM 完全培养基加入 10% 胎牛血清,细胞置于 37 ℃、5% CO2培养箱中培养,隔天换液。待 HEK293T 细胞培养至汇合度为 80% 时,用 0.25% 胰蛋白酶消化,用完全培养基稀释接种于 96 孔板中,并同时使用脂质体 LipofectamineTM3000 转染 pc-IRE-LE。
1.2.3 化合物的筛选 将瞬时转染重组质粒的 HEK293T 细胞于 96 孔板中培养,20 h 后换为无血清培养基,初筛样品存放于 96 孔板中,每个化合物样品浓度为 10 mg/ml。加入待筛选的化合物,筛选用终浓度为 10 μg/ml,作用 24 h 后,用荧光显微镜观察放大 200 倍的细胞中绿色荧光蛋白的表达,有明显抑制作用的孔次拍摄保存。继而用萤火虫荧光素酶试剂盒检测荧光值。
1.2.4 化合物毒性实验 将待测化合物作用于 HEK293T 细胞 24 h 后,每孔加入 0.5% 的 MTT 溶液 10 μl,使 MTT 的终浓度为 0.5 mg/ml,继续在 37 ℃ 条件下孵育 4 h。弃去培养液,PBS 漂洗 1 次,每孔加入 100 μl DMSO,显微镜下观察结晶物都已充分溶解。在 570 nm 波长下检测各孔的光吸收值(A)。细胞存活率(%)=(A加药组/A对照组)× 100%。
1.2.5 实时荧光定量 RT-PCR 待测化合物作用 于 HepG2 细胞 24 h 后,提取细胞的总 RNA,反转录成 cDNA,采用荧光定量 PCR 试剂盒进行实时荧光定量 PCR 反应,利用数据分子软件并计算 Ct 值并以 GAPDH 为内参,采用相对 Ct 的方法对基因的转录水平进行定量分析。
1.3 统计学处理
采用 Graphpad 5.0 软件对数据进行统计学分析。所有的结果均以±s形式表示。两组间比较采用非配对t检验,如果P< 0.05 为差异有统计学意义。
2 结果
2.1 FoxO1 抑制剂高通量筛选模型的构建

图1 重组载体 pc-IRE-LE 的构建及酶切鉴定[A:重组质粒 pc-LE 经 Hind III 和 Xba I 酶切鉴定(M:DNA marker;1:错误转化子;2~3:质粒 pc-LE);B:重组质粒经 Hind III 和 Bgl II 双酶切鉴定(M:DNA marker;1:错误转化子;2:质粒 pc-IRE-LE;3:质粒 pc-minP-LE);C:重组质粒 pc-IRE-LE 构建示意图;D:重组质粒转染 HEK293T 细胞的荧光素酶活性检测;E:重组质粒转染 HEK293T 细胞的 EGFP 表达的检测;***P < 0.001;n = 3;标尺 = 1 mm]Figure 1 Construction and identification of recombinant plasmid pc-IRE-LE [A:Recombinant plasmid pc-LE was identified by Hind III and Xba I digestion (M:DNA marker; 1:Incorrect transformant; 2 - 3:Plasmid pc-LE); B:Recombinant plasmids were identified by Hind III and Bgl II (M:DNA marker; 1:Incorrect transformant; 2:Plasmid pc-IRE-LE; 3:Plasmid pc-minP-LE); C:Schematic diagram of recombinant plasmid pc-IRE-LE; D:Detection of luciferase activity in HEK293T cells transfected with recombinant plasmids; E:Detection of EGFP expression in HEK293T cells transfected with recombinant plasmids; ***P < 0.001; n = 3; Scale bar = 1 mm]
首先将重组质粒 pBluescript II SK-LE 通过Hind III 和XbaI 双酶切获得合成的融合基因序列(约 2.4 kb)连接至 pcDNA3.0 质粒的多克隆位点,酶切鉴定结果如图1A 所示。2 号、3 号克隆 的酶切片段大小正确,选取 2 号克隆命名为 pc-LE 并用于后续实验。随后将同时包含 FoxO1 结合位点(5 × IRE)和基本启动子(minimal promoter,minP)的片段(约 70 bp)以及只含 minP 的片段(约 30 bp)连接至重组质粒 pc-LE 报告基因上游,酶切鉴定结果如图1B 所示,其中 2 号、3 号克隆大小正确,随后测序鉴定序列均正确,分别命名为 pc-IRE-LE 及 pc-minP-LE。pc-IRE-LE 重组质粒示意图如图1C 所示。
将上述构建的重组质粒 pc-IRE-LE 转染至 HEK293T 细胞,并分别对其荧光素酶和绿色荧光蛋白报告基因的活性进行检测。检测结果显示转染 pc-minP-LE 较转染 pcDNA3.0 的细胞而言,荧光素酶活性显著增加了 50 余倍(P< 0.001,图1D),绿色荧光蛋白表达也显著增强(图1E),说明重组质粒 pc-minP-LE 荧光素酶和绿色荧光蛋白都可以正常表达。与转染对照质粒 pc-minP-LE 相比,转染 pc-IRE-LE 的细胞的荧光素酶活性显著增强了 1.5 倍(P< 0.001,图1D),绿色荧光蛋白表达量也明显增加(图1E)。结果表明 FoxO1 结合位点的存在显著增强了下游双报告基因的活性,说明转染 pc-IRE-LE 的细胞可用于构建 FoxO1 抑制剂高通量筛选模型。
2.2 FoxO1 抑制剂高通量筛选模型的优化
首先通过改变脂质体转染试剂 LipofectamineTM3000 的用量对重组质粒 pc-IRE-LE(0.1 μg)的转染效率加以考察。通过优化重组质粒 DNA 和转染试剂两者比例,确定当脂质体用量为 0.3 μl 时,重组质粒 pc-IRE-LE 的转染效率最高,荧光素酶的表达具有显著的增强作用(图2A),绿色荧光蛋白的表达也有所增加(图2B)。

图2 FoxO1 抑制剂高通量模型筛选条件优化(A:不同剂量转染试剂对该模型荧光素酶活性的影响;B:不同剂量转染试剂对该模型 EGFP 的影响;C:不同浓度 DMSO 对该模型的荧光素酶活性的影响;D:0.5% DMSO 对该模型的 EGFP 表达的影响;***P < 0.001 vs 溶剂对照;n = 3;标尺 = 1 mm) Figure 2 Optimization of screening conditions of high-throughput model for FoxO1 inhibitor (A:Effect of different doses of transfection reagent on the luciferase activity in this model; B:Effect of different doses of transfection reagent on the expression of EGFP in this model; C:Effect of different concentrations of DMSO on the luciferase activity in this model; D:Effect of 0.5% DMSO on the expression of EGFP in this model; ***P < 0.001 vs veh; n = 3; Scale bar = 1 mm)
二甲基亚砜(DMSO)作为待筛选化合物的主要溶剂,对细胞活性和生长有一定的影响。因此我们考察了不同浓度 DMSO 对重组质粒 pc-IRE-LE 转染 HEK293T 细胞的荧光素酶及绿色荧光蛋白活性的影响。结果如图2C 所示,1% 及以内浓度的 DMSO 均不会影响细胞荧光素酶的活性。结合化合物库的情况,最终我们确定化合物筛选用浓度为 10 μg/ml,DMSO 终浓度为 0.5%,该浓度对细胞内绿色荧光蛋白的表达无影响(图2D)。
2.3 FoxO1 抑制剂高通量筛选模型的评价
实验室前期构建了 FoxO1 表达质粒 pc-FoxO1,我们通过转染质粒 pc-FoxO1 至 HEK293T 细胞从而表达 FoxO1(图3A),检测构建模型的反应性。以不同的转染比例(0:1、0.5:1、1:1、2:1、3:1 和 5:1)将重组质粒 pc-FoxO1 和 pc-IRE-LE 共转染至 HEK293T 细胞,通过检测双报告基因从而对该细胞筛选模型加以考察。荧光素酶报告基因检测结果显示,随着 FoxO1 表达量的增加,荧光素酶活性显著增强(P< 0.001,图3B)。同时,FoxO1 基因的过表达也可明显增加绿色荧光蛋白的表达(图3C)。以上结果说明该模型能够灵敏且合理地反映 FoxO1 对 IRE 的调节作用。
为了模拟高糖病理状态下的细胞,我们在完全无糖的培养基中加入不同浓度的葡萄糖,以检测本模型对糖的反应并且获得能刺激 FoxO1 表达的葡萄糖最佳作用浓度。结果如图3D 所示,在一定范围内,随着葡萄糖浓度的增加,荧光强度也随之增加。当葡萄糖浓度为 4.5 g/L 时,荧光强度基本达到饱和,且该浓度符合人体高糖病理细胞所能达到的葡萄糖浓度[26]。所以,我们最终确定添加 4.5 g/L 的葡萄糖用于后续化合物的筛选。
AS1842856 是一个已报道的 FoxO1 小分子抑制剂,可通过影响 FoxO1 与其靶基因启动子区的结合从而抑制其对下游靶基因的调节作用[27]。与 溶剂对照相比,AS1842856(1 μmol/L)作用后,荧光素酶活性显著下降 50%(P< 0.001,图3E),说明 AS1842856 可以显著抑制 FoxO1 的结合活性。我们进一步检测了化合物 AS1842856 作用的量效关系,通过荧光素酶活性检测发现 AS1842856 可剂量依赖地抑制 FoxO1 的结合活性,量效关系曲线如图3G 所示,经计算其 IC50为 1.2 μmol/L。AS1842856(1 μmol/L)也可明显抑制绿色荧光蛋白的表达(图3F)。
利用该阳性化合物 AS1842856 对本模型进行了高通量筛选的进一步评价,以荧光素酶活性定量计算筛选窗相关系数 Z' 因子为 0.56,符合高通量筛选的要求。除此之外,我们通过对信噪比(S/N)、信号本底比(S/B)和信号本底变异系数(CV%)等各项参数从不同的角度对模型的置信程度、灵 敏度、重现性和有效性做出衡量和评价,根据细胞表达荧光素酶活性的变化,上述参数的结果分别 为 4.27、32.52 和 2.35,均符合高通量筛选标准。综上评价,说明该模型构建成功并可用于高通量 筛选。
2.4 FoxO1 抑制剂高通量筛选模型的应用
本工作构建的 FoxO1 抑制剂高通量筛选模型经过优化和评价之后,应用该模型对国家新药(微生物)筛选实验室样品库进行高通量筛选,初步 筛选了 6000 余个化合物,初筛获得阳性化合物 110 个,初筛阳性率为 1.83%(图4A)。对初筛阳性化合物进行复筛,最终获得阳性化合物 6 个,阳性率为 0.15%。这些化合物均可剂量依赖地抑制荧光素酶报告基因的表达(图4B),同时还可明显减少绿色荧光蛋白的表达(图4C)。以上结果均说明筛选获得的阳性化合物在模型上均有一定的 FoxO1 抑制剂活性。为了进一步在细胞水平验证这些阳性化合物的 FoxO1 抑制活性,我们首先利用 MTT 比色法检测了不同浓度的阳性化合物对 HEK293T 细胞存活的影响。结果显示,这些阳性化合物在 10~50 μg/ml 之间的浓度时,细胞存活率为对照组的 85% 以上,而低于 10 μg/ml 时,化合物对细胞的生长存活没有影响(图4D)。
2.5 筛选获得的阳性化合物对 FoxO1 靶基因表达的影响
糖异生关键酶葡萄糖 6 磷酸酶(G6Pase)和磷酸烯醇式丙酮酸羧激酶(PEPCK)[22]、载脂蛋白 apoC-III 和微粒体甘油三酯转运蛋白(MTP)[23]是 FoxO1 转录因子的靶基因。为了确定 FoxO1 抑制剂筛选模型筛选获得的阳性化合物是否影响 FoxO1 靶基因的表达,我们检测了 HepG2 细胞中 PEPCK、G6Pase、apoC-III 和 MTP 的 mRNA 的表达水平,结果如图5所示,已知阳性化合物 AS1842856 对 PEPCK、G6Pase、apoC-III 基因均有显著的抑制作用,其结果与文献[27]报道一致,而对 MTP 则表现出上调的作用。而经该模型筛选获得的阳性化合物中,化合物 7625-H9 除可显著性降低 PEPCK、G6Pase、apoC-III 的 mRNA 水平外,还可以显著抑制 MTP 的表达。某些阳性化合物如 7018-B3、7039-E6、7058-F2 等表现出对某些靶基因的抑制作用不明显或者有上调作用,相关机制有待于进一步的讨论和研究。

图3 FoxO1 抑制剂高通量筛选模型的评价[A:质粒 pc-FoxO1 对 HEK293T 细胞中 FoxO1 mRNA 水平的影响;B:过表达 FoxO1 对该模型中荧光素酶活性的影响(***P < 0.001 vs 0:1);C:过表达 FoxO1 对该模型中 EGFP 表达的影响(pc-FoxO1:pc-IRE-LE = 5:1 的比例共转染);D:不同浓度葡萄糖对该模型的影响;E:AS1842856(1 μmol/L)对该模型中荧光素酶活性的影响;F:AS1842856(1 μmol/L)对该模型中 EGFP 表达的影响;G:AS1842856 在该模型中的量效关系曲线;***P < 0.001;n = 3;标尺 = 1 mm]Figure 3 Evaluation of high-throughput screening model for FoxO1 inhibitors [A:Effect of FoxO1 mRNA level by plasmid pc-FoxO1 in HEK293T cells; B:Effect of overexpression of FoxO1 on luciferase activity in this model (***P < 0.001 vs 0:1); C:Effect of overexpression of FoxO1 on EGFP expression in this model (pc-FoxO1:pc-IRE-LE=5:1,co-transfected); D:Effect of different concentration of glucose in this model; E:Effect of AS1842856 (1 μmol/L) on luciferase activity in this model; F:Effect of AS1842856 (1 μmol/L) on EGFP expression in this model; G:Dose-effect curve of AS1842856 in this model; ***P < 0.001 vs veh; n = 3; Scale bar = 1 mm]
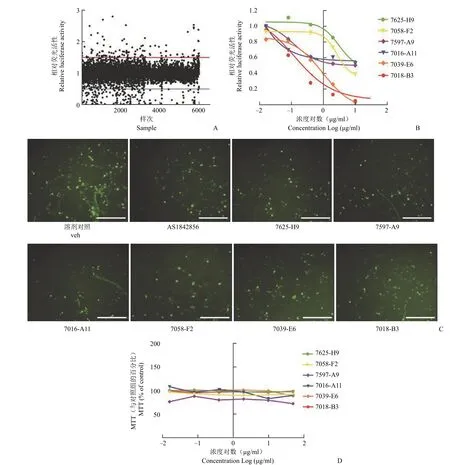
图4 FoxO1 抑制剂高通量筛选模型的应用(A:利用该模型对化合物初步筛选的结果;B:该模型阳性化合物的量效关系曲线;C:10 μg/ml 阳性化合物对该模型 EGFP 表达的影响;D:该模型阳性化合物在 HEK293T 细胞上的细胞毒性检测;veh 为溶剂对照即 0.5% DMSO;标尺 = 1 mm) Figure 4 Application of the high-throughput screening model for FoxO1 inhibitors (A:Results of preliminary screening of compounds using this model; B:Dose-effect curves of positive compounds of this model; C:Effect of 10 μg/ml positive compounds on the EGFP expression in this model; D:Cytotoxicity assay of positive compounds in HEK293T cells; 0.5% DMSO; Scale bar = 1 mm)
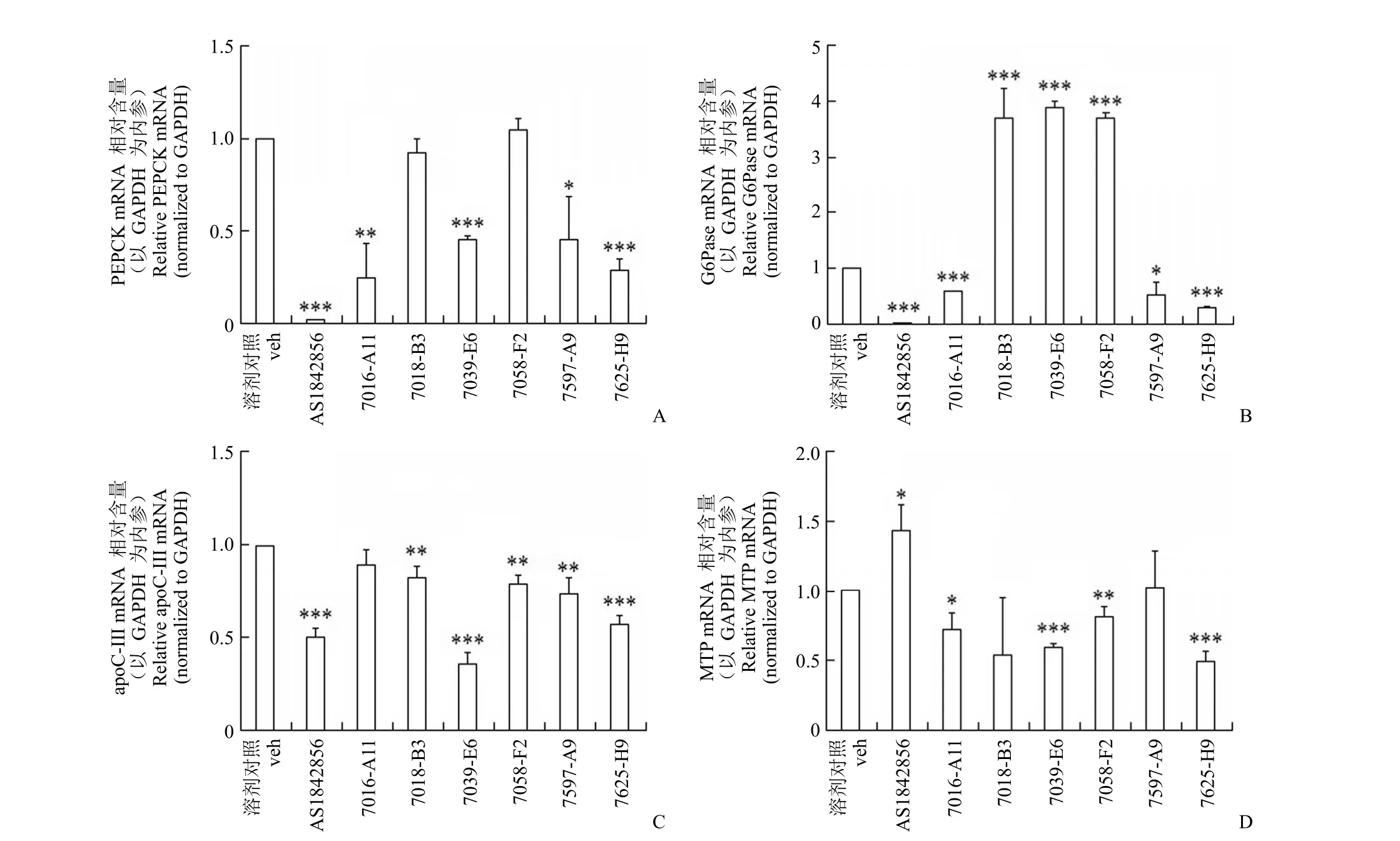
图5 阳性化合物对 HepG2 细胞中不同 FoxO1 靶基因 mRNA 水平的影响(A:化合物对 PEPCK mRNA 水平的影响;B:化合物对 G6Pase mRNA 水平的影响;C:化合物对 apoC-III mRNA 水平的影响;D:化合物对 MTP mRNA 水平的影响;化合物的浓度均为 10 μg/ml;*P < 0.05,**P < 0.01,***P < 0.001;n = 3) Figure 5 Effects of positive compounds on the mRNA levels of FoxO1 target genes in HepG2 cells (A:Effect of compounds on the mRNA level of PEPCK; B:Effect of compounds on the mRNA level of G6Pase; C:Effect of compounds on the mRNA level of apoC-III; D:Effect of compounds on the mRNA level of MTP; The concentration of compounds is 10 μg/ml; *P < 0.05,**P < 0.01,***P < 0.001; n = 3)
3 讨论
目前高通量药物筛选是应用较为广泛的一种药物研发手段。增强型绿色荧光蛋白是一种优化的绿色荧光蛋白,具有诸多优点,如结构稳定、高效表达、检测便捷、无种系依赖性等,是常用的荧光蛋白类报告基因之一[28]。但 EGFP 信号不易定量检测,适用于初步定性分析。荧光素酶基因是一种具有灵敏度高、线性范围广、适用于定量检测等特点的报告基因[29],但其检测费用较高。因此通过构建同时含有这两种报告基因的重组质粒,可以整合两者的优势,应用更加准确及便利。P2A 是一种具有自我加工能力的短肽,最早被研究鉴定的 2A 肽源于口蹄疫病毒,其剪切蛋白的功能是经核糖 体“跳跃”而不是通过蛋白酶水解作用来实现 的[24,30]。将两个基因克隆到 P2A 序列的两侧构建融合基因,翻译出的多聚蛋白会在编码 P2A 区域的 C 末端断裂为两个蛋白,产生 C 端融合了 P2A 的上游荧光素酶蛋白和完整的下游绿色荧光蛋白[31-33]。使用核糖体进入位点(internal ribosome entry site,IRES)也是较为常用的连接两种报告基因的方式,但是 IRES 后面的 ORF 翻译蛋白的水平有可能与 IRES 前面的 ORF 蛋白水平不一致,导致两种蛋白表达量差异较大。而 P2A 则可保证两种蛋白的表达量基本一致,两者的摩尔比理论上是 1:1。因此本文利用双报告基因的优势,在 HEK293T 细胞中实现 Luc2 和 EGFP 两个报告基因的同时表达,通过荧光显微镜检测绿色荧光的强度可初步筛选出阳性化合物,随后利用荧光素酶活性检测进行进一步验证,既节约成本又能提高筛选效率,保证实验的准确性。
我们对该细胞模型进行了多方面深入的评价。首先利用重组质粒 pc-FoxO1 转染 HEK293T 细胞从而过表达细胞中的 FoxO1,随着 FoxO1 表达量的增加,该模型的两个报告基因的表达或活性也 均有显著性的增强,说明模型对 FoxO1 信号敏感,可以利用该模型筛选 FoxO1 调节剂。再者,动物实验研究表明,2 型糖尿病小鼠的肌肉组织和肝组织中 FoxO1 的表达量明显高于对照组[34]。所以,为了模拟高糖病理状态下的细胞,我们检测了不同葡萄糖浓度条件下双报告基因的响应情况且获得筛选用最佳葡萄糖作用浓度,为更合理地筛选出糖脂代谢相关的 FoxO1 抑制剂奠定基础。葡萄糖浓度上调,该模型两个报告基因的表达或活性也均有显著增强,与文献[27]报道一致,说明模型对葡萄糖信号敏感,模型可靠性强,结果具有可信度。然后,利用 FoxO1 小分子抑制剂 AS1842856 作为评价本筛选模型的阳性化合物。通过检测荧光素酶活性发现,AS1842856 可使荧光素酶活性显著下降 50%,并且 AS1842856 可剂量依赖地抑制 FoxO1 的结合活性,与文献[27]报道一致,可用于对 FoxO1 抑制剂进行筛选。最后,我们对筛选窗相关系数(Z' 因子)、信噪比(S/N)、信号本底比(S/B)和信号本底变异系数(CV%)等各项参数进行检测,从不同的角度对模型的置信程度、灵敏度、重现性和有效性做出衡量和评价,上述参数均符合高通量筛选标准。综上所述,我们通过增加或抑制 FoxO1 的表达或活性,多方位全面地对该模型进行了评价,证实该筛选模型可靠、有效,可用于 FoxO1 抑制剂的高通量筛选。
通过动物模型和人类疾病的大量研究,发现 FoxO1 在 T2DM 以及 NAFLD 等许多疾病发病机制中都扮演着关键角色[6-8,35-37]。进食后,胰岛素可通过信号通路激活激酶 PI3K/Akt,进而磷酸化 FoxO1 使其转运出核,导致其转录活性被抑制,从而抑制 FoxO1 所调控的下游靶基因的表达。研究报道,黄酮类化合物可通过使 FoxO1 出核并增强高脂饮食喂养和 db/db 小鼠的肝脏和脂肪组织中的 Akt 和 FoxO1 的磷酸化来防止 T2DM[38]。枸杞多糖(LBPs)可减少大鼠肝脏中非酒精性脂肪肝炎(NASH)引起的损伤,在 NASH 大鼠中,PI3K/Akt 的肝活性受到抑制,所以 FoxO1 活性增加。LBP 的添加则逆转了 PI3K/Akt/FoxO1 途径的变化,表明 FoxO1 的活化可加剧 NASH[39]。这些具有 FoxO1 抑制活性的化合物有望作为具有抗糖尿病治疗前景的先导化合物进行后续的开发与应用。本研究通过构建 FoxO1 抑制剂高通量筛选模型将有助于筛选获得新的 FoxO1 抑制剂,有望成为糖脂代谢相关疾病的先导化合物。通过筛选,我 们共获得 6 个有明显剂量-效应关系的阳性化合物,但是不同化合物对下游靶基因的作用具有差异性。如化合物 7018-B3、7039-E6、7058-F2 等表现出对某些靶基因的抑制作用不明显或者有上调作用。推测其原因可能是这些化合物不仅抑制 FoxO1 与 IRE 位点的结合作用,还作用于其他转录因子或者调控蛋白,通过其他通路直接或者间接地作用于这些靶基因,相关机制有待于进一步的研究。化合物 7625-H9 对 FoxO1 多个靶基因(PEPCK、G6Pase、apoC-III 和 MTP)均具有显著抑制作用,虽然活性不及已知阳性化合物 AS1842856,但是该化合物对 MTP 也具有显著下调作用,推测其对 FoxO1 调节特异性可能优于 AS1842856,相关机制还有待于进一步研究。
总之,FoxO1 在体内的作用十分复杂,与人体多种疾病的发生发展密切相关,近些年来仍是科学研究的热点。FoxO1 抑制剂的发现将为糖脂代谢相关疾病的药物发现带来新的可能,为临床治疗开辟新的路径。
本工作成功构建了含双报告基因的 FoxO1 抑制剂高通量筛选细胞模型。在对该模型进行了优化及评价后,应用本模型对化合物样品库中的样品进行筛选,并对筛选获得的阳性化合物的生物活性进行了验证。阳性化合物 7625-H9 等多个化合物可显著抑制 FoxO1 的活性以及 FoxO1 下游糖脂代谢相关靶基因的表达,有望发展为新型调节糖脂代谢的先导化合物,而该模型也为今后药物的发现及研究提供了可靠有效的方法。

