抗缪勒管激素用于戈舍瑞林在年轻乳腺癌患者化疗期间保护卵巢储备功能的评价
王思源,王 殊
(北京大学人民医院乳腺外科, 北京 100044)
乳腺癌是育龄期女性最常见的恶性肿瘤,我国乳腺癌发病年轻化趋势较欧美国家更加显著[1]。随着乳腺癌早期诊断及综合治疗水平的提高,特别是当前精准治疗手段的介入,乳腺癌的远期预后得到了明显改善[2]。半世纪前就有文献报道化疗可导致年轻乳腺癌患者卵巢储备下降及卵巢早衰[3-6],不育症大幅度降低了年轻乳腺癌患者治疗后的生活质量。近十年,越来越多的研究显示年轻的患者化疗期间联用促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist, GnRHa),如戈舍瑞林,月经自然恢复率会显著提高[7-10]。但值得注意的是,《美国国立综合癌症网络(NCCN)指南》[11]明确指出月经和生育能力并没有必然的联系,例如口服他莫昔芬内分泌治疗的年轻乳腺癌患者,虽然月经不规律,但不意味着生育能力的降低。抗缪勒管激素(anti-Müllerian hormone,AMH)是转化生长因子β(transforming growth factor-β, TGF-β)超家族成员,是由卵巢窦前卵泡和小窦卵泡的颗粒细胞分泌的一种糖蛋白。因AMH血清水平的高低与卵巢中卵泡的数量和质量具有相关性,并且在月经周期中波动较小,近年来在生殖医学领域中成为优于年龄、雌二醇(estradiol, E2)、促卵泡激素(follicle-stimulating hormone,FSH)和抑制素B的反映卵巢储备的最佳指标[12-14],但目前缺乏根据AMH在化疗前后的动态变化支持戈舍瑞林保护年轻乳腺癌患者卵巢储备功能的数据。本研究旨在通过监测AMH在化疗前和化疗结束后1年内的动态变化,评价戈舍瑞林在年轻乳腺癌患者化疗期间保护卵巢储备功能的效果。
1 资料与方法
1.1 资料
1.1.1患者分组 选择2015年12月至2017年6月在北京大学人民医院乳腺外科诊疗的年轻乳腺癌患者101位,经充分告知后根据患者意愿,无干预分至化疗联合戈舍瑞林组(戈舍瑞林组)和单纯化疗组(化疗组)。患者入组标准:年龄≤45岁;病理分期Ⅰ~Ⅲ;有(新)辅助化疗计划;入组前3个月月经周期规律。排除标准:长期口服避孕药;既往接受过化疗;既往接受双侧卵巢切除手术或卵巢放疗;内分泌治疗方案计划含GnRHa;基线血清AMH<0.4 μg /L。本研究开始前获得北京大学人民医院医学伦理委员会审查批准(2015PHB 181-01),所有入组患者均签署知情同意书。
1.1.2实验材料 AMH ELISA试剂盒购自美国Beckman Coulter公司,测定由北京大学人民医院检验科完成。
1.2 方法
1.2.1监测指标 在化疗+/-戈舍瑞林开始前、化疗开始后每周期化疗的第1天、化疗结束后半年、化疗结束后1年,连续监测两组患者的血清AMH和月经状态。
1.2.2用药方法 戈舍瑞林组患者在化疗开始前至少一周皮下注射戈舍瑞林(3.6 mg,英国Astra Zeneca公司)。化疗期间每28天注射1次直至最后1次化疗结束前2周或结束后2周。两组患者化疗方案的选择根据病情而定,常规方案包括:蒽环类药物+环磷酰胺4周期(AC),蒽环类药物+环磷酰胺4周期序贯紫杉类药物4周期(AC-T),蒽环类药物+环磷酰胺4周期序贯紫杉类药物+曲妥珠单抗4周期(AC-TH)。其他方案包括:蒽环类药物+紫杉类药物6周期(TA),紫杉类药物+卡培他滨6周期(TX),多西他赛+卡铂+曲妥珠单抗6周期(TCH)。激素受体阳性的患者在化疗结束后连续口服他莫昔芬内分泌治疗(10 mg,每日两次)。
1.2.3研究终点 首要研究终点是化疗结束后1年AMH低水平(<0.4 μg /L), 次要研究终点是化疗结束后1年闭经(入组后停经时间连续超过12个月)。
1.3 统计学分析
应用SPSS 19.9软件,利用卡方检验或Fisher’s 精确检验进行两组患者临床病理资料之间的比较,以及化疗结束后1年AMH低水平率和闭经率的比较。亚组分析包括:年龄(≤40岁和41~45岁)和化疗方案(AC、AC-T、AC-TH)、辅助内分泌治疗(是否口服他莫昔芬)。P<0.05为差异有统计学意义。
2 结果
2.1 患者
51位患者选择单纯化疗(化疗组),50位患者选择化疗联合戈舍瑞林保护卵巢功能(戈舍瑞林组)。两组患者的临床病理基线资料如表1。经比较,更多的未婚(16.0%vs. 2%)、未育(22.0%vs.3.9%)、生育意愿强烈(66.0%vs. 3.9%)、成功保乳(60%vs.31.4%)、雌激素受体(estrogen veceptor, ER)阴性(50%vs.25.5%)、孕激素受体(progesterone receptor, PR)阴性(50%vs. 29.4%)、处于疾病Ⅰ期或Ⅱ期的(96.0%vs. 80.4%)乳腺癌患者,在化疗开始前选用戈舍瑞林保护卵巢功能。
2.2 化疗结束后1年AMH低水平和闭经
化疗结束后1年,化疗组患者AMH低水平率为74.5%(38/51),显著高于戈舍瑞林组患者 38.0%(19/50,P<0.001)。两组患者的闭经率也与AMH低水平率相一致,化疗组患者为56.9%(29/51),戈舍瑞林组为 24.0%(12/50,P=0.001,图1A)。戈舍瑞林组AMH恢复的31位患者中,有22位(71.0%)是在化疗结束后6个月内升至0.4 μg /L以上,多于化疗组(7/13,53.8%)。相似地,戈舍瑞林组月经恢复的38位患者中,有30位(78.9%)是在化疗结束后6个月内恢复的,多于化疗组(12/22,54.5%)。亚组分析中,无论年龄分组(≤40岁和41~45岁)、化疗方案分组(AC、AC-T、AC-TH)或化疗后是否口服他莫昔芬分组,戈舍瑞林组患者的血清AMH值和月经均恢复得更多(图1B~1D)。特别是在化疗结束后1年,化疗组月经恢复的22人中有8人(36.4%)、戈舍瑞林组月经恢复的38人中有7人(18.4%)AMH仍处于低水平。
2.3 化疗过程中AMH和月经的动态变化
化疗组20位患者和戈舍瑞林组21位患者可用于评估化疗过程中AMH和月经状态的动态变化。在化疗+/-戈舍瑞林开始前,此后每周期化疗的第1天连续检测AMH并记录月经状态。化疗组的患者,其AMH均值在化疗开始后快速下降,在第3周期化疗前降至极低水平(0.11 μg /L),此时70%的患者还未出现停经。而戈舍瑞林组的患者,在第3周期化疗前已全部出现停经现象,但其AMH均值仍在0.4 μg /L以上(图2)。

表1 两组患者的基线临床病理特征Table 1 Baseline characteristics of the patients in the two groups
*Chi-square test, or Fisher’s exact test when one of the cell is smaller than 5. ER, estrogen receptor; PR, progesterone receptor; HER-2, human epidermal growth factor receptor-2. AC, anthracycline plus cyclophosphamide; AC-T, anthracycline plus cyclophosphamide followed by taxane; AC-TH, anthracycline plus cyclophosphamide followed by taxane plus trastuzumab.
3 讨论
随着中国女性首次妊娠年龄的推迟,特别是近些年我国已全面实施一对夫妇可生育两个孩子政策,越来越多的年轻乳腺癌患者在综合治疗前有着强烈的生育意愿,这就要求乳腺专科医生在制定个体化治疗方案的同时,必须考虑化疗期间如何保护卵巢储备功能的问题。2011年Del Mastro等[15]发表于JAMA的PROMISE-GIM6研究报道,化疗期间使用GnRHa可使早期绝经前乳腺癌患者在化疗结束1年时卵巢功能早衰的发生率下降17%(8.9%vs. 25.9%,P<0.001)。而同年Gerber等[16]在JClinOncol上发表了GBG 37 ZORO的研究结果,结论为GnRHa的卵巢功能保护作用缺乏临床和统计学意义。2012年Munster等[17]在JClinOncol发表的研究结果也显示GnRHa组与化疗组在化疗结束后月经恢复率与中位月经恢复时间没有差别。2015年发表于NEnglJMed的S0230/POEMS研究报道,戈舍瑞林联合化疗,对<50岁早期激素受体阴性的乳腺癌女性能显著降低其化疗结束后2年的卵巢早衰率(8%vs. 22%,P=0.02),此外实现怀孕分娩的比例也在化疗+戈舍瑞林组更高[8]。2018年Lambertini等[10]在JClinOncol上发表的Meta分析共纳入5项研究,共873例患者(GnRHa组436例,对照组437例), 结果显示GnRHa可显著降低早发性卵巢功能不足(premature ovarian insufficiency, POI)率,GnRHa组POI率为 14.1%,对照组为 30.9%(OR=0.38,95%CI0.26~0.57,P=0.001), 且该结果在亚组分析中较为统一,多因素分析显示只有GnRHa与年龄是与POI率相关的独立影响因素。在妊娠率方面,GnRHa组治疗后的妊娠率较对照组提高了近一倍(10.3%vs. 5.5%,IRR=1.83, 95%CI: 1.06~3.15,P=0.03),该分析对GnRHa保护年轻乳腺癌患者生育能力的有效性提供了证据。然而GnRHa在化疗期间保护卵巢的机制尚不完全清楚,仅是推测是通过抑制下丘脑-垂体-性腺轴,阻止原始卵泡的募集及进一步的发育成熟,可能会减少化疗药物对卵巢的损伤。加之各项研究结论不全一致,且多项研究的观察终点都是定义为闭经,缺乏针对卵巢生育能力储备指标的数据支持,故化疗联用GnRHa是否可以保留年轻患者的生育能力仍存在争议,该方法暂未写入《欧洲圣加伦(St.Gallen)指南》及《欧洲肿瘤内科学会指南》中。

A, overall; B, sub-groups of age; C, sub-groups of chemotherapy regimen; D, sub-groups of tamoxifen; CT, chemotherapy group; G, goserelin group.图1 两组患者化疗结束后1年的AMH低水平率和闭经率Figure 1 Rates of the low AMH value and amenorrhea at the end of 1 year after chemotherapy of the patients in the two groups
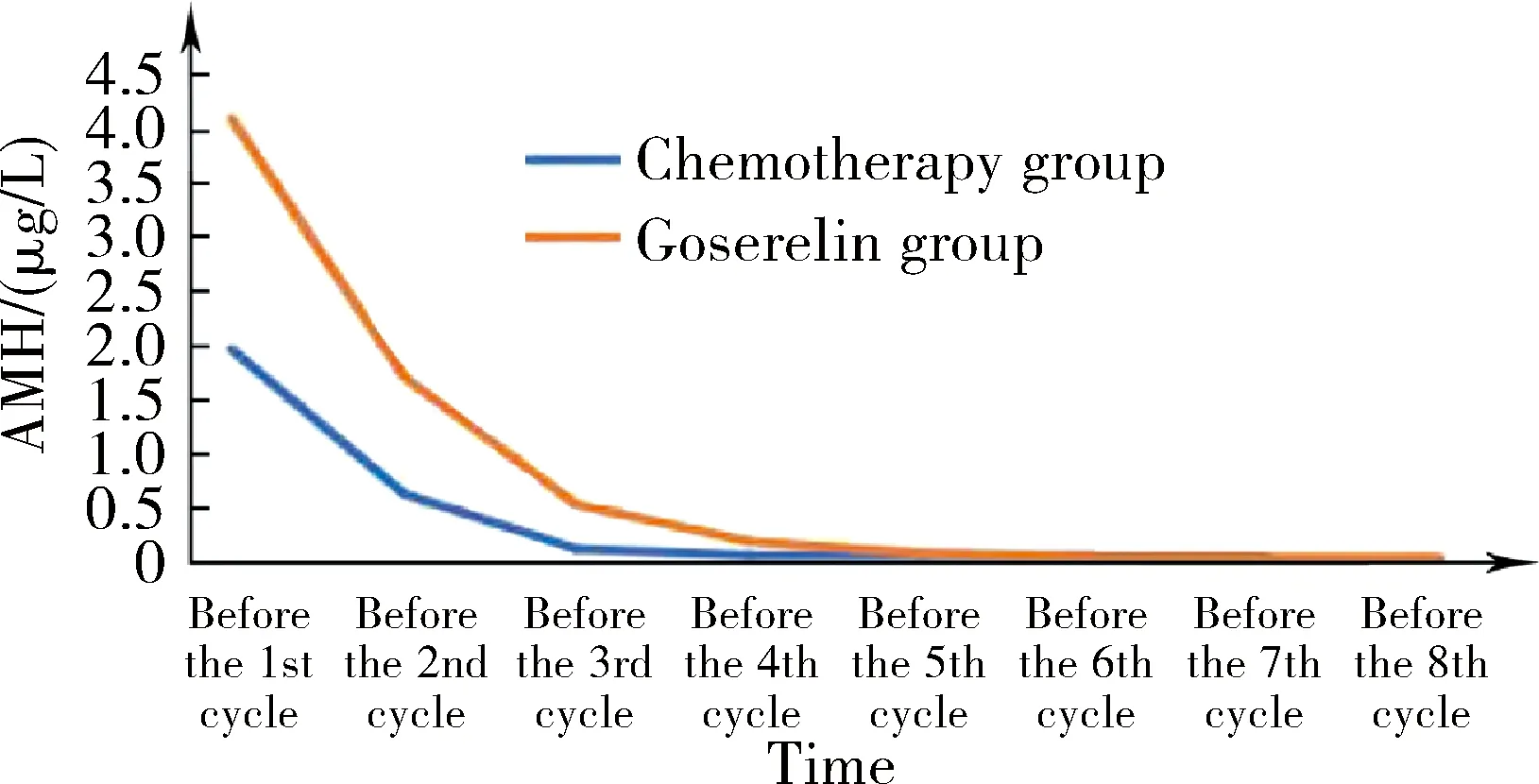
图2 两组患者化疗期间AMH均值的动态变化Figure 2 Dynamic changes of the mean anti-Müllerian hormone (AMH) of the patients in the two groups during chemotherapy
近年AMH因其高灵敏性和稳定性,已成为生殖医学领域反映卵巢储备的首选生化指标。育龄期女性血清AMH数值越高,提示生育能力越强。若AMH值<0.4 μg /L,则意味卵巢储备功能衰竭。本研究比较了戈舍瑞林组和化疗组患者在化疗结束后1年的AMH低水平率,化疗组高出戈舍瑞林组近1倍(74.5%vs. 38.0%,P<0.001)。两组闭经率的比较结果亦相似(56.9%vs. 24.0%,P=0.001), 并且保护组的患者更多地在化疗结束后6个月内恢复月经和AMH,均提示联合戈舍瑞林治疗,不仅能降低化疗诱导性闭经的发生,还可减少育龄期患者卵巢中原始卵泡的损伤。该结论在亚组分析中亦得到了一致性的结果,40岁以上的患者本身在化疗前卵巢储备较弱,故化疗后1年的AMH低水平率和闭经率均高于40岁及以下的患者,但戈舍瑞林仍可减少化疗药物对她们卵巢储备的损伤。4周期AC方案序贯4周期T(H)方案后,卵巢功能持续受损,故序贯T(H)后AMH低水平率和闭经率均高于AC方案,戈舍瑞林也可持续降低8个周期化疗药物对患者原始卵泡的破坏。无论患者在化疗后是否口服他莫昔芬,化疗联用戈舍瑞林仍可降低闭经率和AMH低水平率。因他莫昔芬会影响绝经前患者的月经周期,故无论是否联用戈舍瑞林,口服他莫昔芬患者的闭经率都会高于同组不服他莫昔芬患者的闭经率。
值得注意的是,化疗结束后1年,化疗组月经已恢复的患者中,有36.4%(8/22)其AMH仍处于低水平,而在戈舍瑞林组这一数值为18.4%(7/38),提示决定月经来潮的卵巢分泌功能,与由留存的原始卵泡数所决定的卵巢储备功能,两者在化疗后的恢复也许是不同步的。类似地,在化疗过程中两组患者AMH水平下降至低水平的时间和停经出现的时间也是不同步的。化疗组的患者在第3周期化疗前,其AMH均值降至极低水平,但此时70%的患者还未出现停经,提示卵泡受损导致卵巢储备功能下降先于卵巢分泌功能的降低。而戈舍瑞林组的患者,在第3周期化疗前,即注射戈舍瑞林2次后,已全部出现停经现象,但此时其AMH均值还未降至低水平范围,可能原因是GnRHa阻断下丘脑-垂体-性腺轴后,卵巢分泌功能迅速受到抑制,雌激素水平大幅度降低导致停经现象的快速出现,而此时可能还有未休眠的窦前卵泡或窦卵泡在生长,故血清AMH值未能将至低水平。以上现象均符合《美国国立综合癌症网络(NCCN)指南》中[11]所提及的“月经和生育能力并没有必然的联系”的说法,因而采用可反映卵巢生育能力储备的生化指标AMH,应比月经状态更能精准评价戈舍瑞林在年轻乳腺癌患者化疗期间保护卵巢储备的功效。
综上所述,越来越多的有生育意愿的年轻乳腺癌患者会选择GnRHa联合化疗保护卵巢储备功能,从而提高治疗后的生活质量。因本研究选择戈舍瑞林联合治疗的患者在化疗结束后1年内其血清AMH值更多、更早的恢复,提示化疗期间更多的原始卵泡得以保留,故对戈舍瑞林保护年轻乳腺癌患者卵巢储备功能的有效性提供了证据。相比月经状态,AMH更能精准地用于临床评价化疗前后年轻乳腺癌患者的卵巢储备功能。今后可在AMH对年轻乳腺癌患者治疗结束多久可以妊娠、预测妊娠成功率、推测绝经时间等方面进行进一步深入研究,期待这一新的临床评价指标为有强烈生育意愿的年轻乳腺癌患者带来希望。

