‘凤丹’牡丹叶轴多糖超声辅助提取工艺优化及抗氧化性研究
马晓,陈刚,梁盼
(1.河南职业技术学院,河南 郑州 450046;2.郑州师范学院,河南 郑州 450044)
‘凤丹’牡丹为芍药属落叶亚灌木,是中国栽培牡丹品种的近缘野生种之一[1]。‘凤丹’牡丹又称为铜陵牡丹、铜陵凤丹,属于江南品种群,其根皮具有解热、阵痛和消炎等医用作用,是一种名贵药材,《中药大辞典》明文记载:“安徽省铜陵凤凰山所产丹皮质量最佳”,所以被称为凤丹[2]。近期研究表明,凤丹牡丹种子出油率为27%~33%,籽油含大量不饱和脂肪酸(>90%),特别是α-亚麻酸含量达39%以上。由于α-亚麻酸对于保护心血管、抑制癌症发生等具有显著的生理活性,具有较高的医疗保健价值[3]。因此,‘凤丹’不仅有一定的观赏价值,还可以体现其药用价值和油用价值[4]。
多糖是一种能维持人体生命活动正常运转的重要生物大分子[5]。植物多糖具有免疫调节、抗肿瘤、抗衰老、降血糖等多种生物活性、毒副作用小和不易造成残留等优点[6-7]。常用的提取方法有:热水浸提法、酸浸提法、碱浸提法和酶法[8]。近年来将超声辅助提取技术在多糖提取工艺中应用的越来越广泛[9]。植物多糖提取过程主要包含两个物理现象:细胞膜的通透性增大,多糖从细胞膜中渗出;细胞膜破裂后多糖从细胞中流出[10]。超声波辅助提取主要是通过超声波的空化作用和强烈振动使物体内部产生振荡、收缩,增加分子的运动频率和速率,破碎原料细胞壁,促进多糖的溶出,提高多糖的得率[11]。除了能够提髙提取效率外,该方法还有缩短提取时间、减少试剂消耗和降低提取温度等优点,有利于保持热稳定性较差的有效成分的结构和活性不被破坏[12]。
由于‘凤丹’牡丹的经济价值,其种植面积将逐年扩大[13],但在实践中,牡丹叶轴往往在采收种子后丢弃,不仅浪费资源,还对环境造成污染。有关优化超声辅助提取牡丹叶轴多糖工艺条件,尚未见相关报道,对其抗氧化活性也缺乏研究[14]。因此本试验以‘凤丹’牡丹叶轴作为试验材料,通过单因素试验和正交试验,优化超声辅助提取‘凤丹’牡丹叶轴多糖的最佳工艺,并对其抗氧化活性进行评价,为更好地开发与利用‘凤丹’牡丹叶轴提供依据。
1 材料与方法
1.1 材料与试剂
2017年10月在郑州采摘的七年生实生苗‘凤丹’牡丹叶轴。选取生长旺盛、无病虫害、长约35 cm,粗细均匀的叶轴,去除叶轴上的叶柄带回实验室备用。
无水乙醇、浓硫酸、过硫酸钾、葡萄糖、半乳糖、木糖、果糖、蔗糖等(均为分析纯):Sigma 公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]:合肥巴斯夫生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):阜阳曼林生物技术有限公司。
1.2 仪器与设备
智能温控双频超声波合成/萃取仪(XH-2008DE):北京祥鹄科技发展有限公司;新世纪紫外可见分光光度计(T6):北京普析通用仪器有限责任公司;电热鼓风干燥箱(DHG-9140):上海一恒科技仪器有限公司;电子天平(JA3003N):上海菁海仪器有限公司;数显恒温水浴锅(HH-S8):上海越磁电子科技有限公司;旋风磨(FOSS SCINO CT410):杭州嘉维创新科技有限公司;超纯水机(minI):湖南科尔顿水务有限公司。
1.3 试验方法
1.3.1 混标糖标准曲线的建立
参考王婉冰等[15]的方法,有改进。用天平称取50 mg的混标糖(葡萄糖、半乳糖、木糖、果糖、蔗糖,每种各10 mg)放入烧杯,加蒸馏水,搅拌,待溶解后定容至100 mL,取20 mL 再次定容至100 mL 备用。用移液枪分别量取含 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL 混标糖体积的混合液于编号1 至8 号的试管中,分别补充蒸馏水,使每支试管的溶液体积均达到1.0 mL,蒽酮硫酸比色法[16]测吸光度,拟合线性回归方程。
1.3.2 牡丹叶轴多糖的测定
牡丹叶轴清洗干净后置于干燥箱中,60 ℃烘干至恒重,用旋风磨将其粉碎后过50 目筛;称1.0 g 牡丹叶轴粉末加入相应的蒸馏水搅拌均匀,用超声波萃取器进行提取,将提取液过滤,4 000 r/min 离心10 min 后,取上清液备用。按1.3.1 的方法进行测定,重复3 次,按照标准曲线计算其多糖得率:
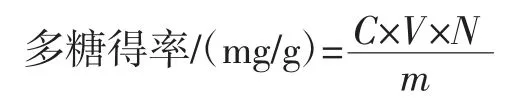
式中:C 为提取液中多糖的浓度,mg/mL;V 为提取上清液体积,mL;N 为稀释倍数;m 为样品质量,g。
1.3.3 牡丹叶轴多糖提取的单因素试验
在液料比为 20 ∶1(mL/g)、超声时间为 40 min、超声功率为250 W 的条件下,考察超声温度为20、30、40、50、60、70 ℃对多糖得率的影响。
在超声温度为50 ℃、超声时间为40 min、超声功率为 250 W 的条件下,考察液料比为 8 ∶1、12 ∶1、16 ∶1、20 ∶1、24 ∶1、28 ∶1(mL/g)对多糖得率的影响。
在超声温度为 50 ℃、液料比为 20 ∶1(mL/g)、超声功率为250 W 的条件下,考察超声时间为10、20、30、40、50、60 min 对多糖得率的影响。
在超声温度为 50 ℃、液料比为 20 ∶1(mL/g)、超声时间为40 min 的条件下,考察超声功率为100、150、200、250、300、350 W 对多糖得率的影响。
1.3.4 ABTS+自由基清除率测定
参考朱玉昌等[17]的方法,有改动。称ABTS 0.096 g,用蒸馏水定容至25 mL,称0.3784 g 过硫酸钾,用蒸馏水定容至 10 mL,量取 5 mL 的 ABTS 溶液与 88 μL 的过硫酸钾溶液混合均匀,在室温(25 ℃)避光的条件下静置过夜,制成ABTS+自由基储备液,在12 h~16 h 之内测定,测定时用无水乙醇稀释,使其在734 nm 波长下的吸光度为0.7±0.02。将样品液及VC标准品配制成500、250、125、62.5、31.25、15.375、7.687 5 μg/mL 的样品液。分别取各浓度的样品液0.2 mL,加入3 mL ABTS+自由基储备液,充分混合,室温放置20 min 用紫外分光光度计在734 nm 处测定吸光值;空白管用蒸馏水替代样品液。以抗坏血酸(VC)作为阳性对照。重复3 次。按照以下公式计算清除率:
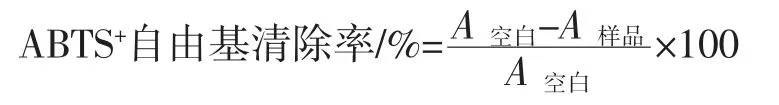
式中:A空白为蒸馏水代替样品液所测得吸光值;A样品为样品溶液所测得吸光值。
1.3.5 DPPH 自由基清除率测定
参考孙丽萍等[18]的方法,有改动。精确取0.019 7 g的DPPH 粉末,用无水乙醇溶解定容至250 mL,配制成0.2 mmol/L 的DPPH 自由基储备液,0 ℃保存。将样品液及 VC标准品配制成 500、250、125、62.5、31.25、15.375、7.6875 μg/mL 的样品液。分别取各浓度的样品液 0.5 mL,加入 2.5 mL 的 DPPH 自由基储备液,在 28 ℃恒温水浴锅中反应30 min,用紫外分光光度计于517 nm处测定吸光度,以抗坏血酸(VC)作为阳性对照。重复3次。按照以下公式计算清除率:

式中:A空白为无水乙醇代替样品液所得吸光值;A样品为样品溶液所测得吸光值。
1.4 数据处理
试验数据均为3 次重复试验的平均值,用Microsoft Excel 2010 进行整理,用SPSS13.0 对试验数据进行统计分析。
2 结果与分析
2.1 混标糖标准曲线
根据不同质量分数的混标糖溶液以及其对应的吸光度,所做的拟合线性方程为:y=0.822 4x+0.014 8,R2=0.993 5,式中:y 为吸光度值;x 为混标糖含量(mg/mL)。
2.2 单因素试验结果与分析
2.2.1 超声温度对‘凤丹’牡丹叶轴多糖得率的影响
超声温度对‘凤丹’牡丹叶轴多糖得率的影响见图1。
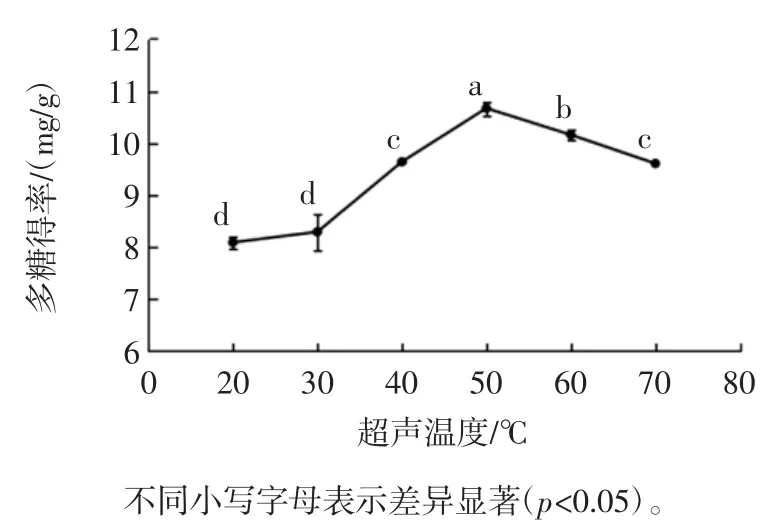
图1 超声温度对多糖得率的影响Fig.1 Effect of ultrasonic temperature on the polysaccharide yield
由图1 可知,20 ℃到50 ℃的多糖得率随着超声温度的升高而增大,当超声温度为50 ℃时多糖得率为10.664 7 mg/g,达到最大,但是当超声温度高于50 ℃时,多糖得率开始下降。这可能是由于多糖溶解度随温度的升高而增大;但当温度继续升高时,由于多糖的热不稳定性而发生分解,多糖得率下降[19]。方差分析结果表明,超声温度为50 ℃时的多糖得率显著(p<0.05)大于其他处理水平的多糖得率。因此,超声温度以50 ℃为宜。
2.2.2 液料比对‘凤丹’牡丹叶轴多糖得率的影响
液料比对‘凤丹’牡丹叶轴多糖得率的影响见图2。
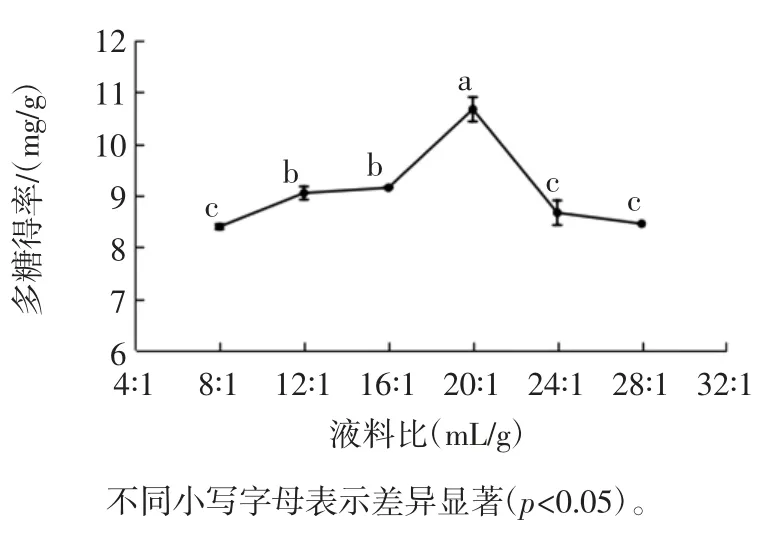
图2 不同液料比对多糖得率的影响Fig.2 Effect of different ratio of liquid to material on the polysaccharide yield
如图2所示,液料比在 8 ∶1(mL/g)至 20 ∶1(mL/g)的范围内,多糖得率是不断增加的。随着液料比的升高,蒸馏水用量逐渐增大。当液料比达到20 ∶1(mL/g)后,得率随蒸馏水用量的增加而呈降低趋势。当蒸馏水增加时,其与蒸馏水的接触面积增加,有利于多糖溶出。当蒸馏水量过多时,蒸馏水会吸收超声波的辐射,从而使细胞破壁作用降低,多糖得率趋于缓慢降低[20]。方差分析结果表明,液料比 20 ∶1(mL/g)时的多糖得率显著(p<0.05)高于其他处理水平。因此,液料比以 20 ∶1(mL/g)为宜。
2.2.3 超声时间对‘凤丹’牡丹叶轴多糖得率的影响
超声时间对‘凤丹’牡丹叶轴多糖得率的影响见图3。
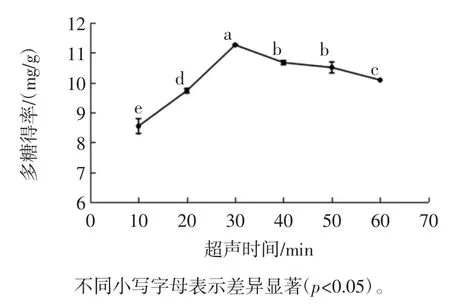
图3 超声时间对多糖得率的影响Fig.3 Effect of ultrasonic time on the polysaccharide yield
由图3 可知,10 min 到30 min 内,多糖得率随超声时间的延长而增加,当超声时间达到30 min 时,多糖得率最大,为11.256 5 mg/g,继续延长提取时间,多糖得率反而开始下降,可能是由于超声时间过长,多糖在高温下部分化学结构发生破坏[21],最终影响多糖的得率。方差分析结果表明,超声时间为30 min 时的多糖得率,显著(p<0.05)大于其他处理水平的多糖得率。因此,超声时间以30 min 为宜。
2.2.4 超声功率对‘凤丹’牡丹叶轴多糖得率的影响
超声功率对‘凤丹’牡丹叶轴多糖得率的影响见图4。

图4 超声功率对多糖得率的影响Fig.4 Effect of ultrasonic power on the polysaccharide yield
由图4 可以看出,在100 W 至250 W 范围内,随超声功率不断增加,多糖得率也随之增加,当超声功率超过250 W 时,多糖得率开始下降。可能是因为在一定超声功率范围内,提高超声功率有利于促进细胞壁的破裂和溶液传质作用,从而提高了多糖得率;但较大的超声功率产生出一定的剪切作用而使多糖组分中糖苷键断裂,所以呈下降趋势[22]。方差分析结果表明,超声功率为250 W 时的多糖得率显著(p<0.05)高于其他处理水平。因此,超声功率以250 W 为宜。
2.3 超声辅助提取牡丹叶轴多糖正交试验结果与分析
在单因素试验基础上,采用L(934)正交试验,对超声温度、液料比、超声时间、超声功率等4 个因素进行优化,正交试验因素水平设计与试验结果分别如表1、表2所示。
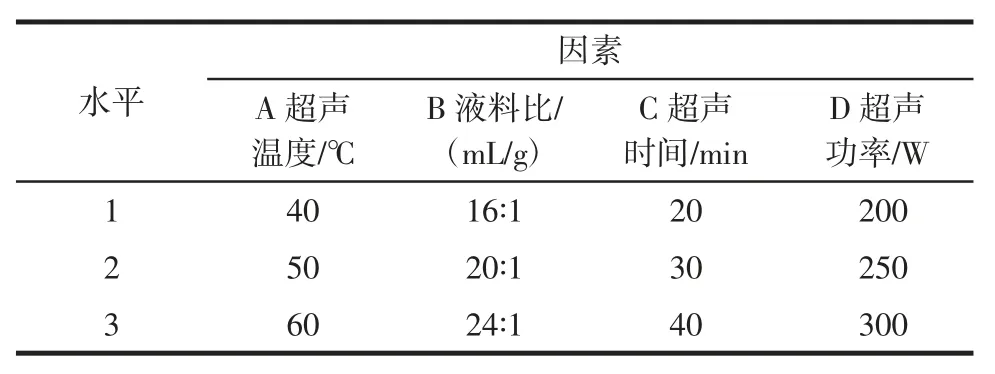
表1 正交试验因素与水平Table 1 Orthogonal experimental factors and levels
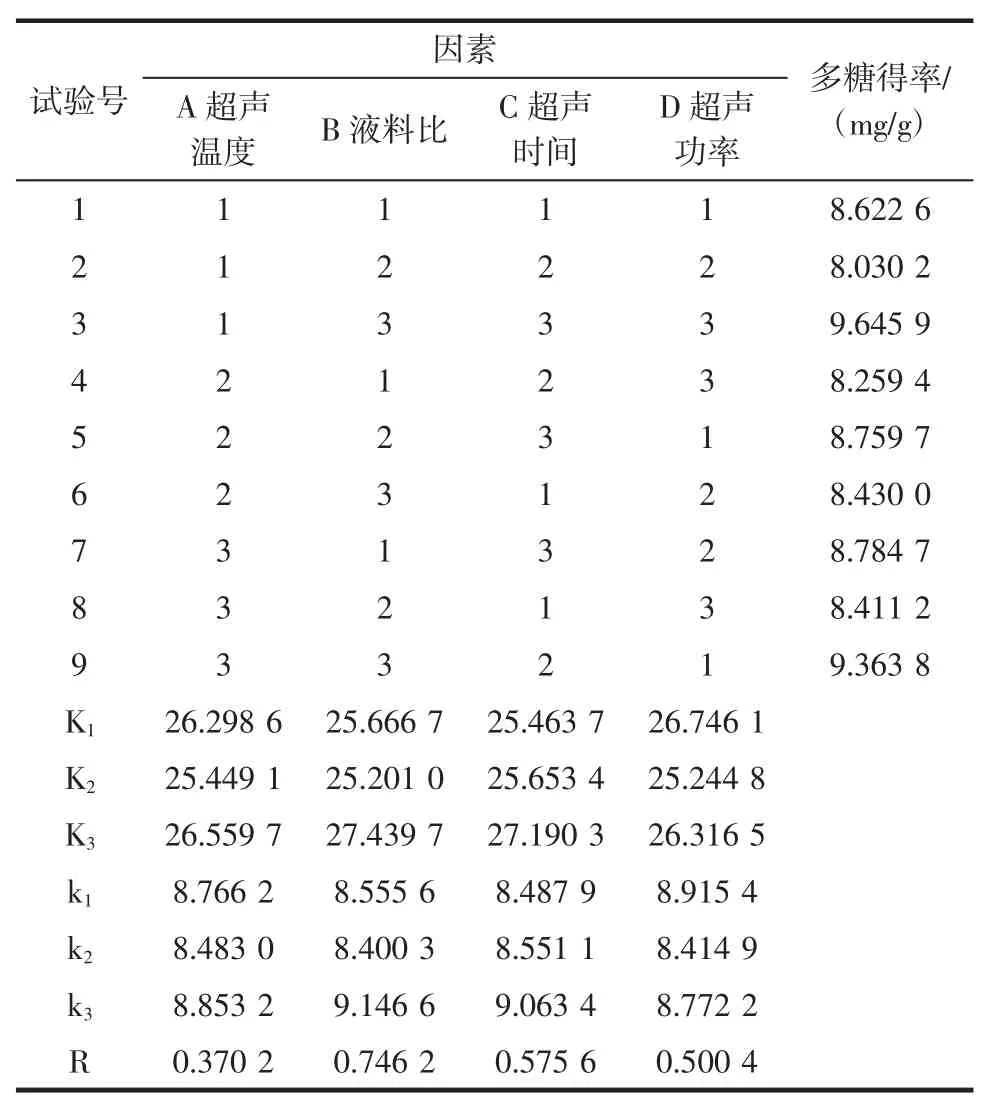
表2 正交试验设计与极差分析结果Table 2 Orthogonal experimental design and range analysis results
由表2 可以看出,在所选取得的4 个单因素中,极差的大小顺序依次为B>C>D>A;说明对牡丹叶轴多糖得率影响最大的是液料比(B),超声温度(A)对牡丹叶轴多糖得率的影响最小。根据分析可以得到各个因素的最优水平为A3B3C3D1,即在超声温度为60 ℃,液料比为24 ∶1(mL/g),超声时间为40 min,超声功率为200 W 时,‘凤丹’牡丹叶轴多糖得率最大,按此工艺条件进行3 次验证试验,得出最优组合提取条件下的多糖得率为(11.328 8±0.525 3)mg/g,高于正交试验中任一提取工艺组合的多糖得率。与传统提取工艺[液料比为 20 ∶1(mL/g),不进行超声处理,浸泡 30 min 后直接过滤测定]的多糖得率(7.867 3 mg/g)相比,最优组合提取的多糖得率比传统提取工艺高43.998 6%。
方差分析结果见表3。
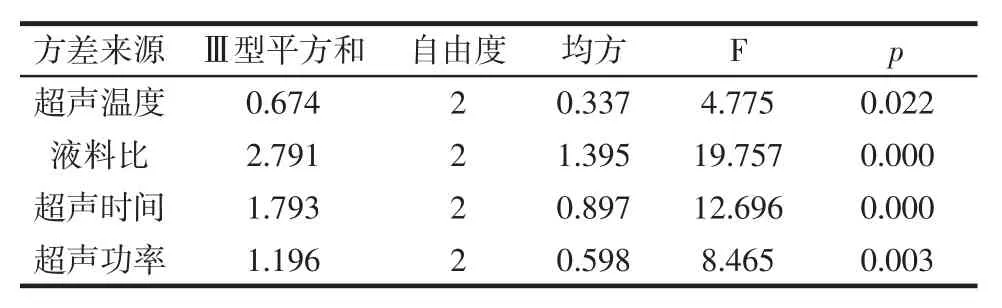
表3 方差分析结果Table 3 The results of variance analysis
由表3 可知,超声温度、液料比、超声时间和超声功率4 个试验因素均达到显著(p<0.05)水平,表明这4 个因素均显著(p<0.05)地影响到了多糖的得率。
2.4 牡丹叶轴多糖提取物对自由基的清除作用
2.4.1 牡丹叶轴多糖提取物对ABTS+自由基的清除能力
牡丹叶轴多糖提取物对ABTS+自由基的清除能力见图5。
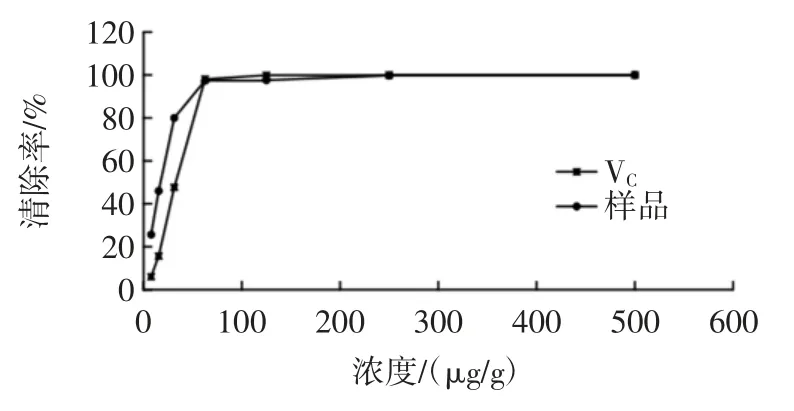
图5 多糖提取物对ABTS+自由基的清除能力Fig.5 Scavenging ability of the polysaccharide extract on ABTS+free radical
ABTS 在反应体系中被氧化,生成稳定的蓝绿色ABTS+自由基,734 nm 处有特征吸收峰,加入自由基清除剂(如多糖类化合物、VC等)会使颜色减弱,吸光度减小,颜色变化的程度可反应自由基清除剂清除自由基的能力[23]。由图5 可知,在一定的浓度下,牡丹叶轴多糖提取物和VC对ABTS+自由基均具有较好的清除作用,并且随着浓度的增加,对ABTS+自由基的清除效果越好。在试验条件下,当牡丹叶轴多糖提取物浓度在 500 μg/mL 和 VC浓度为 250 μg/mL 时清除率均达到了100%。分析得出牡丹叶轴多糖提取物和VC对ABTS+自由基清除率的 IC50分别为 19.316 7 μg/g 和31.430 4 μg/g。
2.4.2 牡丹叶轴多糖提取物对DPPH 自由基的清除能力
多糖提取物对DPPH 自由基的清除作用见图6。
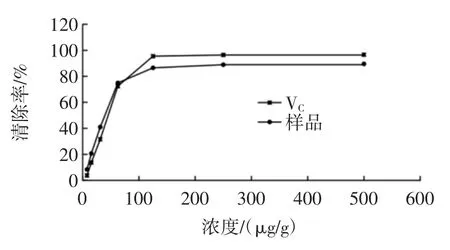
图6 多糖提取物对DPPH 自由基的清除作用Fig.6 Scavenging effect of polysaccharide extract on DPPH free radical
DPPH 自由基是一种稳定的含氮自由基,结构中存在单电子,在乙醇溶液中显深紫色,在517 nm 处有特征吸收。多糖类化合物多数都具有羟基,可以提供氧原子,与DPPH 自由基结构中的孤对单电子配对,从而减少单电子数目,使吸收减弱,颜色变浅或者消失。根据颜色变化程度就可以判定自由基的清除程度[24]。由图6 可知,牡丹叶轴中提取的多糖化合物对DPPH自由基的清除作用随多糖提取物浓度的增加,其清除能力也逐渐加强,表明了牡丹叶轴多糖提取物对DPPH 自由基的清除能力与其浓度有着明显的量效关系。在试验条件下,当牡丹叶轴多糖提取物浓度在500 μg/mL 时对DPPH 自由基清除率达到了89.567 9%。分析得出牡丹叶轴多糖提取物和VC对DPPH 自由基清除能力的 IC50分别为 39.330 0 μg/g 和 40.790 0 μg/g,牡丹叶轴多糖提取物和VC对DPPH 自由基清除能力相近。
3 结果与讨论
本文使用超声辅助提取‘凤丹’牡丹叶轴中的多糖,考察了超声温度、液料比、超声时间和超声功率这4 个单因素对‘凤丹’牡丹叶轴多糖得率的影响。通过正交试验对超声辅助提取‘凤丹’牡丹叶轴多糖的条件进行优化,得出最佳工艺条件是:超声温度为60 ℃,液料比为 24 ∶1(mL/g),超声时间为 40 min,超声功率为200 W 时,牡丹叶轴多糖得率为(11.328 8±0.525 3)mg/g。
通过对‘凤丹’牡丹叶轴多糖提取物的体外抗氧化试验可知,在试验所选取的浓度范围内‘凤丹’牡丹叶轴多糖提取物对ABTS+自由基、DPPH 自由基均有较强清除作用。当牡丹叶轴多糖提取物浓度在500 μg/mL 时ABTS+自由基清除率达到了100%,牡丹叶轴多糖提取物对ABTS+自由基清除能力的IC50为19.316 7 μg/g;当牡丹叶轴多糖提取物浓度在500 μg/mL 时对DPPH自由基清除率达到了89.567 9%,牡丹叶轴多糖提取物对DPPH 自由基清除能力的IC50为39.330 0 μg/g,牡丹叶轴多糖具有较强的抗氧化活性,是天然抗氧化剂的良好来源。

