4株姬松茸胞外多糖含量和生物活性的对比分析
解修超,刘军生,罗阳兰,邓百万,柏秋月,张毓文
(陕西省食药用菌工程技术研究中心,陕西理工大学生物科学与工程学院,陕西 汉中 723001)
姬松茸(Agaricus blazei)又名巴西蘑菇,属担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、伞菌目(Agaricales)、蘑菇科(Agaricaceae)、蘑菇属(Agaricus),原产于巴西、秘鲁和美国等地,后被引进日本和中国等国家,并对其进行了深入研究。研究发现,姬松茸具有较高的食药用价值,富含多种活性成分,与白蘑菇的亲缘关系较近,其多糖含量更是食用蕈菌之首[1]。近年来相关学者对姬松茸多糖在抗氧化[2],抗疲劳[3],抗炎[4],抗肿瘤[5-6],抗衰老[7],降血糖[8]等方面的作用进行了深入研究,表明姬松茸多糖在糖尿病[9]、肥胖症等疾病的治疗方面具有一定的潜在价值。
然而目前,一方面对姬松茸多糖的研究主要集中在胞内多糖,对胞外多糖研究较少,仅有关于姬松茸胞外多糖抗氧化活性的初步报道[10],尚无系统性的研究,相对于胞内多糖而言,胞外多糖提取加工方便,成本较低[11];另一方面,国内目前用于生产或研究的姬松茸种大部分来源于巴西和日本等地,我国品质优良的姬松茸菌株稀缺,种质资源严重不足[12-13],优良菌株亟待筛选补充。本研究利用4 株姬松茸菌株采用液体深层发酵法生产胞外多糖,测定其胞外多糖产量并考察其抑菌、抗氧化、抑制α-淀粉酶活性,筛选产胞外多糖的优势菌株,以期为姬松茸的进一步综合开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
供试的4 株姬松茸由陕西省食药用菌工程技术研究中心保藏。
枯草芽孢杆菌(Bacillus subtilis,批号 CMCC63501)、金黄色葡萄球菌(Staphyloccocus aureus,批号ATCC-25925)、大肠埃希菌(Escherichia coli,批号ATCC-25922)、白色念珠菌(Candida albicans,批号 CMCC85021),以上4 种菌株由陕西理工大学陕西省资源生物重点实验室菌种保藏中心提供,试验前复苏传代使用。
维生素 C(VC,分析纯,批号:20160105):天津市天新精细化工开发中心;DPPH:Sigma 公司;ABTS:上海生工生物工程有限公司;其余试剂均为分析纯:天津市盛奥化学试剂有限公司。
马铃薯琼脂(potato dextrose agar,PDA)培养基:马铃薯200.0 g/L、葡萄糖20.0 g/L、蛋白胨5.0 g/L、磷酸二氢钾5.0 g/L、硫酸镁3.0 g/L、琼脂15.0 g/L、水1 000 mL、pH 值自然。
察氏培养基:硝酸钠3.0 g、磷酸氢二钾1.0 g、七水合硫酸镁(MgSO4·7H2O)0.5 g、氯化钾 0.5 g、硫酸亚铁0.01 g、蔗糖 30.0 g、琼脂 15.0 g、蒸馏水 1 000 mL。
牛肉膏蛋白胨培养基:牛肉浸粉3.0 g/L,蛋白胨10.0 g/L,氯化钠 5.0 g/L,琼脂 15 g/L,水 1 000 mL。
1.2 仪器与设备
EYELA N1000 型旋转蒸发仪:上海爱郎仪器有限公司;SW-CJ-1D 型单人超净工作台:上海苏净实业有限公司;YXQ-LS-50S 型高压灭菌锅:上海博讯实业有限公司医疗设备厂;KQ5200DE 型数控超声波清洗器:昆山市超声仪器有限公司;UV2550 型紫外分光光度计:日本岛津公司。
1.3 方法
1.3.1 菌株菌落及细胞形态
分别将4 株姬松茸菌株接种于察氏培养基上,28 ℃暗培养5 d,观察其菌落形态,采用棉蓝染色法[14]在光学显微镜下观察菌丝体的形态和大小[15]。
1.3.2 菌株ITS分子鉴定
对4 株姬松茸菌株进行ITS 分子鉴定,利用CTAB 法提取4 株姬松茸菌株的DNA,采用真菌通用引物 ITS-1(5′TCCGTAGGTGAACCTGCGG-3′)和 ITS-4(5′TCCTCCGCTTATTGATATGC-3′)对 ITS 序列进行扩增。PCR 反应体系 50 μL:2×Taq Master Mix 25 μL,10 μmol/L 引物各 2 μL,模板 DNA1 μL(浓度 10 ng/μL),双蒸水补齐至50 μL。反应条件:94 ℃预变性2 min;94 ℃ 30 s,59 ℃退火 30 s,72 ℃ 60 s,33 个循环;72 ℃延伸2 min,4 ℃保存。将试验阳性PCR 产物送上海生工生物工程有限公司测序,测序结果整理后提交National Center for Biotechnology Information 数据库,申请并获得登录号,并利用blast 进行序列比对,下载相似序列后利用Mega7.0 构建系统发育树。
1.3.3 胞外多糖提取及含量测定
将4 株姬松茸菌株接入150 mL PDA 液体培养基中,120 r/min 振荡发酵7 d,抽滤,收集滤液旋转蒸发浓缩至60 mL,采用Sevag 法去除蛋白质,滤液与Sevag试剂按3 ∶1(体积比)置于250 mL 三角瓶中120 r/min振荡30 min,分液漏斗静置20 min,重复3 次,取上层清液。真空浓缩至50 mL,转入三角瓶中加入3 倍体积的无水乙醇,4 ℃静置过夜,5 000 r/min 离心 10 min,45 ℃干燥至恒重,即得姬松茸胞外多糖[16]。首先取除蛋白质后上层清液采用苯酚-浓硫酸法[17]测定总糖含量,并作葡萄糖标准曲线,其回归方程为y=28.529x-0.001 9,R2=0.993 9。然后取加入乙醇沉降并离心后的上清液利用DNS 法测定还原糖含量,两者之差即为胞外多糖的含量[18],计算公式如下:

1.3.4 抑菌活性分析
采用滤纸片扩散法[19]研究4 株姬松茸胞外多糖(各取50 μL)对指示菌-枯草芽孢杆菌Bacillus subtilis、金黄色葡萄球菌Staphyloccocus aureus、大肠杆菌Escherichia coli、白色念珠菌Candida albicans 菌株的抑菌效果,以含无菌PDA 培养基50 μL 的纸片作为溶剂阴性对照,以含 25 μg/mL 青霉素 50 μL 的纸片作为阳性对照,以0.96%生理盐水100 μL 的纸片为空白对照。利用十字交叉法测量抑菌圈直径D,抑菌效果(E)按下列公式计算:
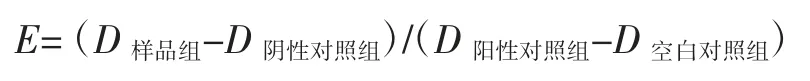
采用二倍连续梯度稀释法测定最小抑菌浓度(minimal inhibitory concentration,MIC),以 0.5 mL 的生理盐水为空白对照,同时采用平板转种法[20]测定最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.5 α-淀粉酶抑制作用的测定
参考文献[21-22],稍作修改,用无菌水将4 种胞外多糖样品配制成 0、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL溶液,取0.5 mL 样品溶液,加入0.5 mL 1 U/mL 的α-淀粉酶溶液与1 mL 0.25%的淀粉溶液,混匀后于50 ℃恒温水浴反应10 min。然后立即加入1 mL DNS 溶液,沸水浴加热5 min,冷却后用pH 6.6 磷酸缓冲液定容至10 mL,测定575 nm 处吸光值。每样重复3 次,取平均值,按下列公式计算α-淀粉酶活性的抑制率:
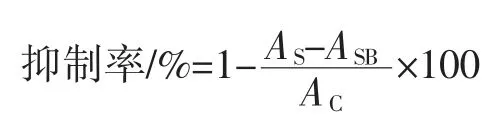
式中:AS为 0.5 mL 样品液 +0.5 mL α-淀粉酶溶液的样品吸光值;ASB为0.5 mL 样品+0.5 mL 磷酸缓冲液的样品对照组吸收值;AC为0.5 mL 二甲基亚砜+1 mL磷酸缓冲液的空白对照组吸光值。
1.3.6 体外抗氧化活性
1.3.6.1 还原能力测定
参考文献[23],稍作修改,用无菌水将4 种胞外多糖样品及 VC配成 0、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL 不同浓度的样品溶液,取1mL 样品,加入1mLpH6.6 磷酸缓冲液,1 mL 1%铁氰化钾溶液,混匀后于50 ℃水浴中反应20 min,加入1 mL10%三氯乙酸,混匀后取2 mL,加超纯水 2 mL 与 200 μL 0.1%三氯化铁,5 000 r/min 离心5 min,取上清液测定OD700,同时将铁氰化钾溶液替换成1 mL 去离子水作为对照组。以VC作为阳性对照,重复3 次,取平均值。
1.3.6.2 DPPH 自由基清除能力的测定
参考文献[24],稍作修改,用无菌水将4 种胞外多糖样品及 VC配制成 0、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL不同浓度的样品溶液,取2 mL 样品溶液加入1 mL 0.2 mmol/L DPPH-99.9%乙醇溶液,混匀,放置在室温(25 ℃)暗处 10 min,5 000 r/min 离心 5min,取上清液测定517 nm 处吸光值,以VC为阳性对照,每样重复3 次,取平均值,并按下列公式计算DPPH 自由基清除率:
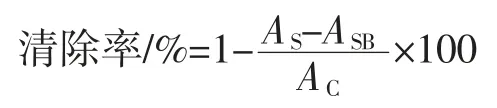
式中:AS为2 mL 样品液+1 mL DPPH-乙醇溶液的样品吸光值;ASB为2 mL 样品液+1 mL 99.9 %乙醇溶液的样品对照组吸光值;AC为2 mL 二甲基亚砜+1 mL 99.9%乙醇溶液的空白对照组吸光值。
1.3.6.3 ABTS+自由基清除能力的测定
参考文献[25-26],稍作修改,将7 mmol/L 的ABTS溶液和2.45 mmol/L 的过硫酸钾溶液等体积混合,在室温(25 ℃)、避光条件下静置过夜,形成ABTS+储备液。使用前将ABTS+储备液用99.9 %乙醇稀释(约稀释60 倍),即 OD734为0.7±0.02。用无菌水将4 种胞外多糖样品和 VC配制成 0、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL不同浓度的样品溶液,取1 mL 样品溶入2 mL ABTS+工作液,振荡混合,放置于暗处5 min 后5 000 r/min 离心5 min,取上清液测定OD734,VC为阳性对照。每样重复3 次,取平均值,并按下列公式计算ABTS+自由基清除率:

式中:AS为 1 mL 样品液+2 mL ABTS+工作液的样品吸光值;ASB为1 mL 样品+2 mL 99.9%乙醇溶液的样品对照组吸收值;AC为1 mL 二甲基亚砜+2 mL 99.9%乙醇溶液的空白对照组吸光值。
1.3.6.4 羟自由基清除能力的测定
参考文献[27],稍作修改,用无菌水将4 种胞外多糖样品及 VC配制成 0、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL 溶液,在1 mL 样品中分别加入9 mmol/L FeSO4和9 mmol/L水杨酸-乙醇溶液各2 mL 最后加2 mL 1.2 mmol/L H2O2启动反应,于 37 ℃反应 30 min,5 000 r/min 离心 5 min,取上清液以去离子水调零在波长510 nm 测定样品浓度吸光度A1;另外,去离子水代替H2O2重复上述操作,测定两样品本身的吸光值A2,同时以水代替两样品溶液,测定吸光度A0。VC为阳性对照。每样重复3 次,取平均值,并按下列公式计算羟自由基清除率:
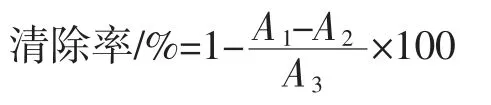
1.4 数据分析
试验采用SPSS22.0,Origin8.5 软件进行数据分析、图表制作等,结果取3 次平行试验的平均值。
2 结果与分析
2.1 菌株菌落形态
菌株外观形态与显微特征图见图1。

图1 菌株外观形态与显微特征图Fig.1 Colony morphology and microscopic characteristic of strains
4 株姬松茸菌丝有隔膜,具锁状分枝弯曲,与次顶端细胞融合,形成一桥状结构。菌丝呈白色,呈扇面状,背面呈淡黄色。4 株姬松茸菌株呈现不同的菌落形态,JS01 和JS06 气生菌丝较为发达,生长速度快,生长后期能够拧结成束,而JS04 和JS05 以基生菌丝为主,生长速度较慢。
2.2 菌株ITS 分子鉴定
JS01、JS04、JS05 和 JS06 菌株 ITS 的扩增结果显示其序列大小在800 bp 左右。
将菌株ITS 序列测序后,提交至GenBank 数据库中,进行序列分析和相似性比较,并建立系统发育树以证实该菌的系统发育地位,结果如图2所示。菌株与Agaricus blazei 中的ITS 序列具有99%的高度相似性,同时结合菌株菌落形态及显微特征结果认为,菌株 JS01、JS04、JS05 和 JS06 为姬松茸菌株。
2.3 胞外多糖含量测定
采用苯酚-浓硫酸法和DNS 法测定4 株姬松茸胞外多糖含量见表1。

图2 4 株姬松茸菌株系统发育树Fig.2 Phylogenetic tree of 4 Agaricus blazei strains

表1 胞外多糖含量Table 1 Extracellular polysaccharide content of strains
如表1所示,各姬松茸菌株的胞外多糖含量有所差异,其中JS01 胞外多糖含量为8.50 mg/mL,JS04 为3.34 mg/mL,JS05 为 8.81 mg/mL,JS06 为 7.70 mg/mL。
2.4 抗菌活性分析结果
本试验利用滤纸片扩散法对4 株姬松茸胞外多糖的抗菌活性进行对比分析,结果见表2。
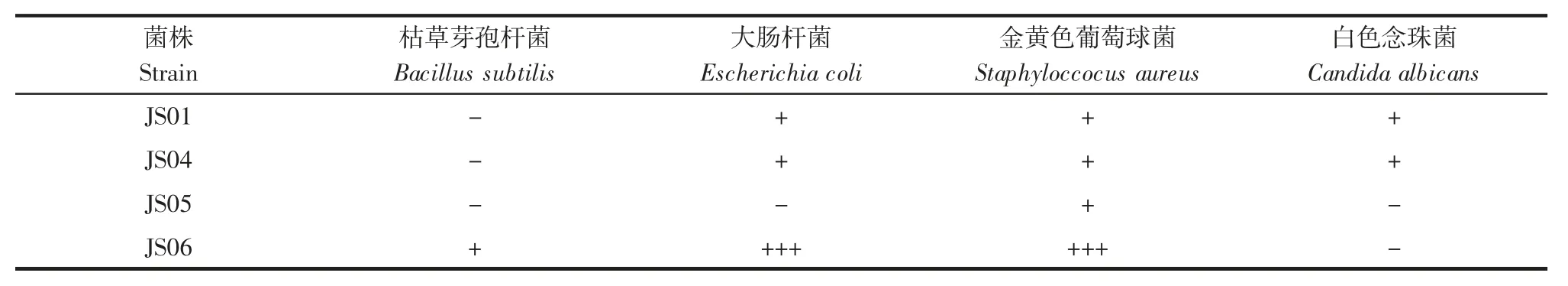
表2 胞外多糖抗菌活性分析Table 2 Antibacterial activity analysis of extracellular polysaccharide
菌株 JS01、JS04 的胞外多糖对 Escherichia coli 这种革兰氏阴性菌有微弱的抑制作用,抑菌圈的大小为8 mm~12 mm,但 JS06 的胞外多糖对 Staphylococcus aureus 和Escherichia coli 均有很强的抑制作用,抑菌圈大小为21 mm~28 mm。4 株姬松茸胞外多糖对病原菌Staphyloccocus aureus 均具有一定的抑制作用。上述研究表明,JS06 胞外多糖在抑制病原菌方面效果更好。
2.5 抑菌活性对比
胞外多糖的MIC 和MBC 结果见表3。
试验对照组无菌水纸片周围无抑菌环,阳性对照组0.5%碘伏溶液周围抑菌环均>1.5 cm,表明试验方法可行且无误。结果表明,4 株姬松茸的胞外多糖对Bacillus subtilis、Staphyloccocus aureus、Escherichia coli和Candida albicans 均有一定的抑制作用,4 种姬松茸菌株对金黄色葡萄球菌的抑制效果较好,对枯草芽孢杆菌的抑制效果差距不大;试验表明菌株JS06 有更好抑菌活性,而对金黄色葡萄球菌和大肠埃希菌的抑菌效果明显优于其他两株致病菌,其最小抑菌浓度分别为0.31 g/L 和0.77 g/L,最小杀菌浓度为0.39 g/L 和0.94 g/L。
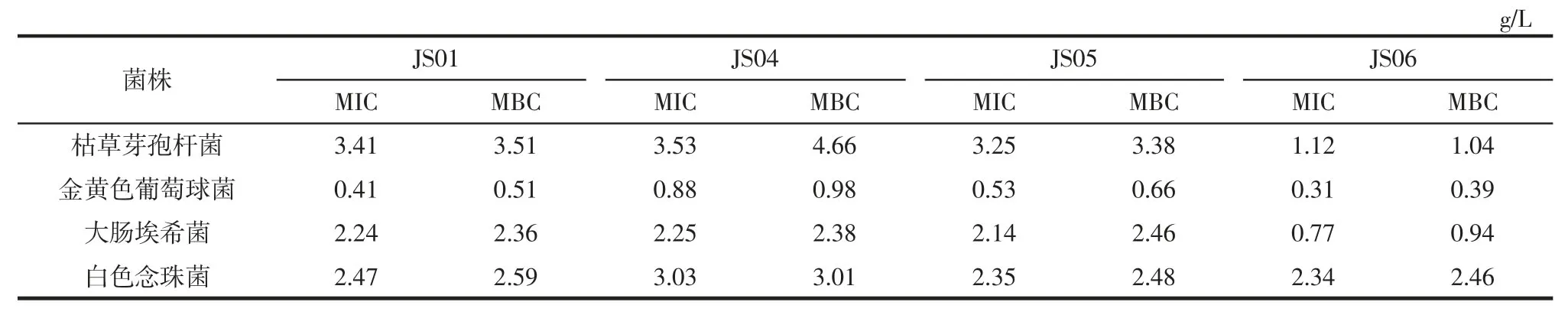
表3 胞外多糖的MIC 和MBCTable 3 MIC and MBC of extracellular polysaccharide
2.6 α-淀粉酶抑制能力测定
胞外多糖对α-淀粉酶的抑制作用见图3。

图3 胞外多糖对α-淀粉酶的抑制作用Fig.3 Inhibitory effect of extracellular polysaccharide on α-Amylase
由图3 可以看出,4 株姬松茸胞外多糖成分对α-淀粉酶均有一定的抑制作用。浓度在0.1 mg/mL~1.0 mg/mL 内,随着质量浓度的增加,α-淀粉酶抑制率不断增加时,当浓度达到1.0 mg/mL 时,对α-淀粉酶的抑制率分别为93.55%、81.44%、89.46%和91.79%。经回归分析得JS01 胞外多糖成分回归方程为:y=9.539 8x+26.862(R2=0.998 8),计算得 IC50为 2.425 mg/mL;JS04 胞外多糖成分回归方程为:y=10.95x+3.388 5(R2=0.997 2),计算得IC50为4.257 mg/mL;JS05 胞外多糖成分回归方程为:y=9.756 2x+21.572(R2=0.999 3),计算得 IC50为2.905 mg/mL;JS06 胞外多糖成分回归方程为:y=10.869x+17.854(R2=0.991 0),计算得 IC50为 2.958 mg/mL,表明4 株姬松茸胞外多糖成分对α-淀粉酶抑制作用存在较大差异,JS01 对α-淀粉酶抑制效果明显优于其他3 株姬松茸菌株。
2.7 体外抗氧化活性对比
2.7.1 还原能力测定
胞外多糖的还原能力见图4。

图4 胞外多糖的还原能力Fig.4 Reducing activity of extracellular polysaccharide
由图4 可知,4 株姬松茸胞外多糖成分均表现出不同程度的还原能力,与阳性对照VC相比,还原力从大到小排序为 VC>JS01>JS06>JS05>JS04。还原能力随浓度的增加而逐渐增加,当浓度为0.1 mg/mL 时,4 株姬松茸胞外多糖的还原能力大小无显著差异,但当大于0.1 mg/mL 时,四者的还原能力差距逐渐变大。当浓度为 1.0 mg/mL 时,VC和菌株 JS01、JS06、JS05、JS04 的还原力分别为 0.70±0.05 和 0.53±0.04、0.52±0.02、0.50±0.04、0.41±0.03,表明JS04 胞外多糖成分还原能力明显小于其他3 株姬松茸菌株,4 株姬松茸胞外多糖都小于VC的还原能力。
2.7.2 DPPH 自由基清除能力的测定
胞外多糖对DPPH 自由基的清除作用见图5。
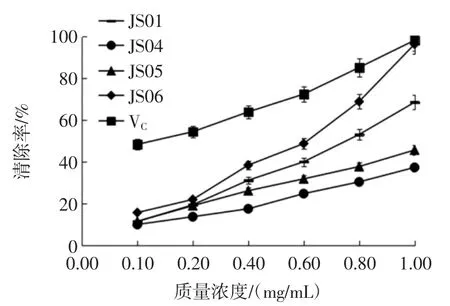
图5 胞外多糖对DPPH 自由基的清除作用Fig.5 DPPH free radicals scavenging activity of extracellular polysaccharide
由图5 可知,4 株姬松茸胞外多糖成分对DPPH自由基均有一定的清除能力,0.1 mg/mL~1.0 mg/mL内,随着质量浓度的增加,DPPH 自由基清除能力不断增强,呈现良好的剂量效应关系。DPPH 自由基清除能力从大到小排序为 VC>JS06>JS01>JS05>JS04,浓度为1.0 mg/mL 时,对DPPH 自由基清除率分别为98.33%、96.47%、68.62%、45.75%和37.42%,经回归分析得VC回归方程为:y=10.007x+25.484(R2=0.983 8),计算得EC50为2.449 mg/mL;JS06 多糖成分回归方程为:y=17.928x-33.145(R2=0.985 0),计算得 EC50为 4.638 mg/mL;JS01 多糖成分回归方程为:y=11.292x-13.442(R2=0.988 6),计算得 EC50为 5.618 mg/mL;JS05 多糖成分回归方程为:y=6.652 5x-1.204 3(R2=0.997 3),计算得EC50为7.697 mg/mL;JS04 多糖成分回归方程为:y=5.543 4x-2.579 3(R2=0.985 2),计算得 EC50为 9.486 mg/mL。半数有效浓度(median effective concentration,EC50)是指清除率为50%时的样品质量浓度,一般认为某种物质的EC50值低于10 mg/mL,表明其具有较好的抗氧化性[28],因此4 株姬松茸胞外多糖成分均有较好的DPPH 自由基清除能力且存在显著差异,JS06 胞外多糖的清除能力显著优于其他3 株姬松茸的胞外多糖,表明JS06 的胞外多糖成分具有较强的DPPH 自由基清除能力。任朝辉等研究发现,姬松茸菌丝体多糖对DPPH 自由基的EC50为0.184 mg/mL,清除DPPH 自由基能力显著大于胞外多糖,这可能与多糖本身活性和浓度有关,这有待于后续试验的验证。
2.7.3 ABTS+自由基清除能力的测定
胞外多糖对ABTS+自由基的清除作用见图6。
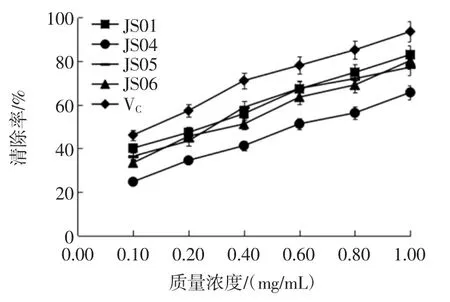
图6 胞外多糖对ABTS+自由基的清除作用Fig.6 ABTS+free radicals scavenging activity of extracellular polysaccharide
由图6 可知,4 株姬松茸胞外多糖成分均具有较强的ABTS+自由基清除能力,随着其质量浓度的增加,清除作用也随之增强。ABTS+自由基清除能力从大到小排序为块 VC>JS01>JS05>JS06>JS04,浓度为 1.0 mg/mL 时,对ABTS+自由基清除率分别为93.65%、83.06%、80.30%、77.27%和65.71%,经回归分析Vc 和4 株姬松茸菌株的 EC50值依次为 2.163、3.203、3.647、3.708 mg/mL 和5.046 mg/mL,表明4 株姬松茸菌株胞外多糖成分对ABTS+自由基清除能力存在较大差异,JS01 的清除能力明显优于其他3 株姬松茸菌株。说明JS01 的胞外多糖成分具有更强的ABTS+自由基清除能力。
2.7.4 羟自由基清除能力的测定
胞外多糖对羟自由基的清除作用见图7。
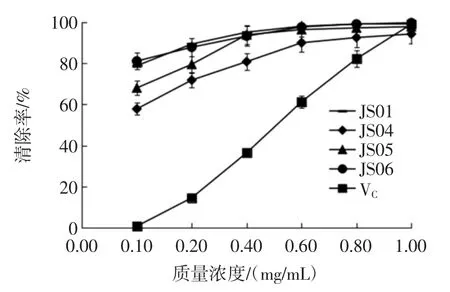
图7 胞外多糖对羟自由基的清除作用Fig.7 Hydroxyl free radical scavenging activity of extracellular polysaccharide
由图7 可知,4 株姬松茸胞外多糖成分和VC均具有明显的清除羟自由基作用且随着质量浓度的增加不断增加,对羟自由基的清除能力也逐渐增强。羟自由基清除能力从大到小排序为JS06>JS01>VC>JS05>JS04,浓度为1.0 mg/mL 时,对羟自由基清除率分别为99.71%、99.48%、99.03%、97.80%和94.25%。表明4株姬松茸菌株胞外多糖成分对羟自由基清除能力存在较大差异,JS06 和JS01 的清除能力优于VC,且明显优于其他2 株姬松茸菌株。说明JS06 和JS01 的胞外多糖成分具有较强的羟自由基清除能力,张卉等[29]研究发现姬松茸胞外多糖AbEXP-la 在30 mg/L 的浓度条件下对羟基自由基的清除率达32.74%,这与本试验的结果类似。
3 结论
4 株姬松茸菌株对4 种致病菌的均有一定抑制效果,对金黄色葡萄球菌抑制效果最好,表明菌株JS06有更好抑菌活性,可为天然抗菌药物的开发提供新材料。
抗氧化结果显示4 株姬松茸胞外多糖均具有一定的抗氧化活性,当浓度为1.0 mg/mL 时,JS01 的还原能力为 0.53±0.04,相当于 0.76 mg/mL VC当量。JS06 对于DPPH 自由基和羟自由基的清除率分别为96.47%和99.71%,均高于其他3 株姬松茸菌株,且对于羟自由基的清除率高于VC;菌株JS01 对α-淀粉酶的IC50为2.425 mg/mL,明显优于其他3 株姬松茸菌株的抑制作用。由此可见,4 株姬松茸胞外多糖均具有抑菌、抗氧化活性和α-淀粉酶抑制作用,表明其胞外多糖具有潜在的药用价值,有利于加大对姬松茸的研究力度,对姬松茸种质资源的开发利用具有重要意义。4 株姬松茸菌株中JS01 和JS06 的综合表现较好,值得进一步研究。本试验未对提取得到的胞外多糖进行脱色和进一步的纯化处理,这可能会对其生物活性有一定影响,需要后续试验进一步验证,并提出有效解决方案,以便在不破坏胞外多糖活性的前提下,对其进行进一步的脱色和纯化。

