重组毕赤酵母生产β-葡萄糖苷酶发酵条件优化及固定化研究
汪 飞, 吴 敬, 陈 晟
(江南大学 食品科学与技术国家重点实验室/工业生物技术教育部重点实验室/教育部食品安全国际合作联合实验室, 江苏 无锡 214122)
β-葡萄糖苷酶广泛存在于植物、动物和微生物中[1],其微生物来源包括原核微生物约氏黄杆菌、真核微生物清酒酵母、黑曲霉等[2]。β-葡萄糖苷酶能水解β-D-糖苷键和配基[3],同时也具有转糖苷活性,可以将水解释放出的配基或葡萄糖体以β-1,6-糖苷键形式转移到其他糖底物上[4]。
低聚龙胆糖是一种功能性低聚糖,包括龙胆二糖,少量的三糖和四糖[5]。低聚龙胆糖不能被人体降解,并且热量低,适合肥胖症、糖尿病等人群食用[6]。同时低聚龙胆糖作为功能性低聚糖可以有效地改善肠内菌群[7],目前已被广泛地运用于食品行业中。
早期多利用提取法制备低聚龙胆糖;但提取法受原料的限制,且过程复杂,效率低,难以工业化生产[8]。酶转化法具有反应条件温和、绿色环保、环境污染小等优点。工业上主要通过β-葡萄糖苷酶转化合成低聚龙胆糖,即通过游离酶或固定化酶将葡萄糖转化为低聚龙胆糖,再经分离纯化精制获得不同规格的低聚龙胆糖成品[9-10]。相比于游离酶,固定化酶具有重复使用、产物易分离、稳定性高、可控性强等优点[11]。目前只有日本食品化工株式会社实现了低聚龙胆糖工业化生产,国内未见工业化生产的报道[12]。
本研究拟在实验室前期研究的基础上,对已构建好的重组菌P.pastorisKM71/pPIC9K-bgl1/pPICZ A-pdi3.6 L罐发酵培养条件进行优化,同时对β-葡萄糖苷酶进行固定化研究并将其应用到低聚龙胆糖的生产中。
1 材料与方法
1.1 材料与试剂
1.1.1菌株与质粒
重组菌P.pastorisKM71/pPIC9K-bgl1/pPICZ A-pdi由实验室前期构建,以P.pastorisKM71为宿主,整合来自绿色木霉(Trichodermaviride)的β-葡萄糖苷酶基因bgl1,同时共表达二硫键异构酶pdi(提高新生肽的折叠效率)。
1.1.2实验试剂
对- 硝基苯基-β-葡萄糖苷(pNPG),上海西宝公司;龙胆二糖、龙胆三糖,美国Sigma公司;其他常见试剂,上海国药集团化学试剂有限公司。
1.1.3仪器与设备
Agilent 1200型HPLC色谱仪、Agilent自动进样器、Agilent示差折光检测器,美国安捷伦公司。
1.1.4培养基的配制
种子培养基(g/L):酵母提取物10.0,胰蛋白胨20.0,YNB 13.4,甘油30.0。
BSM培养基(g/L):CaSO4·2H2O 0.939,MgSO4·7H2O 14.9,KOH 4.13,K2SO418.2,甘油 30.0;85% H3PO426.7 mL/L,PTM微量元素溶液4.32 mL/L。
补料培养基:50 g/L甘油,同时加入PTM微量元素溶液5 mL/L。
诱导培养基:体积分数100%甲醇,同时加入PTM微量元素溶液12 mL/L。
PTM微量元素溶液(g/L):FeSO4·7H2O 65,MnSO4·H2O 3,CuSO4·5H2O 6,ZnCl220,CoCl20.5,Na2MoO3·2H2O 0.2,KI 0.08,H2SO45.0,H3BO30.02,生物素0.2。
1.2 实验方法
1.2.1发酵条件优化
从甘油管中吸取200 μL的种子液接种到100 mL发酵种子培养基中,于30 ℃恒温摇床中培养24 h,然后接种到含有1 L BSM培养基的3.6 L发酵罐中。发酵的条件为温度30 ℃,溶氧30%,pH值5.0。当出现溶氧反弹时,开始补加甘油,控制菌体浓度每小时增加3 g/L,到达预设的初始诱导菌体浓度时停止补加甘油,将菌体饥饿2 h,然后添加一定体积分数的甲醇开始促进菌体生长和产酶,通过甲醇浓度检测流加仪将甲醇体积分数一直维持在预设的数值。主要从诱导温度(25、28、30 ℃),初始诱导菌体浓度(33、50、60 g/L),甲醇体积分数(0.5%、1.0%、1.5%)3个方面优化重组P.pastoris在3.6 L发酵罐中产β-葡萄糖苷酶的发酵条件。
1.2.2酵母菌体浓度的测定
取一定量的菌液,用去离子水稀释一定的倍数,在600 nm波长处用分光光度计检测对应的吸光度,菌体浓度(g/mL)计算见式(1),测定之前先用去离子水进行校零。发酵过程中不同时间的OD600可表示此时菌体的生长状况。
菌体浓度=稀释倍数×OD600×0.3。
(1)
1.2.3固定化酶及固定化条件优化
壳聚糖微球载体的制备:将一定质量的壳聚糖溶于质量分数2.0%的醋酸溶液中,制成壳聚糖胶体溶液。用带针头的注射器将上述胶体溶液以60滴/min的速度滴入4 mol/L氢氧化钠溶液中,形成大小均一的壳聚糖微球,然后用去离子水洗至中性。将制好的壳聚糖微球加入到一定质量浓度的戊二醛溶液中进行交联,4 ℃条件下静置2 h后用去离子洗去多余的戊二醛溶液,壳聚糖微球载体4 ℃条件下保存于去离子水中备用。
β-葡萄糖苷酶的固定化:称取5.0 g壳聚糖微球载体,加入10 mL含一定单位酶活力的醋酸缓冲液(50 mmol/L,pH值 5.0),于4 ℃振荡吸附交联一定时间后取出抽滤,用蒸馏水洗去未交联游离酶,即得到固定化酶。
采用单因素实验,控制一个因素不变,分别改变微球载体的壳聚糖和戊二醛含量、加酶量和吸附时间来考察各个因素对固定化效果的影响。
1.2.4固定化酶操作稳定性分析
将固定化微球在酶转化反应中重复使用多次,检测每批反应中低聚龙胆糖的产率。
1.2.5β-葡萄糖苷酶酶活力的测定
pNPG法测定β-葡萄糖苷酶水解活力。反应的总体系为1 mL,取960 μL pH值5.0的醋酸缓冲液加入到5 mL离心管中,加入20 μL适当稀释的酶液,在60 ℃水浴锅中预热10 min,然后加入20 μL同样经过预热的100 mmol/L的pNPG,精确反应10 min,200 μL 1 mol/L的Na2CO3溶液终止反应,室温下静置显色5 min,于405 nm下测定吸光度,对照组中加入失活的酶[13]。
β-葡萄糖苷酶酶活力单位定义:每分钟生成1 μmol 对硝基苯酚所需要的酶量定义为1个酶活力单位(U)。
固定化酶酶活力的测定只需要将20 μL适当稀释的酶用一定质量的固定化酶代替,其他步骤相同。固定化酶酶活回收率计算见式(2)。

(2)
1.2.6酶转化产物的测定
酶转化生成的低聚龙胆糖,以及反应体系中的葡萄糖、纤维二糖均通过HPLC进行检测。HPLC条件:Agilent ZORBAX NH2 色谱柱(4.6 m×250 mm),柱温35 ℃;参比池温度40 ℃;流动相为乙腈和去离子水的混合溶液(体积比75∶25);流速0.8 mL/min;进样量10 μL。
2 结果与讨论
2.1 重组毕赤酵母发酵条件优化结果
以前期构建好的重组菌P.pastorisKM71/pPIC9K-bgl1/pPICZ A-pdi为出发菌株,在3.6 L罐上进行放大培养,分别从诱导温度、初始诱导菌体浓度和诱导阶段甲醇体积分数3个方面对发酵工艺条件进行优化,以实现Trichodermavirideβ-葡萄糖苷酶在重组毕赤酵母中的高效表达。
2.1.1诱导温度对发酵产酶的影响
大量的研究表明在毕赤酵母甲醇诱导阶段诱导温度是影响菌体生长和产酶的重要因素,而且不同的重组菌往往有不同的最适诱导温度[14-15]。研究拟定在25、28、30 ℃ 3个诱导温度条件下考察诱导温度对重组菌发酵产酶的影响。设定初始诱导菌体浓度为33 g/L,甲醇体积分数1.0%,诱导144 h后结束发酵。发酵上清液β-葡萄糖苷酶酶活力如图1。β-葡萄糖苷酶酶活力随温度的降低而提高,当诱导温度为30 ℃时,β-葡萄糖苷酶酶活力最高为916 U/mL,分别为28 ℃和25 ℃条件下最高酶活力的81.9%和73.7%;诱导温度为28 ℃和25 ℃时,β-葡萄糖苷酶的酶活力相当。考虑到工业发酵过程中制冷成本较大,所以选取28 ℃作为诱导温度。

图1 诱导温度对β-葡萄糖苷酶酶活力的影响Fig.1 Effect of induction temperatures on β-glucosidase activity
2.1.2初始诱导菌体浓度对发酵产酶的影响
初始诱导菌体浓度对重组毕赤酵母发酵产酶有很大影响,在低菌体浓度下进行诱导,菌体对环境较为敏感,不利于生长,导致最终的菌体浓度较低,从而最终的酶活力也会很低;在高菌体浓度下进行诱导,最终的菌体浓度也会很高。但当菌体量达到一定程度时,培养基中营养物质和氧就不能满足菌体的需求,导致发酵后期菌体的生长环境较为恶劣,菌体会释放出一些蛋白酶,从而影响目的蛋白质的稳定性[16-17]。为了提高β-葡萄糖苷酶的表达量同时保证发酵后期酵母细胞的活力,研究对初始诱导菌体浓度进行了优化。当菌体浓度分别达到33、50、60 g/L时开始诱导,诱导阶段甲醇体积分数维持在1.0%,28 ℃诱导144 h后结束发酵,发酵上清液β-葡萄糖苷酶酶活力如图2。当初始诱导菌体浓度为50 g/L时,β-葡萄糖苷酶酶活力最高,能达到1 452 U/mL,分别是菌体浓度达到33、60 g/L条件下的1.3、1.2倍。因此确定初始诱导菌体浓度为50 g/L时较优。

图2 初始诱导菌体浓度对β-葡萄糖苷酶酶活力的影响Fig.2 Effect of initial cell densities on β-glucosidase activity
2.1.3诱导阶段甲醇体积分数对发酵产酶的影响
在毕赤酵母诱导阶段,甲醇作为碳源的同时也是诱导剂,诱导酵母细胞产生醇氧化酶并利用甲醇为酵母细胞的生长产酶提供能量,同时诱导外源蛋白的表达。因此控制诱导过程中甲醇体积分数是毕赤酵母进行高密度发酵的关键一步[17]。为了研究诱导过程中甲醇体积分数对重组毕赤酵母发酵产酶的影响,在初始菌体浓度50 g/L,诱导温度为28 ℃条件下,分别采用0.5%、1.0%、1.5% 3个不同体积分数的甲醇进行诱导,菌体产酶情况如图3。当培养基中甲醇体积分数维持在1.0%时,β-葡萄糖苷酶酶活力最高,为1 452 U/mL,分别是0.5%、1.5%条件下的1.2、1.4倍,从而确定诱导阶段较优甲醇体积分数为1.0%。发酵上清液SDS-PAGE电泳如图4。
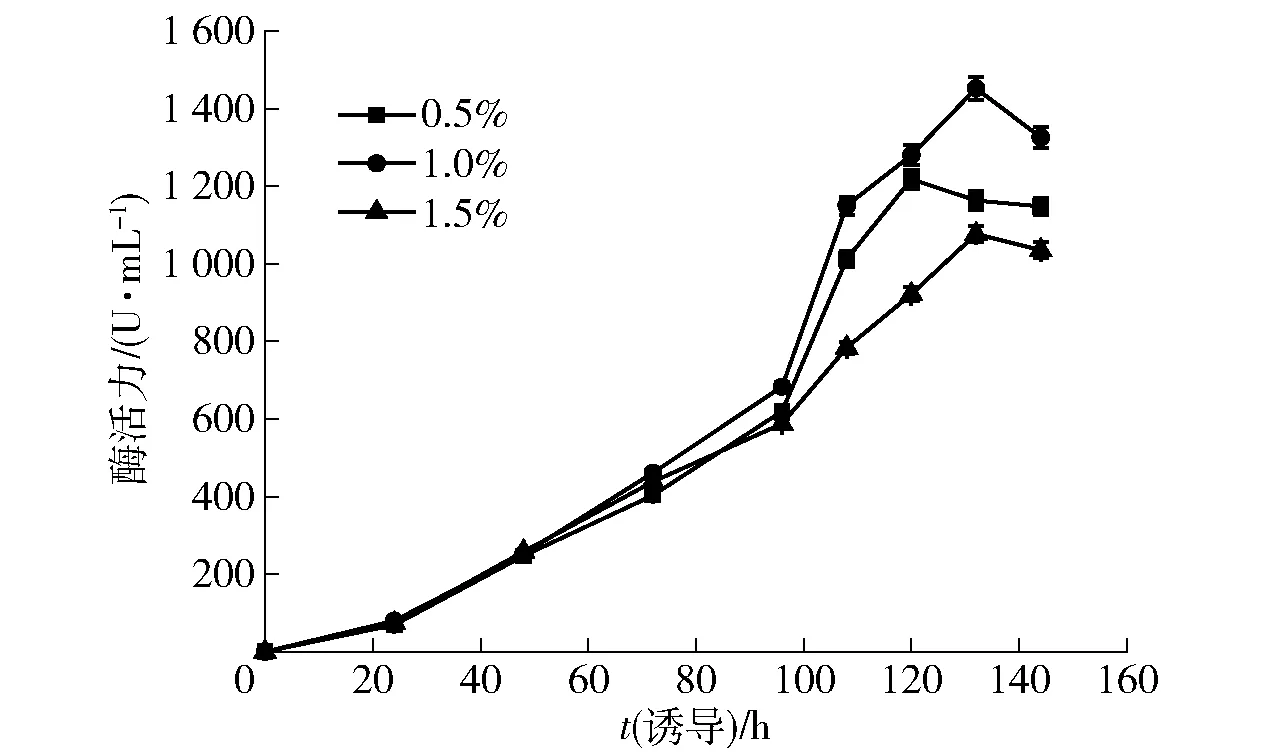
图3 甲醇体积分数对β-葡萄糖苷酶酶活力的影响Fig.3 Effect of methanol concentrations on β-glucosidase activity
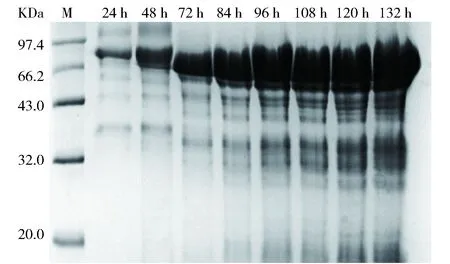
图4 重组P. pastoris 3.6 L罐发酵 上清液SDS-PAGE电泳图Fig.4 SDS-PAGE analysis of 3.6 L fermentor culture supernatant of recombined P. pastoris
2.2 β-葡萄糖苷酶固定化条件优化结果
2.2.1壳聚糖含量对固定化酶的影响
壳聚糖含量影响固定化微球的机械强度、比活、底物传质速度等,从而影响固定化酶的酶活回收率。在戊二醛质量浓度为0.010 g/mL、加酶量为400 U/g、吸附时间为12 h的条件下研究了不同壳聚糖含量对固定化β-葡萄糖苷酶酶活回收率的影响,结果如图5。酶活回收率随着壳聚糖含量的增加呈现先升高后降低的现象,当壳聚糖质量浓度为0.03 g/mL时,酶活回收率达到最大值为53.6%。当壳聚糖含量过低时,微球载体的机械强度低,在吸附和冲洗过程中易破裂;但当壳聚糖含量过高时,微球载体的空隙很小,影响酶进入载体内部,底物传质也困难,从而影响酶活回收率[19]。因此,选用0.03 g/mL的壳聚糖来制备微球载体。

图5 壳聚糖含量对固定化酶酶活回收率的影响Fig.5 Effect of chitosan concentrations on recovery of immobilized enzyme
2.2.2戊二醛含量对固定化酶的影响
戊二醛是壳聚糖微球载体制备过程中的交联剂,可以使线性的壳聚糖分子转变成网状高聚物,生成交联壳聚糖[20-21]。当戊二醛含量过低时,壳聚糖微球载体的机械强度差,固定化的酶易脱落;戊二醛含量过高时,戊二醛会发生羟醛缩合,固化成不规则物附在微球载体表面,从而影响微球载体表面的孔结构,使酶不易被固定,而且还会使得共价连接后的酶与酶之间过于紧密,改变酶的构象,从而影响固定化酶的酶活回收率[22]。在壳聚糖质量浓度为0.03 g/mL、加酶量为400 U/g、吸附时间为12 h的条件下研究了戊二醛含量对固定化β-葡萄糖苷酶酶活回收率的影响,结果如图6。当戊二醛质量浓度为0.008 g/mL时,酶活回收率达到最大,为56.5%。因此,选择0.008 g/mL的戊二醛作为交联剂。

图6 戊二醛含量对固定化酶酶活回收率的影响Fig.6 Effect of glutaraldehyde concentrations on recovery of immobilized enzyme
2.2.3游离酶添加量对固定化酶的影响
在壳聚糖质量浓度为0.03 g/mL、戊二醛质量浓度为0.008 g/mL、吸附时间为12 h的条件下研究了不同游离酶添加量对β-葡萄糖苷酶酶活回收率的影响,结果如图7。当加酶量为400 U/g时,固定化酶酶活力达到最大为226 U/g,继续增加酶添加量而固定化酶的活力增加不显著。当微球载体吸附游离酶未达到饱和时,固定化酶的酶活力随着游离酶添加量的增大而增大;但当微球载体达到饱和时,继续增加游离酶添加量,固定化酶的酶活力不会再增加,酶活回收率反而逐渐降低。所以从固定化酶的酶活力和酶活回收率两个方面综合考虑,游离酶的添加量为400 U/g较为合适。
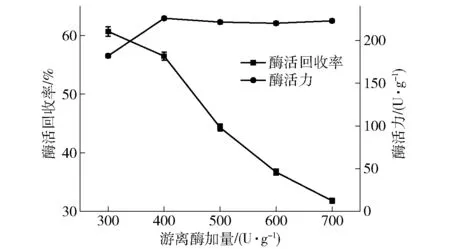
图7 游离酶添加量对固定化酶酶活 回收率和酶活力的影响Fig.7 Effect of free enzyme concentrations on recovery and activity of immobilized enzyme
2.2.4吸附时间对固定化酶的影响
在壳聚糖质量浓度为0.03 g/mL、戊二醛质量浓度为0.008 g/mL、加酶量为400 U/g的条件下,研究了吸附时间对固定化β-葡萄糖苷酶酶活回收率的影响,结果如图8。当固定化时间达到20 h后,载体与酶的作用达到饱和,此时酶活回收率达到65.4%,酶活为261.6 U/g,因此选择的吸附时间为20 h较为合适。

图8 吸附时间对固定化酶酶活回收率的影响Fig.8 Effect of adsorbtion time on recovery of immobilized enzyme
2.3 固定化酶操作稳定性研究
固定化酶跟游离酶相比,有较好的操作稳定性和重复使用性。将固定化酶连续酶转化6次,每次结束后检测低聚龙胆糖的产率。酶转化在pH值5.0,60 ℃条件下进行,以质量分数20%葡萄糖和40%纤维二糖为底物,加酶量为400 U/g(1 g纤维二糖的加酶量为400 U),反应48 h后终止反应,结果如图9。随着转化次数的增加,低聚龙胆糖的产率逐渐下降;连续转化第6次时,低聚龙胆糖产率仍有15.2%,显示出该固定化酶具有较好的持续利用性及较高的低聚龙胆糖生产能力。

图9 固定化酶的操作稳定性Fig.9 Operational stability of immobilized enzyme
3 结 论
研究对重组菌P.pastorisKM71/pPIC9K-bgl1/pPICZ A-pdi进行3.6 L罐放大培养,分别从诱导温度、初始诱导菌体浓度和诱导阶段甲醇体积分数3个方面对发酵工艺条件进行优化。结果表明,当诱导温度28 ℃,初始诱导菌体浓度50 g/L,诱导阶段甲醇体积分数为1.0%时,酶活力最高,能达到1 452 U/mL。同时以壳聚糖为载体、戊二醛为交联剂,采用吸附交联法对β-葡萄糖苷酶进行固定化。结果表明,当壳聚糖质量浓度为0.03 g/mL,戊二醛质量浓度为0.008 g/mL,游离酶加量为400 U/g,固定化吸附时间为20 h时,固定化酶酶活回收率最高达到65.4%。在优化的转化条件下连续转化6次,低聚龙胆糖产率仍有15.2%,显示出该固定化酶具有较好的持续利用性及较高的低聚龙胆糖的生产能力,为固定化酶法合成低聚龙胆糖的工业化提供了一定的参考价值。

