基于环介导等温核酸扩增技术分型检测多房/细粒棘球蚴方法的建立※
蒋巧燕,张 颖,胡缤文,汤 锋#,李润乐&
(1.青海大学高原医学研究中心,青海省高原医学应用基础重点实验室,高原医学教育部重点实验室,青海 西宁 810001;2.青海大学医学院,青海 西宁 810001)
棘球蚴病分为泡型包虫病(alveolar echinococcosis,AE)、囊型包虫病(cystic echinococcosis,CE),分别由多房棘球蚴(E.m.)、细粒棘球蚴(E.g.)感染引起[1],由于形态学观察很难区分绦虫属虫卵,目前疾控无法准确区分不同环境中的棘球绦虫污染源[2],因此需建立起一种对多房/细粒棘球蚴分型的快速检测方法。2000年,Notomi[3]等创建了一种在等温条件下进行核酸扩增的新技术,即环介导等温核酸扩增技术(LAMP),由于该技术具有快速、精确、高敏感性及等温扩增和无需专门仪器设备等优点,近年来,被广泛应用于病原微生物的快速检测。
线粒体DNA具有母系遗传、缺乏重组和进化速率高等特点,是研究物种进化与区分物种的一个很有用的遗传标记[4],NADH脱氢酶第二亚基(ND2)作为线粒体电子传递链复合体的关键组分与线粒体其他蛋白质编码基因和rRNA相比具有更快的进化速率[5],许多学者已经将ND2基因序列应用于生物分子系统学的研究[6]。本实验利用生物信息学软件Primerexplorer,针对多房/细粒棘球蚴线粒体基因组ND2基因,设计出可用于区分多房和细粒棘球蚴DNA样本的LAMP引物,建立起一种快速分型方法。
1 材料与方法
1.1 材料
DNA提取试剂盒购自Tiangen生化科技(北京)有限公司,dNTP(10mM each)购自Tiangen生化科技(北京)有限公司,Bst DNA聚合酶购自BioLabs公司。多房棘球蚴和细粒棘球蚴DNA为青海大学高原医学研究中心保存品。
1.2 方法
1.2.1 LAMP引物设计
在NCBI基因库中,针对多房棘球蚴线粒体基因组序列(登录号:NC 000928.2)和细粒棘球蚴线粒体基因组序列(登录号:AF297617.1),利用生物信息学软件primerexplorer设计出两组LAMP引物(表1)。引物由上海生工公司合成。
1.2.2 DNA提取及检测
使用DNA提取试剂盒提取样本DNA进行浓度检测。稀释到试验所需浓度(2ng/μL)后通过电泳检测DNA提取质量。
1.2.3 反应液配置
按要求配制25 μL反应液[10×Thermo Pol Buffer(2.5μL);MgSO4(100mM,1.5μL);dNTP Mix(10mM,3.5μL);FIP(40μmol/L,1.0μL);BIP(40μmol/L,1.0μL);F3(5μmol/L,1.0μL);B3(5μmol/L,1.0μL);Bst DNA polymerase(8000U/mL,1.0μL);LAMP可见光染料(1.25μL);模板(2.0μL);ddH2O(9.25 μL)]。
1.2.4 LAMP扩增条件设定
65 ℃下扩增60 min,82 ℃下延伸10 min。
1.2.5 LAMP扩增产物检验
扩增产物可直接通过观察LAMP可见光染料颜色变化得出结果(阳性结果颜色由反应前的紫色变成天蓝色,仍为紫色则是阴性)后吸取5 μL扩增产物行2%凝胶电泳检测验证(阳性结果为阶梯条带,否则为阴性)。
1.2.6 引物筛选
在多组引物中找出一组多房/细粒棘球蚴分型检测结果最佳的,针对其所对应的线粒体基因,再设计一组该基因的引物进行验证,从中选择检测效果最佳的引物组。
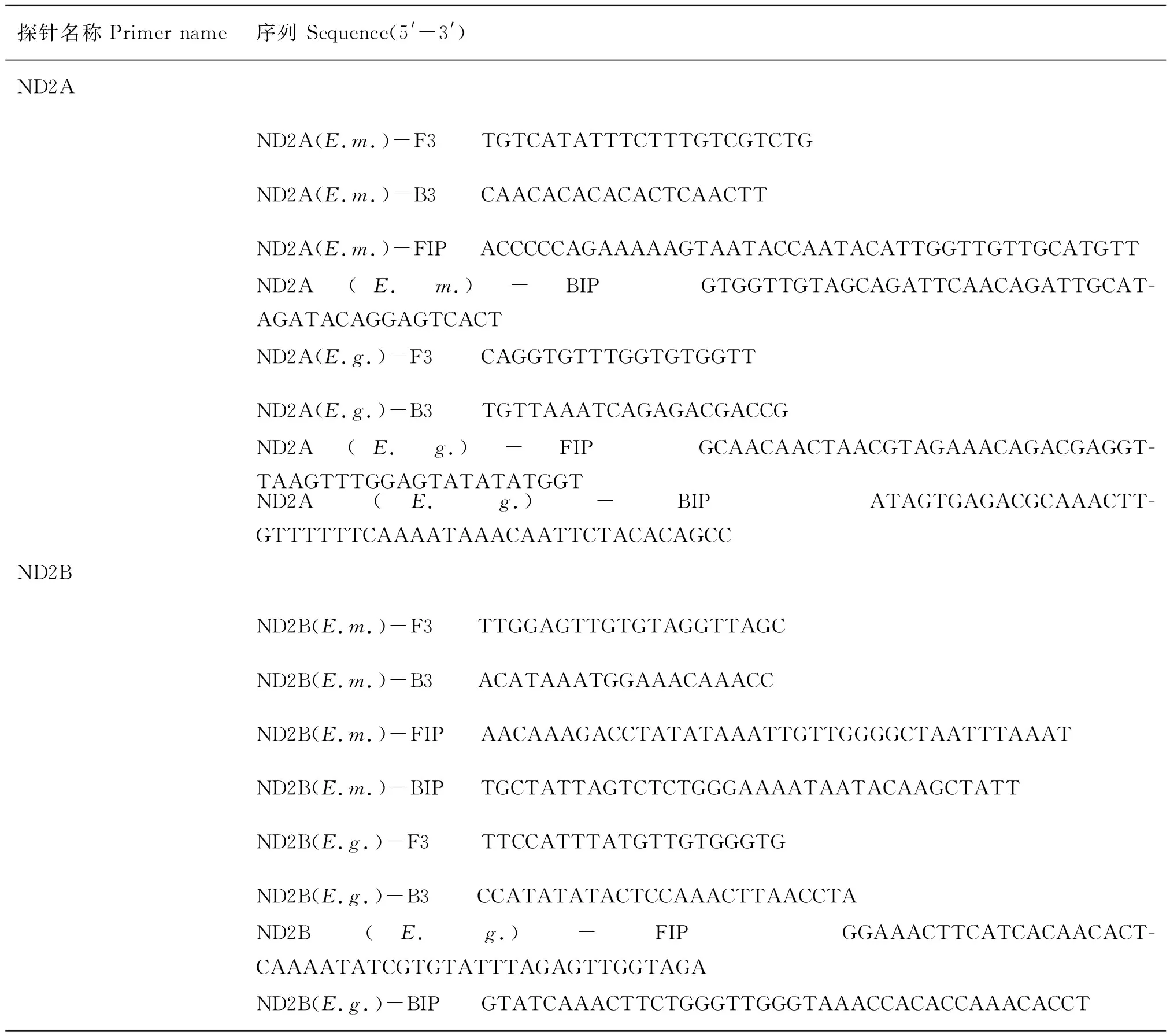
表1 ND2基因的LAMP引物序列Table 1 Primers used for ND2 gene
1.2.7 反应温度优化
使用1.2.6中最优引物组寻找其最适反应温度。以61 ℃~65 ℃为待选范围,选出引物的最适反应温度。
1.2.8 Mg2+反应浓度优化
使用1.2.6中最优引物组寻找其最适Mg2+反应浓度。以1.3~1.7×10-4mM为待选范围、0.1×10-4mM为梯度重复试验浓度选出引物的最适Mg2+反应浓度。
1.2.9 dNTP Mix反应浓度优化
使用1.2.6中最优引物组寻找其最适dNTP Mix反应浓度。以3.3~3.7×10-5mM为待选范围、0.1×10-5mM为梯度重复试验浓度选出引物的最适dNTP Mix反应浓度。
2 结果
2.1 ND2基因LAMP引物序列及位点图的筛选
通过BLAST差异比对从多房和细粒棘球蚴线粒体ND2基因筛选出差异序列(图1),并在此基础之上采用生物信息学软件primerexplorer,针对线粒体基因组中ND2差异序列设计出了两组用于区分多房和细粒棘球蚴的LAMP引物ND2A、ND2B序列及位点图(图1)。
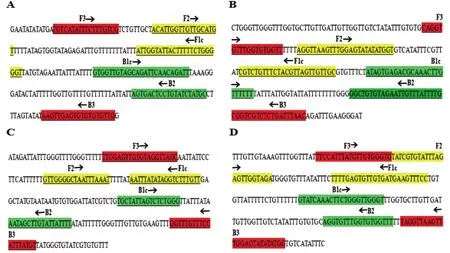
A:ND2A(E.m.)的靶序列位点图;B:ND2A(E.g.)的靶序列位点图;C:ND2B(E.m.)的靶序列位点图;D:ND2B(E.g.)的靶序列位点图A:target sequence of ND2A(E.m.);B:target sequence of ND2A(E.g.);C:target sequence of ND2B(E.m.);D:target sequence of ND2B(E.g.)图1 ND2基因LAMP引物靶序列位点图Figure 1 Targets sequences of primers for LAMP of ND2 gene
2.2 多房棘球蚴和细粒棘球蚴的DNA提取
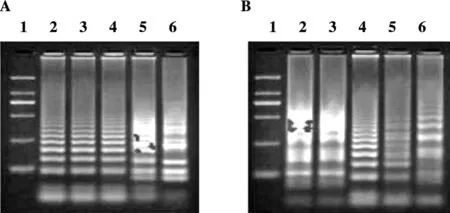
分别从实验室保存的多房棘球蚴原头节和细粒棘球蚴原头节中提取多房棘球蚴和细粒棘球蚴DNA,通过琼脂糖凝胶电泳检测确认其质量符合后续LAMP实验要求(可用于LAMP扩增实验,图2)
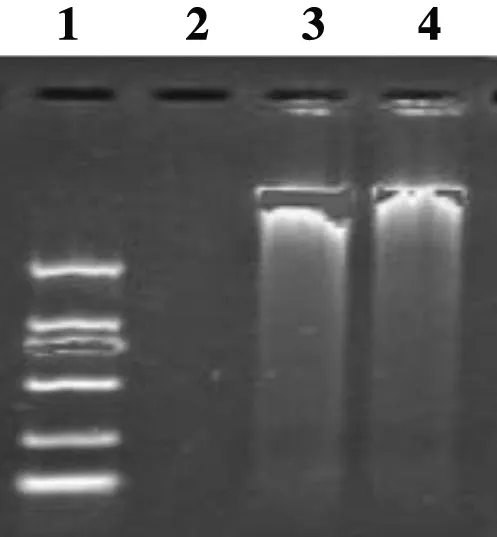
1:DL2000 DNA marker;2:多房棘球蚴DNA;3:细粒棘球蚴DNA1:DL2000 DNA marker;2:DNA of Echinococcus multilocularis;3:DNA of Echinococcus granulosus图2 DNA1%琼脂糖凝胶电泳图Figure 2 Bands of DNA samples by 1% agarose gel electrophoresis
2.3 LAMP分型检测引物的筛选及验证
分别以多房棘球蚴DNA、细粒棘球蚴DNA、超纯水、人源基因组DNA为模板,以设计获得的ND2A(E.m.)、ND2A(E.g.)、ND2B(E.m.)、ND2B(E.g.)为引物进行LAMP扩增反应,之后通过琼脂糖凝胶电泳及可视化探针对反应产物进行评价(图3、4):ND2A(E.m.)可准确扩增出多房棘球蚴目的序列而无法以细粒棘球蚴DNA为模板进行扩增,ND2A(E.g.)可准确扩增出细粒棘球蚴目的序列而无法以多房棘球蚴DNA为模板进行扩增,ND2B(E.m.)可准确扩增出多房棘球蚴目的序列而无法以细粒棘球蚴DNA为模板进行扩增,扩增效率较低,可视化探针无法检测到;ND2B(E.g.)对多房棘球蚴DNA及细粒棘球蚴DNA均可扩增。ND2A这组引物可用于多房和细粒棘球蚴的分型检测,而ND2B组引物无法准确区分多房和细粒棘球蚴DNA样本。
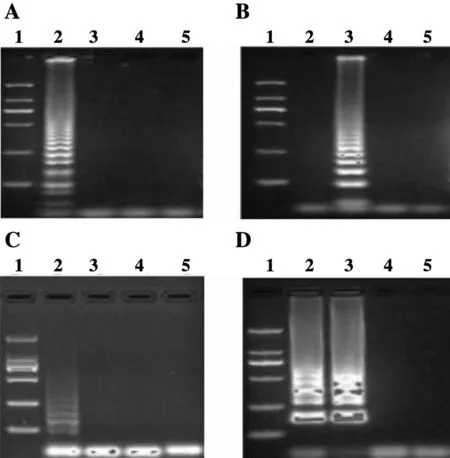
A:ND2A(E.m.);B:ND2A(E.g.);C:ND2B(E.m.);D:ND2B(E.g.)1:DL2000 DNA marker;2:多房棘球蚴DNA;3:细粒棘球蚴DNA;4:超纯水;5:正常人的组织DNAA:ND2A(E.m.);B:ND2A(E.g.);C:ND2B(E.m.);D:ND2B(E.g.)1:DL2000 DNA marker;2:DNA of Echinococcus multilocularis;3:DNA of Echinococcus granulosus;4:ultrapure water;5:DNA of normal human tissue图3 ND2A引物和ND2B引物扩增结果的2%琼脂糖电泳图Figure 3 Results of ND2A and ND2B probes in 2% agarose gel electrophoresis
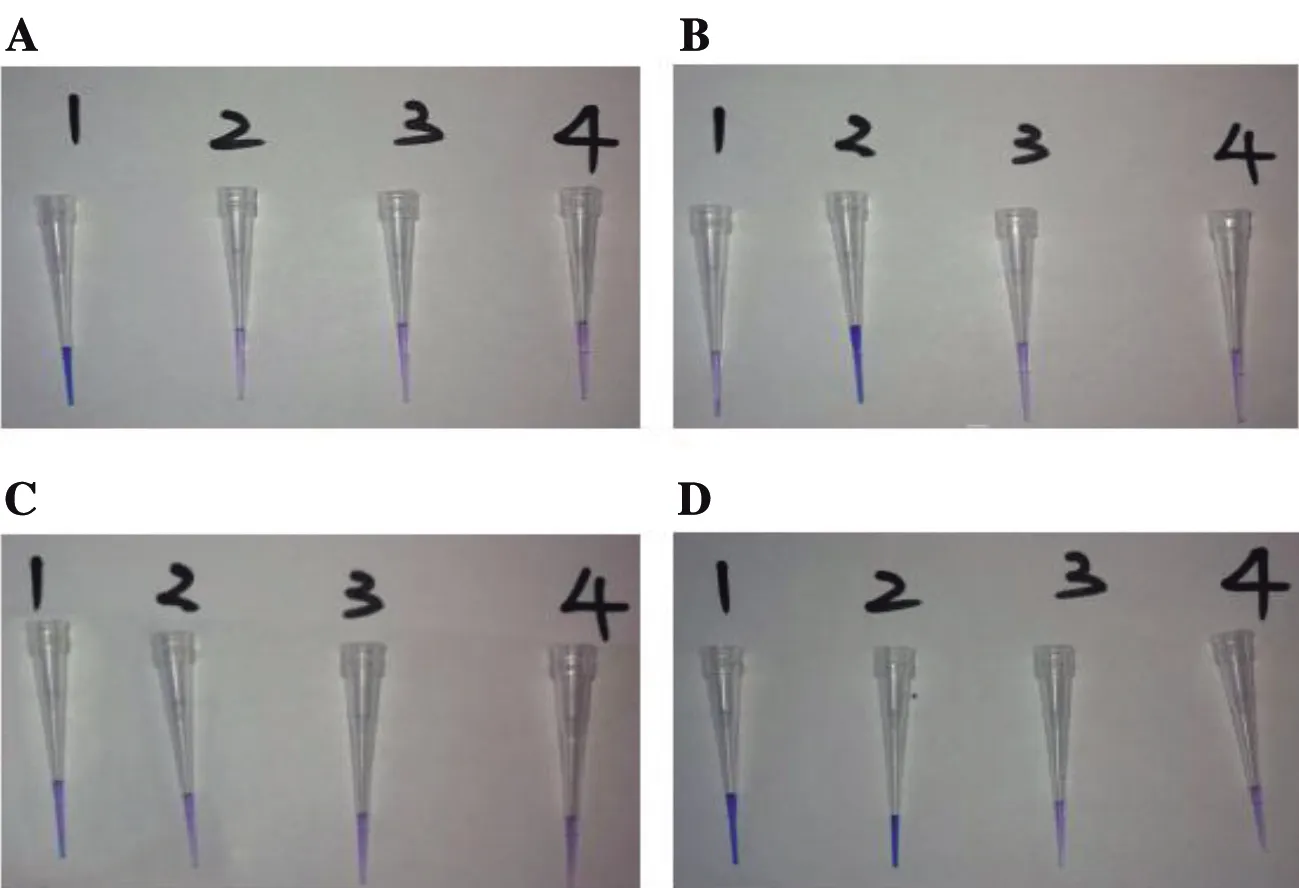
A:ND2A(E.m.);B:ND2A(E.g.);C:ND2B(E.m.);D:ND2B(E.g.)1~4加入的模板顺序为:多房棘球蚴DNA;细粒棘球蚴DNA;超纯水;正常人的组织DNAA:ND2A(E.m.);B:ND2A(E.g.);C:ND2B(E.m.);D:ND2B(E.g.)The order of the templates added to 1~4 is: DNA of Echinococcus multilocularis;DNA of Echinococcus granulosus;ultrapure water;DNA of normal human tissue
2.4 ND2A引物的反应温度的优化
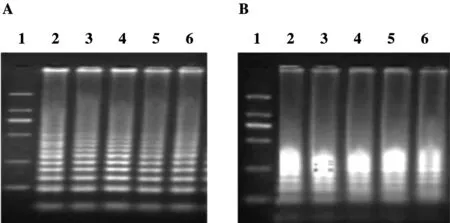
ND2A引物以61 ℃~65 ℃为待选范围选出该组引物的最适反应温度。如图5所示,ND2A(E.m.)引物扩增效率自61 ℃到65 ℃呈先增加后减少的趋势,故将ND2A(E.m.)的引物最适反应温度定为64 ℃,而ND2A(E.g.)引物扩增效率自61 ℃到65 ℃呈逐步降低的趋势,故将ND2A(E.g.)引物的最适反应温度定为61 ℃。
A:ND2A(E.m.);B:ND2A(E.g.).1:DL2000 DNA marker,2~6:61℃~65℃图5 ND2A引物最适反应温度的2%琼脂糖电泳图Figure 5 Optimum reactive temperature of ND2A probe in 2% agarose gel electrophoresis
2.5 ND2A引物的Mg2+反应浓度的优化
ND2A引物以1.3~1.7×10-4mM为待选范围、0.1×10-4mM为梯度重复试验浓度选出引物的最适Mg2+反应浓度。ND2A(E.m.)这一引物最适Mg2+反应浓度为1.5×10-4mM,ND2A(E.g.)这一引物最适Mg2+反应浓度为1.7×10-4mM(图6)
A:ND2A(E.m.);B:ND2A(E.g.).1:DL2000 DNA marker,2~6:1.3~1.7×10-4mM图6 ND2A引物最适Mg2+反应浓度的2%琼脂糖电泳图Figure 6 Optimum Mg2+ reactive concen trationin ND2A probe by 2% agarose gel electrophoresis
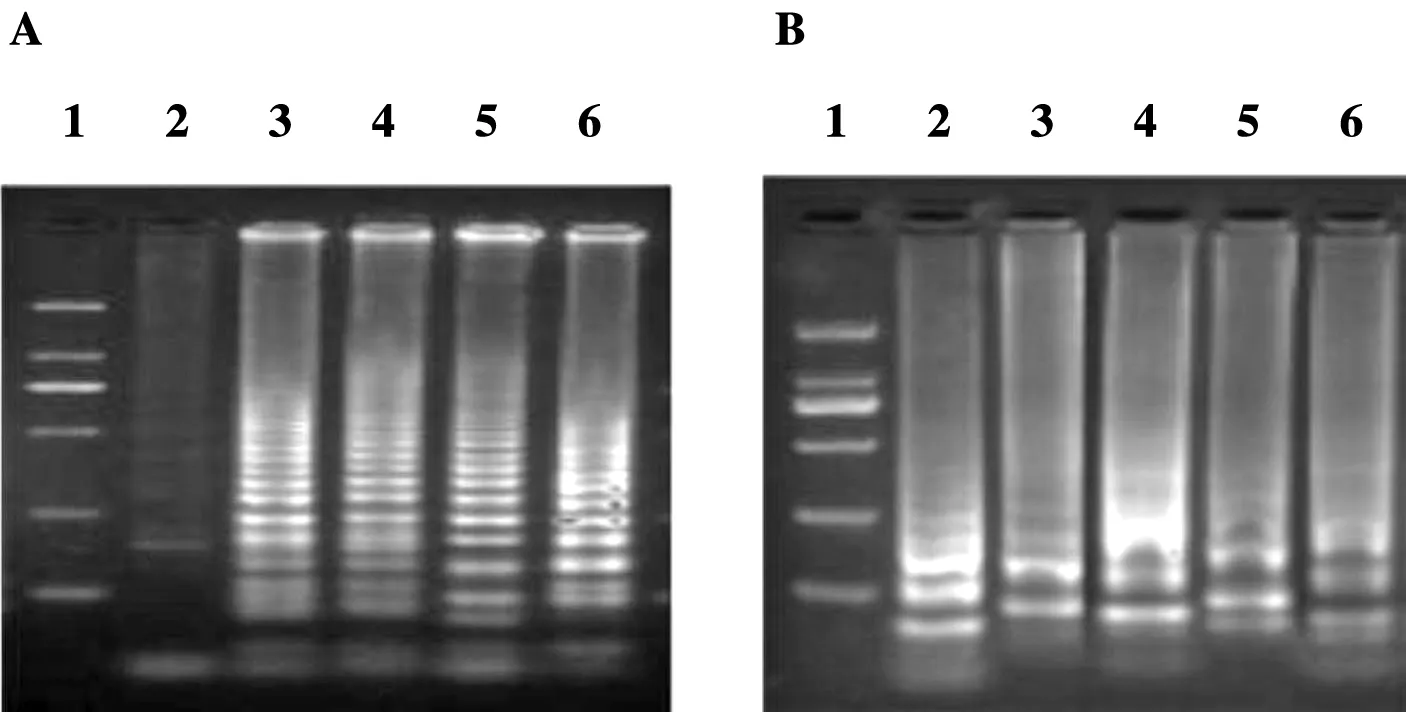
A:ND2A(E.m.);B:ND2A(E.g.).1:DL2000 DNA marker,2~6:3.3~3.7×10-5mM
2.6 ND2A引物的dNTP Mix反应浓度的优化
ND2A引物以3.3~3.7×10-5mM为待选范围、0.1×10-5mM为梯度重复试验浓度选出引物的最适dNTP Mix反应浓度。ND2A(E.m.)这一引物最适dNTP Mix反应浓度为3.4×10-5mM,ND2A(E.g.)这一引物最适dNTP Mix反应浓度为3.5×10-5mM(图7)。
3 讨论
自2013年以来,国内外的研究团队完成了对多房棘球蚴[7]和细粒棘球蚴[8]的全基因组测序,这为棘球蚴的防治奠定了重要基础。现阶段已将PCR技术运用于棘球蚴的检测[9],PCR扩增具有精确敏感快速等优点,但需要熟练操纵技能的人才和昂贵的仪器(热循环仪器)才能完成,造成该技术使用受到限制。而LAMP不但具有PCR的精确敏感快速等优点,还具备反应条件简单便于直接观察等弥补了PCR在基层不便于大规模应用的缺点,被广泛应用于病原体的诊断和鉴别诊断:张伟阳[10]等研究发现LAMP可用于诊断结核分支杆菌;许静[11]等研究发现LAMP可用于早期检测日本血吸虫感染家兔血清的特异性DNA;张超群[12]等研究发现LAMP可用于幽门螺旋杆菌检测及分型研究;王岑[13]等研究发现LAMP可用于诊断日本血吸虫的DNA。
Mohamed E[14]于2016年报道了实时LAMP法用于鉴定细粒棘球蚴G5和G6分型检测、Salant H[15]于2012年报道了LAMP法用于细粒棘球蚴病原体的检测、Ni X[16]于2014年报道了LAMP法用于多房棘球蚴终末宿主肠道内病原体及粪便中虫卵的检测,然而上述三项检测方法不能同时对多房棘球蚴与细粒棘球蚴进行分型检测。由于我国青海省三江源地区和四川省石渠县等流行区属于多房棘球蚴和细粒棘球蚴的混合感染区[17],需要能够准确区分两种病原体的分子生物学方法,本研究旨在建立一种可以有效区分细粒棘球蚴和多房棘球蚴病原体的LAMP反应体系。
本研究进行了多房棘球蚴和细粒棘球蚴基因组的全序列对比,结果显示这两者的全基因组序列存在极大相似性,不利于分型检测。由于多房棘球蚴和细粒棘球蚴线粒体序列相似性在95%以上,故通过常规的引物设计较难区分二者。本研究首先通过序列比对选择了多房棘球蚴与细粒棘球蚴线粒体基因组中ND2基因中差异较大的序列,通过生物信息学软件设计了两组用于区分扩增二者的LAMP引物,经后续试验验证获得了ND2A(E.m.)和ND2A(E.g.)用于有效区分二者,而ND2B(E.m.)和ND2B(E.g.)由于扩增效率、扩增特异性等原因无法有效区分。
LAMP扩增结果的检测方法有多种:2%琼脂糖凝胶电泳检测法灵敏度高,但存在一定的缺点,如易造成污染引起假阳性结果且需要电泳仪等;目视浑浊法(阳性LAMP扩增结果会产生沉淀:dNTPs在Bst酶的作用下会产生PPi,PPi=P2O7,P2O74-和Mg2+作用会产生Mg2P2O7,Mg2P2O7是一种白色沉淀物,会使阳性扩增管产生浑浊)需要有经验的检测人员才能准确判断;反应前、后加入染料观测法(扩增前后颜色的不同)优于上述方法。
反应前、后加入染料观测法最初采用SYBR greenⅠ,但因其不能特异性指示LAMP产物,并且在反应前加入会抑制反应的进行;需要在反应之后开盖加入,易造成污染引起假阳性结果。之后采用钙黄绿素,但钙黄绿素需要和锰离子进行一定比例的配比才能达到检测目的,且较不稳定。最后采用的是生物公司制备的LAMP可见光染料,阳性扩增结果会从原先的紫色变成天蓝色,肉眼便可断定结果,且该染料在反应前便加入反应体系中,既不会抑制反应进行也不需要开盖加入而造成污染引起假阳性结果。
本实验最终筛选出的ND2A引物,是针对多房棘球蚴和细粒棘球蚴线粒体基因组中的ND2基因设计的,其BLAST结果显示为没有明显的相似性,为多房/细粒棘球蚴的分型检测提供了有效方法。利用LAMP采用ND2A引物这一体系,初步建立起了一种多房/细粒棘球蚴分型的快速检测方法,并进行了反应温度的优化:ND2A(E.m.)的最适温度为64 ℃,ND2A(E.g.)的最适温度为61 ℃。上述工作将为后续应用于不同环境棘球绦虫污染源的检测奠定了前期实验基础。
本研究通过多房棘球绦虫与细粒棘球绦虫线粒体ND2基因设计,筛选获得可用于分型鉴别多房/细粒棘球蚴的LAMP引物的方法,并进一步通过优化反应条件,建立了一种基于LAMP技术用于多房/细粒棘球蚴分型检测的分子生物学方法。

