托珠单抗治疗中重度类风湿关节炎的临床研究
苏 哲,张 宁
0 引言
类风湿关节炎(Rheumatoid arthritis,RA)是以侵蚀性、对称性多关节炎为临床表现的慢性、全身性自身免疫疾病。关节滑膜的慢性炎症、增生形成血管翳,侵犯关节软骨、软骨下骨、韧带和肌腱等,并逐渐出现关节软骨和骨破坏,最终导致关节畸形和功能丧失。一般认为RA发病始于免疫细胞如巨噬细胞和中性粒细胞表达。这些细胞产生不同类型的细胞因子IL-6和TNF-α等。IL-6与TNF-α参与T细胞分化成Th17,Th17产生IL-17。IL-17与其他细胞因子在免疫细胞分化中起协同作用。IL-6也参与B细胞分化为浆细胞。此外,IL-6和IL-1b增强滑膜细胞扩散,通过产生不同的细胞因子、标志物和酶,如VEGF、TGFβ、COX-Ⅱ、RANKL和MMPs等,导致血管生成、细胞凋亡、软骨破坏和骨侵蚀[1]。目前,临床上治疗RA的常用药物是慢作用抗风湿药物,其特点是药效发挥较慢,起效时间长。且长时间使用抗风湿药物治疗时,易产生骨髓抑制,影响治疗效果[2]。因此,新兴的生物制剂备受关注。
托珠单抗是一种单克隆抗体,作为IL-6受体拮抗剂,被批准用于治疗中度至重度活动性类风湿性关节炎。托珠单抗可以联合或不联合MTX(甲氨蝶呤)或其他DMARDs(改善病情药物)药物。随机对照试验(RCT)证实了托珠单抗对改善RA活动性的有效性[3-4]。此外,对RCT人群进行病后分析显示,给予托珠单抗单药治疗可改善RA患者的生活质量[5-6]。
本研究通过回顾性收集、分析应用托珠单抗治疗的中重度RA患者的临床资料,观察托珠单抗的临床疗效及不良反应。
1 资料与方法
1.1 病例选择 选择2016年1月1日至2018年8月1日我院风湿免疫科门诊或住院的RA患者30例。应用药物前,向患者充分交代药物的不良反应与可能发生的不良事件,签订书面知情同意后,确定为试验对象。入选标准:①符合2009年版类风湿性关节炎ACR/EULAR分类标准诊断。总分在6分以上即确诊为RA。②在用托珠单抗治疗前,所有患者应停用非甾体抗炎药1个月以上。排除标准:①有严重心、肝、肾等重要脏器和血液、内分泌系统病变及病史者;②孕妇、哺乳期妇女;③活动性感染和/或具有重症感染机会的患者;④对托珠单抗严重过敏者;⑤恶性肿瘤患者或有家族史的易感人群;⑥近1个月应用糖皮质激素;⑦诊断有其他自身免疫疾病患者。
1.2 给药方法 第0、4、8、12、16周,分别静脉给予托珠单抗,受试者每4周静脉滴注1次托珠单抗8 mg/kg,对于体重大于100 kg患者,每次最大剂量不超过800 mg。30例患者均给予托珠单抗单药治疗。治疗期间,如果患者肝酶升高大于正常上限的1~3倍,可减量或暂停使用托珠单抗;如重复肝酶升高>3倍正常上限或单次升高>5倍正常上限,停用托珠单抗。如中性粒细胞绝对计数<0.5×109/L,停用托珠单抗。血小板计数<50×109μl,停用托珠单抗。
1.3 观察指标 观察患者血常规、关节肿胀数(SJC)、关节压痛数(TJC)、25-OH VitD、D-二聚体(DD)等指标。
1.4 疗效评价 采用DAS28评分评价活动性,按照DAS28评分将疾病活动性分为4级:缓解(<2.6),轻度活动(2.6~3.2),中度活动(3.2~5.1),重度活动(>5.1)。治疗后患者DAS28降低>1.2为有效,DAS28降低<0.6或DAS28>5.1为治疗无效。
1.5 不良反应 记录两组患者不良反应发生时间、严重程度、持续时间,采取的措施及结果,以及是否需要终止治疗。
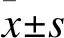
2 结果
2.1 一般资料 共计30例中重活动性RA患者入组,其中男2例,女28例。第1次应用托珠单抗患者,年龄29~75岁,平均年龄(46.63±12.04)岁;病程5~244个月,平均病程(102.37±67.19)个月。23例患者血清高水平RF或高水平抗CCP抗体,其中抗CCP抗体阳性率为76.7%。患者基本信息见表1。

表1 患者基本信息及既往抗风湿治疗方案
注:GC:激素,MTX:甲氨蝶呤,LEF:来氟米特(妥抒、爱若华),CTX:环磷酰胺,TNF-αII(益赛普),GTW:雷公藤,TGP:帕夫林,HCQ:羟氯喹,恩利(依那西普),艾拉莫德片,SSZ:柳氮磺吡啶,TNF-α:英夫利昔单抗,MMF:吗替麦考酚酯
2.2 疗效指标 治疗4周时,与基线资料比较,患者HGB、PLT、WBC、25-OH VitD、D-二聚体、DAS-28均明显改善,差异有统计学意义(P<0.05);治疗16周时,与基线资料比较,患者HGB、PLT、WBC、NEU(%)、LYM(%)、25-OH VitD、D-二聚体、DAS-28均明显改善,差异有统计学意义(P<0.05)。见表2。

表2 托珠单抗疗效指标比较(n=30)
注:*治疗4周与基线比较;#治疗16周与基线比较
2.3 不良反应 30例患者中,出现局部注射反应者1例,2 d内可自动消失。发生肝酶异常(转氨酶未超过正常值上限2倍)2例,停药后复查正常。未出现严重的感染、胃肠道症状及脑缺血发作或中风等不良反应。
3 讨论
RA是一种慢性全身性自身免疫性疾病,其特点是关节压痛、肿胀以及关节结构的逐步退化。由于疼痛、僵硬、疲劳和身体功能受损,导致RA患者出现健康相关的生活质量下降[7-10]。对于临床医生来说,合理选择RA治疗药物非常重要。
托珠单抗作为IL-6受体拮抗剂,被批准用于治疗中度至重度活动性类风湿性关节炎。RCT证实了其对改善类风湿性关节炎活动性的有效性[5-6]。此外,对RCT人群进行病后分析显示,给予托珠单抗单药治疗可改善RA患者的生活质量[6]。对于托珠单抗改善RA病情活动性,张如峰等[11]认为,IL-6是多种细胞因子中的关键因素,在细胞存活、分化、增殖、凋亡中有重要作用。托珠单抗与IL-6受体进行特异性结合,阻断IL-6信号转导,改善CRP、ESR,减少B细胞活化,最终控制RA。王硕等[12]认为,IL-6作为一种炎性细胞因子,能诱导肝脏合成急性期蛋白,其浓度与疾病活性及临床表现密切相关,是RA最主要的致病因子之一。IL-6可以诱导内皮细胞表达黏附分子,促进白细胞与血管内皮黏附渗透导致局部炎症。本研究中,经过托珠单抗治疗后,患者DAS28明显改善,表明其对活动性类风湿有较好的疗效,且起效迅速。
RA伴贫血的发病机制目前尚未明确。研究表明,RA伴贫血可分为慢性贫血(ACD)和缺铁性贫血(IDA)两种。慢性贫血是RA中贫血的最常见原因,一般认为主要由IL-6-铁调素轴介导的[13]。铁调素抑制铁在小肠的吸收并阻止铁从巨噬细胞的释放及转运,有效地减少铁在骨髓中成熟红细胞,从而容易出现贫血。而IL-6在肝细胞内诱导产生铁调素。对于缺铁性贫血,有人认为是由用非甾体抗炎药物相关的胃肠道溃疡丢失引起;另外,研究发现,RA伴IDA患者血清铁调素和铁蛋白水平也较低[13]。本研究中,经过4、16周的治疗,患者贫血得到明显改善,表明托珠单抗对RA贫血治疗的有效性。但是本研究托珠单抗治疗前未对患者进行慢性贫血与缺铁性贫血的鉴别,因此,托珠单抗对RA合并慢性贫血和合并IDA皆有改善,还是对两者治疗有差异,将是进一步研究的方向。
Fleischmann等[14]研究发现,经托珠单抗治疗后,血小板增高等全身系统症状也得到明显改善。研究显示,受试者血小板较前降低,差异有统计学意义,血小板没有明显减少,表明治疗后血小板增高能得到改善。提示在托珠单抗治疗期间,应密切关注血小板指标,避免血小板明显降低的发生。
本研究中,治疗4、16周后,25-OH VitD、D-二聚体指标较治疗前明显改善,差异有统计学有意义,表明托珠单抗对RA合并凝血异常、维生素D缺乏治疗的有效性。
本研究中,未发现需要停止治疗的严重不良反应。有1例患者出现局部注射反应,2 d内可自动消失。有2例受试者发生过肝酶升高不良事件,均在停药后缓解。虽然本研究中患者未出现严重的感染、胃肠道症状及脑缺血发作或中风等不良反应,但生物制剂的不良反应仍然非常需要临床关注。同时,托珠单抗的适用人群应排除严重感染、结核、肝炎、肿瘤患者。托珠单抗治疗期间,应进行安全性监测。由于本次实验观察时间较短、病例较少,在随访中尚未发现相关疾病发生,但托珠单抗治疗RA的感染的长期风险有待长期大数据支持。
总之,托珠单抗对中重度RA有较好疗效,且起效迅速,能改善炎症指标,降低疾病活动度,改善贫血,改善凝血,提高维生素D水平。本研究结果也表明,托珠单抗治疗RA具有较好的安全性。我们的研究是单中心观察,患者数量较少,并且随访时间较短,托珠单抗治疗RA的长期疗效及安全性需要更大的多中心队列研究来证实。

