自发性孤立性肠系膜上动脉夹层16例临床诊治分析
韩道正 沈 超 周 云 吴 昊 王 燕 孙 蓬
扬州大学附属医院血管外科,江苏 扬州 225012
肠系膜上动脉夹层(superior mesenteric artery dissection,SMAD)曾经被认为是主动脉夹层累及肠系膜上动脉(superior mesenteric artery,SMA)所致,但真正的自发性孤立性肠系膜上动脉夹层(spontaneous isolated superior mesenteric artery dissection,SISMAD)由Bauersfeld[1]最早提出。该疾病早期在世界范围内鲜见报道,常以罕见病例报告的形式出现,但随着腹部影像学检查技术发展并应用于急性腹痛患者诊断检查,使得检出SISMAD的病例数得以极大提高。因此,SISMAD得到国内外的广泛关注。本研究通过对16例SISMAD患者临床资料进行分析研究,为该病的诊治策略提供理论支持,现报告如下。
1 资料与方法
1.1 一般资料
收集扬州大学附属医院血管外科2012年5月至2017年5月收治的16例SISMAD患者进行分析研究,其中男性14例,女性2例,年龄39 ~ 60岁,平均年龄(49.6±2.8)岁。11例合并高血压,1例合并糖尿病,1例合并慢性肾病,1例合并冠状动脉疾病;1例合并心房颤动;1例合并慢性阻塞性肺疾病。2例从不吸烟;3例现已戒除吸烟;11例仍继续吸烟。15例出现症状,1例无症状。11例行保守治疗,5例行血管腔内治疗。所有患者均经腹部计算机断层扫描血管造影(computed tomographic angiography,CTA)确诊。诊断标准:(1)SMA内见双腔结构,双腔内见造影剂;(2)SMA内见内膜片形成,甚至可见偏心性钙化斑;(3)SMA壁内可见半月形结构,可伴有溃疡,与动脉腔相通;同时主动脉及其他内脏动脉通畅,无夹层病变表现。发病时间3 h~10 d。
1.2 影像学分型
本研究采用2009年,Yun等[2]提出的SISMAD分型:Ⅰ型,假腔有入口和出口,血流通畅; Ⅱa 型,血流可经入口进入假腔,但无出口; Ⅱb 型,假腔内血栓形成,无血流;Ⅲ型,夹层导致真、假腔均闭塞。
1.3 治疗方案
SISMAD治疗的目的是限制夹层的进一步进展,防止假腔破裂,并维持真腔远端血液供应。若患者CTA图像显示SMA存在直径大于2cm的动脉瘤或真腔的狭窄率大于80%,则积极一期行血管腔内治疗[3],其余患者确诊后立即予以抗凝治疗,若患者腹痛症状逐步缓解,无进一步加重,无明显腹膜炎体征,则继续行保守治疗。若患者经保守治疗后腹痛症状无缓解或加重,复查CTA显示夹层范围进展,或者出现严重持续肠缺血症状,应积极转为腔内治疗。动脉破裂和肠坏死是开放手术治疗的绝对指征。
1.3.1 保守治疗
明确诊断后立即给予抗凝治疗(低分子肝素钠100 IU/kg,皮下注射,12 h/次),禁食、镇痛、扩张血管、抑制血管痉挛和开放静脉通道,予以肠外营养支持及促进胃肠道排空,从而减轻胃肠道负担。合并高血压的患者维持血压在正常范围[4]。在抗凝治疗下如果肠道缺血症状缓解或没有进一步加重可考虑继续行保守治疗,并根据病情变化逐渐过渡饮食(流质饮食—半流质饮食—软食)。出院后改用华法林抗凝(国际标准化比值控制在2.0~2.5),抗凝时间6个月,6月后可继续抗血小板治疗(阿司匹林肠溶片75~100 mg/d,≥18个月)。
1.3.2 血管腔内治疗
有3例患者SMA真腔狭窄率超过80%,一期行血管腔内治疗;2例患者先行保守治疗后腹痛症状无缓解,复查CTA显示夹层范围进展,转为血管腔内治疗被列为腔内治疗组,行血管腔内治疗:1%利多卡因局部麻醉后,细针穿刺左股动脉成功,置入5F短鞘,再置入150cm泥鳅导丝及5F PIGTAIL导管,造影示左髂动脉连续性显影,管腔无明显狭窄。导丝配合导管进入T12水平。DSA机头转左右位,造影示:腹主动脉,腹腔干动脉,双肾动脉连续性显影,管腔无明显狭窄,肠系膜上动脉距离开口处仔细寻找破口,明确夹层长度,远端真腔连续性显影并发出多根分支动脉。交换置入6F长鞘于肠系膜上动脉开口水平,150 cm泥鳅导丝配合4F单弯导管,造影指引下顺利进入肠系膜上动脉真腔进一步进入真腔远端,交换260 cm导丝,长鞘跟进于肠系膜上动脉近端后撤去单弯导管,经鞘造影定位后,跟进EV3自膨式EverFlex 6 mm×40 mm支架覆盖夹层破口,跟进单弯导管造影示:支架形态良好,血流通畅,无残余狭窄,夹层破口未再显影,假腔消失,支架远端动脉管径明显增粗,流速增快,各肠系膜上动脉分支显影良好,经单弯导管注入罂粟碱30mg稀释液后撤除全部介入输送系统。术后继续给予抗凝治疗及抗血小板治疗。出院后改用华法林抗凝(抗凝时间≥6个月),国际标准化比值控制在2.0~2.5之间。
1.4 统计学方法
采用描述性统计学方法,计数资料采用n(%);计量资料采用(±s)表示。

2 结果
16例SISMAD患者,其中11例行保守治疗患者经抗凝、禁食和(或)胃肠减压、改善微小血管循环和营养支持治疗后,腹痛症状逐渐消失;1周后复查腹部CTA提示患者SISMAD无明显加重,真腔血流通畅。5 例行血管腔内治疗,手术技术成功率100%;2例经股动脉入路,3例经左肱动脉入路。1例患者仅行经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA);其余4例患者行PTA+自膨式裸支架EverFlex 6 mm×40 mm植入术,共植入5枚,术后造影显示SMA真腔血流通畅,SMA分支血管显影良好,假腔消失(见表1,图1)。在操作过程中为避免发生远端血管痉挛,常规经导管注射罂粟碱30 mg 稀释液,无并发症发生。
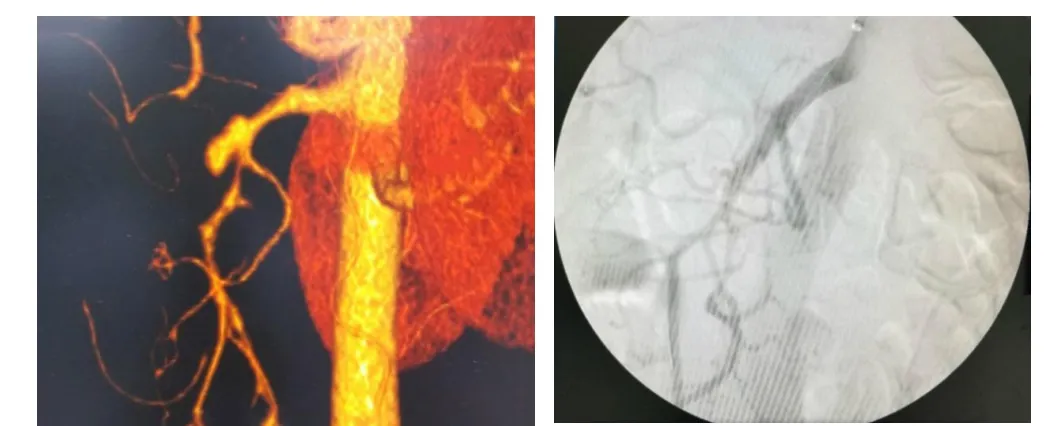
图1 血管腔内治疗术前CTA影像及治疗后数字减影血管造影影像
3 讨论
SISMAD发病原因尚不清楚,目前认为可能与动脉壁病理改变[5-6]及动脉壁基质中弹性蛋白和胶原蛋白下降[7]有关。最近的研究发现还可能与血流动力学变化和高同型半胱氨酸血症相关,高血压及吸烟[8,9]被认为是独立危险因素。
SISMAD的确诊则依赖于腹部CTA检查,CTA检查不仅可以清晰地显示动脉夹层的位置和范围,还有助于判断肠管缺血和坏死情况[10],对治疗方案的选择起到关键作用。在SISMAD的CTA图像上,需要重点观察破口的数量及位置,夹层段的长度和真假腔直径,真腔的通畅程度以及是否存在肠系膜血肿、肠缺血及夹层段是否掩蔽分支血管的开口及其他并发夹层的存在。
本组11例患者行保守治疗,经抗凝治疗,禁食,控制血压在正常范围,镇痛,扩张血管、抑制血管痉挛,开放静脉通道予以肠外营养支持治疗后,患者腹痛症状逐渐消失,1周后复查腹部CTA提示患者SISMAD无明显加重,真腔血流通畅,假腔无进一步进展,逐步过渡饮食后无明显不适症状而出院。出院后改用华法林抗凝(国际标准化比值控制在2.0~2.5,抗凝时间6个月)。6月后可继续抗血小板治疗。目前在是否必要行抗血小板治疗,抗血小板治疗为单抗方案还是双抗方案;是否必要行抗凝治疗;抗凝还是抗血小板治疗;是否需要抗血栓治疗上意见不一,仍有争议。欧洲血管外科学会(European Society of Vascular Surgery ,ESVS)2017年4月发布了肠系膜血管疾病管理临床指南[4],建议使用抗血小板治疗或低分子肝素或普通肝素直至症状消退。
Leung[11]等2000 年首先报道采用Wallstent自膨式支架治疗SISMAD,随后腔内治疗成功的报道日趋增多。血管腔内治疗可早期恢复动脉血流,有利于快速缓解症状,并且创伤小、恢复快,目前已成为SISMAD 非保守治疗的首选方法。手术入路的选择主要根据肠系膜上动脉走行与腹主动脉的夹角θ决定,当θ≤45°时,一般选择经肱动脉或桡动脉入路,此时导丝容易超选进入肠系膜上动脉真腔;当45°<θ≤90°时,选择经股动脉入路或者经肱动脉、桡动脉入路;当θ>90°时,选择经股动脉入路。本组研究5 例患者行血管腔内治疗, 1例患者仅行PTA术,未植入支架;共植入5枚自膨式裸支架;2例经股动脉入路,3例经左肱动脉入路。术毕造影显示支架形态良好,血流通畅,无残余狭窄,夹层破口未再显影,假腔消失,支架远端动脉管径明显增粗,流速增快,各SMA 分支血管显影良好,效果满意。
综上所述,多数患者经保守治疗后能够取得较为满意的治疗效果,可作为不具有肠严重缺血、腹膜炎、肠坏死、夹层破裂或动脉瘤症状患者的初始治疗方案。如果真腔狭窄程度较重、累及远端回结肠动脉、腹痛不能缓解或复发、或出现严重持续肠缺血症状,应考虑血管腔内治疗或开放手术。血管腔内治疗具有微创、手术时间短、手术成功率高、并发症少、住院时间短等特点,较开放手术具有一定优势。但目前仍缺乏大规模多中心研究经验、以及长期疗效的相关循证医学证据的支持。
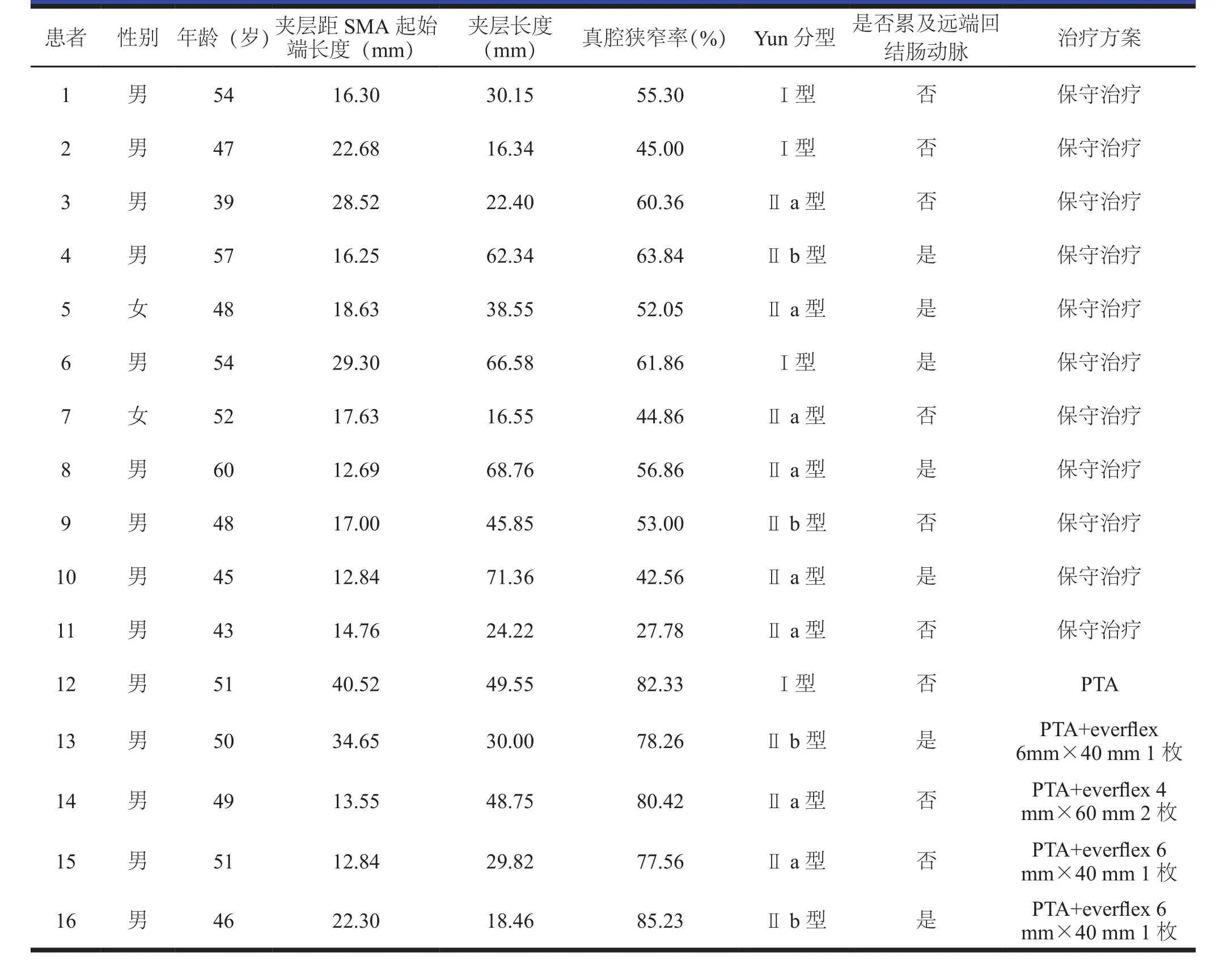
表1 16例SISMAD患者的临床资料

