硬齿猕猴桃组织培养和快速繁殖技术研究
毕海林,吴永斌,杨洪涛,杨燕林,杨正松,和文佳*
(1.云南省农业科学院 高山经济植物研究所,云南 丽江 674199;2.云南丽江蓝玛生物科技开发有限责任公司,云南 丽江 674199)
硬齿猕猴桃(ActinidiacallosaLindl.),是猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl)一种大型落叶藤本。该种是一个庞杂的大类群,形态多样,其共同点是近全体无毛,仅部分的脉腋和花序花萼等处被毛。硬齿猕猴桃为原变种,共有6个变种,分别为台湾猕猴桃、尖叶猕猴桃、毛叶硬齿猕猴桃、京梨猕猴桃、异色猕猴桃、驼齿猕猴桃。硬齿猕猴桃分布于中国长江以南各省区,西起云贵高原和四川内陆,东至台湾省,云南文山、漾濞、景东、凤庆、富宁、屏边等地均有分布,此外,印度、不丹和印度北部地区也有分布[1]。猕猴桃的质地柔软,口感酸甜,味道被描述为草莓、香蕉、菠萝三者的混合。猕猴桃除含有猕猴桃碱、蛋白水解酶、单宁果胶和糖类等有机物,以及钙、钾、硒、锌、锗等微量元素和人体所需的17种氨基酸外,还含有丰富的维生素C、葡萄酸、果糖、柠檬酸、苹果酸、脂肪。1颗猕猴桃能提供1个人一日维生素C需求量的两倍多,被誉为“水果之王”。猕猴桃还含有良好的可溶性膳食纤维以及具有出众抗氧化性能的植物性化学物质SOD。猕猴桃还具有稳定情绪、降胆固醇、帮助消化、预防便秘、止渴利尿和保护心脏等作用。我国是猕猴桃的原产地,有着丰富的猕猴桃遗传资源[2]。猕猴桃大多是雌雄异株,采用种子繁育,周期长,且较难鉴别幼株性别,不易获得大批雌株群体;而利用扦插、嫁接的育苗方法,存活率较低。与其他育苗方式相比,组织培养不但能周年供苗,高效快速,而且成本低廉。 1975年Hirsch首次以猕猴桃茎段为材料,进行离体培养,为猕猴桃组织培养的研究工作揭开了序幕;从此,国内外利用组织培养技术快速繁殖猕猴桃受到了广泛的重视[3-8]。国内外有关猕猴桃栽培品种组织培养的研究报道较多,有关猕猴桃野生种组织培养的研究报道也不少见,而有关硬齿猕猴桃的组培快繁技术尚未见报道。我们对硬齿猕猴桃进行了组织培养、快速繁殖技术的研究,以期为硬齿猕猴桃野生资源的开发和利用奠定基础。
1 材料与方法
1.1 材料
硬齿猕猴桃果实、枝条,取自云南沧怒分水岭。
1.2 方法
1.2.1 外植体消毒及初代培养 以硬齿猕猴桃的干种子、带腋芽茎段作为外植体。9月下旬取硬齿猕猴桃的成熟果实和枝条进行处理,干种子为从成熟果实中洗出并晾干的当年种子。将种子、茎段均用洗衣粉液浸泡5 min,用流水冲洗2 h,然后放入超净台,用70%乙醇消毒30 s,用无菌水浸洗2次,再用0.1%升汞溶液分别消毒2、8 min,最后用无菌水浸洗5次后供接种使用。将种子、茎段直接接种在以下5种诱导培养基上:MS基本培养基、MS+0.5 mg/L 6-BA+0.2 mg/L IBA、MS+0.5 mg/L 6-BA+0.5 mg/L IBA、MS+0.5 mg/L ZT+0.2 mg/L IBA、MS+0.5 mg/L ZT+0.5 mg/L IBA。培养温度为(25±2)℃,光照强度为3000 lx,光照时间为12 h/d,培养基pH值均为5.8。每瓶培养基接种10粒种子或1个茎段,以60粒种子或60个茎段为1个组合,分别重复3次,观察记录种子及茎段的变化情况,对种子培养150 d以后的生长情况、茎段培养45 d以后的生长情况进行统计及分析。
1.2.2 继代增殖培养 培养基均为MS培养基。 将初代培养萌发的种子苗和腋芽新枝剪成约1 cm的茎段,接种到含不同激素配比的6种增殖培养基上,增殖培养基分别为MS+1.0 mg/L 6-BA、MS+1.0 mg/L 6-BA+0.1 mg/L IBA、MS+1.0 mg/L 6-BA+0.2 mg/L IBA、MS+2.0 mg/L 6-BA、MS+2.0 mg/L 6-BA+0.1 mg/L IBA、MS+2.0 mg/L 6-BA+0.2 mg/L IBA。培养条件与初代培养相同,每瓶接4个茎段,培养45 d后测量苗的高度及统计新转接的培养瓶数,每种配方统计测量6瓶。
1.2.3 生根培养及炼苗移栽 将试管苗剪去基部愈伤组织,并剪成约长2 cm的茎段,接种在以下5种生根培养基上:1/2MS、1/2MS+0.5 mg/L IBA、1/2MS+1.0 mg/L IBA、1/2MS+1.5 mg/L IBA、1/2MS+2.0 mg/L IBA。培养条件与初代培养及继代培养相同;在培养第45天观察统计生根情况,每种配方统计测量6瓶。将试管苗进行炼苗,即把培养瓶微开盖,3 d后将瓶盖打开1/3左右,再过3 d将瓶盖去除,2 d之后进行移栽,以草炭土和珍珠岩(10∶1)作为苗床基质,用消毒剂将苗床进行消毒,移栽时尽量剪去叶片;移栽后要注意保持空气湿度,并遮荫养护。
将试管苗剪去基部愈伤组织,并剪成约长2 cm的茎段,蘸1000 mg/L IBA后分别扦插在细沙+珍珠岩(20∶1)、草炭土+珍珠岩(20∶1)、椰糠+珍珠岩(20∶1)、松针粉+珍珠岩(20∶1)4种基质中,将基质分别盛放在70孔穴盘中;扦插以后放入大棚里的塑料小拱棚内,观察生根情况,每种基质观察3盘,并在第45天统计生根情况;在第75~90天将穴盘苗上营养钵或进行大田移栽。
2 结果与分析
2.1 硬齿猕猴桃外植体初代培养生长情况
由表1和图1可以看出,硬齿猕猴桃种子在培养基中需要很长时间才能萌发,普遍需要4个月以上才开始萌发,且在5个月后观察统计时,发现种子萌发率普遍不高,其萌发率在60%~75%。加了激素6-BA、ZT、IBA的培养基与不加激素的培养基相比,无论是种子萌发时间,还是种子萌发率均差异不明显。在MS基本培养基中,种子萌发后苗长高较快,基部不形成愈伤组织,最后统计时苗最高;而在加了不同浓度的6-BA、IBA、ZT或IBA的培养基上,种子萌发后基部均逐渐膨大形成或多或少的淡绿色致密的愈伤组织,但在形成的愈伤组织上没有分化出丛生芽,苗长得较慢。由此说明,一定浓度的激素6-BA、ZT、IBA对硬齿猕猴桃种子的萌发无促进作用,不加激素的MS基本培养基是硬齿猕猴桃最佳的种子启动培养基。
由表1和图1还可见,硬齿猕猴桃带腋芽的茎段腋芽萌发较快,在加有一定浓度的激素6-BA、ZT或IBA的培养基中一般培养1周腋芽就开始萌发;在不加激素的培养基中腋芽萌发较缓慢,需要2周多才能萌发。另外,在加有一定浓度的激素6-BA、ZT或IBA的培养基中腋芽的萌发率较高,基本在90%以上,而且腋芽萌发后伸长较多,在45 d统计测量时,伸长的腋芽枝条平均长度普遍超过3 cm;在不加激素的培养基中腋芽萌发较缓慢,且腋芽萌发后伸长极少。另外,对比加有激素的4种培养基发现:当细胞分裂素6-BA、ZT的浓度相同时,较低浓度的生长素IBA更有利于腋芽枝条的生长;而当生长素IBA的浓度相同时,一定浓度的细胞分裂素6-BA、ZT均有利于腋芽枝条的生长,且6-BA和ZT差别不明显。故MS+0.5 mg/L 6-BA+0.2 mg/L IBA可作为硬齿猕猴桃较佳的茎段腋芽的初代培养启动培养基。
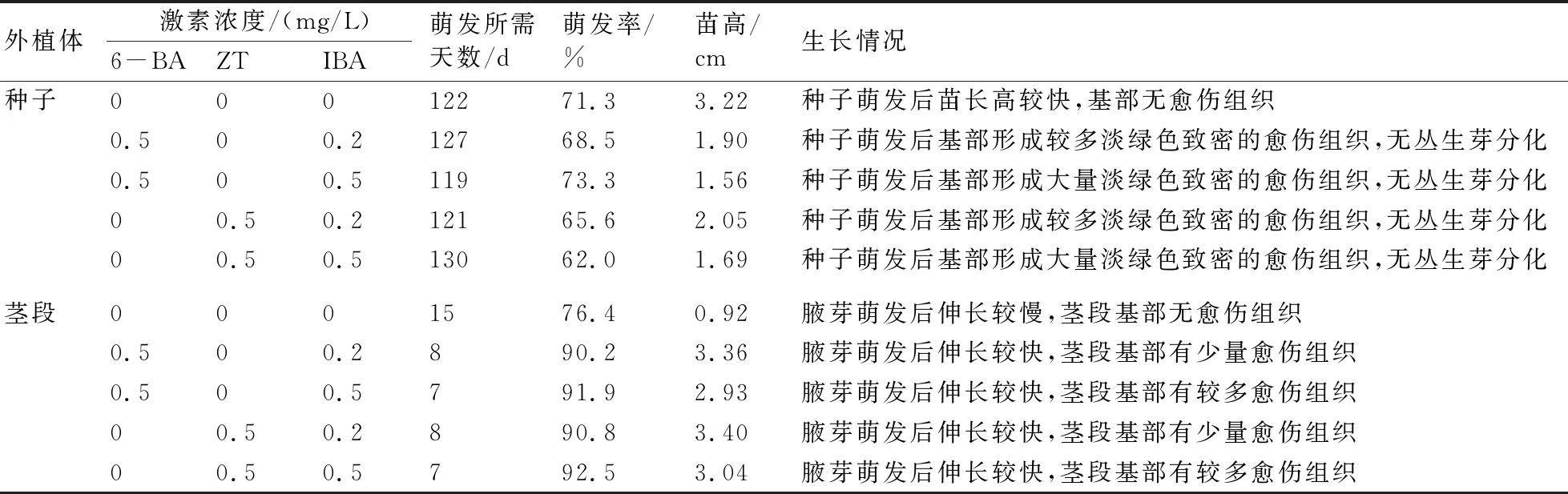
表1 2种硬齿猕猴桃外植体在MS基本培养基上初代培养的生长情况

A,种子开始萌发; B,腋芽生长状态; C,继代培养第45天时的增殖状态;D,培养瓶内生根培养第45天时的生根状态; E,瓶外生根培养第45天时的生长情况。
2.2 不同激素对硬齿猕猴桃不定芽分化和增殖的影响
由表2可以看出,在培养45 d后,不同浓度的6-BA和IBA对硬齿猕猴桃的增殖影响较显著。当细胞分裂素6-BA的浓度为1.0 mg/L时,不加生长素IBA的培养基中苗长得也较高,只是苗的基部基本上没有愈伤组织形成,形成的丛生芽极少,其增殖系数最低,但也达到了4.6;而在加较低浓度生长素IBA的培养基中苗长得最高,苗的基部有较少的愈伤组织形成,但丛生芽分化较少,增殖系数稍高;在加较高浓度生长素IBA的培养基中苗长得较高,苗的基部有较多的愈伤组织形成,丛生芽分化也较多,增殖系数较高。当细胞分裂素6-BA的浓度为2.0 mg/L时,在不加生长素IBA的培养基中苗长得较高,只是苗的基部基本上没有愈伤组织形成,形成的丛生芽极少,其增殖系数较低;而在加较低浓度生长素IBA的培养基中苗长得稍高一些,苗的基部有较少的愈伤组织形成,丛生芽分化较少,增殖系数也较低;在加较高浓度生长素IBA的培养基中苗长得最矮,但苗的基部有较多的愈伤组织形成,此时丛生芽分化最多,增殖系数最高,达到7.4。由此可见,较高浓度的生长素IBA有利于硬齿猕猴桃愈伤组织的形成,而且较高浓度的细胞分裂素6-BA的协同作用有利于其丛生芽的分化。培养基MS+2.0 mg/L 6-BA+0.2 mg/L IBA较有利于硬齿猕猴桃的增殖。
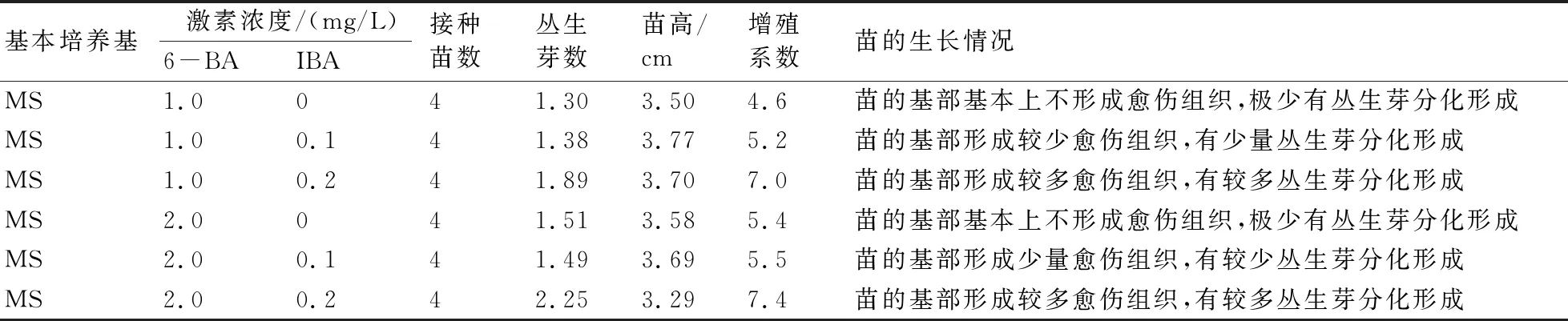
表2 不同激素对硬齿猕猴桃不定芽分化和增殖的影响
2.3 生根培养及炼苗移栽
2.3.1 不同浓度生长素IBA对硬齿猕猴桃培养基内生根的影响 由表3可以看出,无论加不加生长素IBA,所有培养基中苗基部或多或少均形成愈伤组织,根原基形成一般均需1周左右。在不加生长素IBA的培养基中,根基部愈伤组织较小,生根率达到100%;而在加有生长素IBA的培养基中,根基部愈伤组织均较大,且浓度越高,愈伤组织通常越大,极少量的苗只有愈伤组织但不长根,生根率略有降低;在不加生长素IBA或加有较高浓度 IBA的培养基中,苗长得较高,平均根长也较长;随着IBA浓度的增高,生根数逐渐增多,在加较高浓度IBA的培养基中苗最高,平均根长最长,根数也最多。综合来看,1/2MS基本培养基是硬齿猕猴桃较佳的生根培养基。
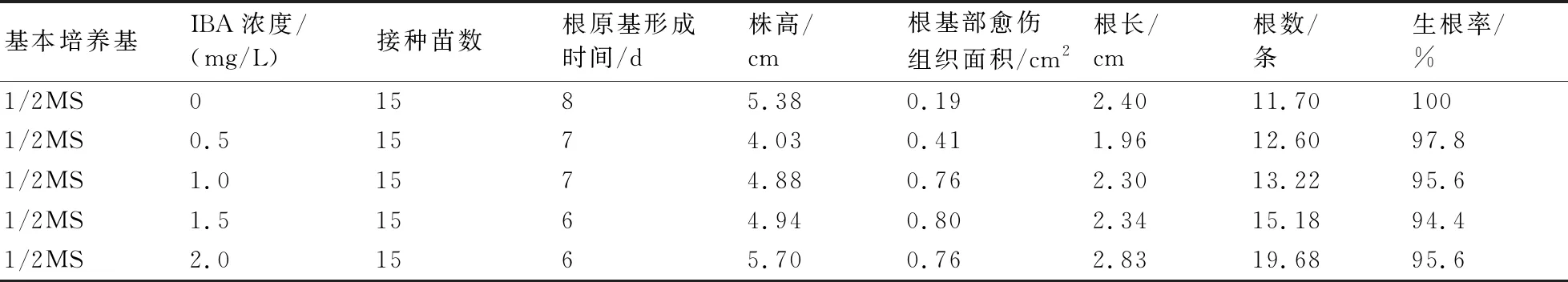
表3 IBA浓度对硬齿猕猴桃培养基内生根的影响
2.3.2 不同基质对硬齿猕猴桃培养瓶外生根的影响 由表4可以看出:当细沙+珍珠岩作为基质时,硬齿猕猴桃的生根率较低,开始生根的时间也较长,生根后苗也长高较少;而在草炭+珍珠岩、椰糠+珍珠岩、松针粉+珍珠岩3种基质中,硬齿猕猴桃长根较快,生根率也较高,生根后苗也长高较多,其中在草炭+珍珠岩、椰糠+珍珠岩基质上生根率稍高,在椰糠+珍珠岩上苗生根后长高最多。综合来看,椰糠+珍珠岩(20∶1)是硬齿猕猴桃较好的培养瓶外生根基质。

表4 不同基质对硬齿猕猴桃培养瓶外生根的影响
3 讨论与结论
在本实验中,一定浓度的细胞分裂素6-BA、ZT与较低浓度的生长素IBA协同作用有利于硬齿猕猴桃腋芽枝条的萌发及生长;当IBA的浓度相同时,一定浓度的6-BA、ZT均有利于腋芽枝条的生长。因为玉米素ZT是一种价格非常昂贵的激素,而6-BA又比较便宜,因此在今后硬齿猕猴桃初代培养腋芽萌发及生长时,宜选用6-BA而不用ZT,这样能有效降低硬齿猕猴桃组培苗的生产成本,有利于其下一步产业化发展。
在硬齿猕猴桃培养基内生根诱导时,加了生长素IBA以后,苗基部形成了较大的愈伤组织,这会对今后的炼苗移栽造成一定程度的影响,甚至会降低炼苗移栽的存活率。
另外,培养基内诱导生根和瓶外基质内扦插均能使硬齿猕猴桃高效生根,但两种方式各有优缺点。在培养基内诱导生根,当试管苗开始生根以后,苗迅速长高,在第45天统计时,苗长高了2~3倍,但整个过程需在超净工作台上无菌操作完成,费时费力,且需要进行后期的基质内炼苗移栽。在瓶外基质内扦插,苗长根后生长较缓慢,但整个过程无需超净工作台,可以聘请大量工人在短时间内完成扦插,且生根后养护一段时间后可直接上营养钵或进行大田移栽,即将“生根”与“炼苗移栽”同步进行。因此,瓶外基质内扦插更有利于硬齿猕猴桃的工厂化育苗及其产业化开发。
本实验发现,虽然硬齿猕猴桃在松针粉+珍珠岩上生根率较低,但是松针粉的成本较低,因此在一些松针较丰富的地方,可以选用松针粉+珍珠岩作为硬齿猕猴桃的生根基质。
本实验结果表明:在初代培养阶段,一定浓度的激素6-BA、ZT、IBA对硬齿猕猴桃的种子萌发无促进作用,不加激素的MS基本培养基是硬齿猕猴桃最佳的种子启动培养基; MS+0.5 mg/L 6-BA+0.2 mg/L IBA可作为硬齿猕猴桃较佳的茎段初代培养启动培养基;在继代培养阶段, MS+2.0 mg/L 6-BA+0.2 mg/L IBA较有利于硬齿猕猴桃的增殖;在生根阶段,1/2MS基本培养基是硬齿猕猴桃较佳的生根培养基;椰糠+珍珠岩(20∶1)是硬齿猕猴桃较好的培养瓶外生根基质。

