微压香氧预处理对MCAO大鼠Apaf-1表达的影响
陈 莎,曹珺菲,徐金勇,李光武
脑卒中严重危害人类的生命健康,具有极高的发病率、致残率和较高的复发率、致死率[1],这与人们的生活方式和临床治疗、康复效果不理想有很大关系。研究大脑中动脉阻塞(Middle cerebral artery occlusion,MCAO)模型,就是致力于寻找更为有效的方法,以减少脑卒中的危害。再灌注,即脑血流的恢复,这一过程中产生大量的氧自由基,使线粒体损伤,引起细胞大量凋亡,脑损伤进一步加剧,也就是所谓的“再灌注损伤”[2]。脑耗氧占人体总耗氧量的20%~30%,在发生缺血的同时也造成组织缺氧,组织的缺氧是引起细胞死亡的关键因素[3]。氧是帮助物质代谢的,它本身不是能量物质。因此提高脑组织供氧对缺血性脑卒中有治疗作用。高压氧预处理对卒中动物模型能产生明显的神经保护作用[4]。临床上已将高压氧疗作为缺血性脑血管病治疗的一种手段。但是,高压氧治疗有很多副作用,如气压伤、减压病、氧中毒等,以及高压氧舱有限的利用性和患者的依从性[5],使得高压氧用于治疗卒中受到了很多限制。
MHBO-AT是一个全新的康复手段,它把氧气疗法与芳香疗法结合在一起,从而形成临床新的干预疗法。其中,微压氧(Micro-Hyperbaric Oxygen,MHBO)现应用于缓解高原反应、康复治疗等领域,芳香疗法现应用于调节植物神经功能、营养神经等领域[6]。氧舱利用分子筛制氧,舱内增加1.3倍大气压,制氧浓度93%±3%,制氧流量3~5 L/min,实际吸入氧浓度约50%。它利用压力提供动力,利用氧气帮助提供能量,能增加血浆中的溶解氧含量,增加氧的弥散半径,从而增加组织供氧,清除ROS水平,维持缺血组织处线粒体的功能,减少缺血处组织的损伤[7]。芳香疗法是一种古老的自然疗法,通过吸入、沐浴或按摩将精油作用于人体,属于替代医学的一种[6]。精油是从芳香植物中蒸馏萃取出来的,是分子量很小的活性混合物,它含有多种化学成分,可以通过嗅觉产生药理作用,具有多靶点、高生物活性、高渗透性、高挥发性、人体相容性等生物学特性[8]。以前的研究表明,精油对神经系统有保护作用[9]。本实验通过将氧气疗法与芳香疗法联合应用,结合脑缺血再灌注损伤模型,采用TTC染色、免疫组织化学法、Western blot等,探讨MHBO-AT预处理对大鼠脑缺血再灌注损伤的干预作用及其可能的机制,为缺血性脑卒中的预防打下基础。
1 材料与方法
1.1 动物 清洁级健康雄性成年SD大鼠,85只,体重量220~250 g,鼠龄2~3 m,由安徽省实验动物中心提供。分笼喂养,适应环境3 d,自由饮水和进食,环境温度22~25 ℃,湿度50%,光暗周期12 h。
1.2 仪器和试剂 微压氧舱(上海氧知元医疗科技有限公司),YSJ-SD自动组织脱水机(常州中威电子仪器有限公司),YD-6L生物组织石蜡包埋机(金华市益迪医疗设备有限公司),RM-2135石蜡切片机(上海徕卡仪器有限公司),DM6 B正置智能显微镜(上海徕卡仪器有限公司),JY92-11D超声波细胞粉碎机(宁波新艺超声设备有限公司),Legend Micro 17R微量离心机(Thermo),DYY-7C电泳仪(北京市六一仪器厂),EPSON V600 Photo扫描仪(爱普生中国有限公司)等。迷迭香精油(安徽澳德瑞生物科技有限公司),兔多克隆抗体Apaf-1(Abcam),免疫组织化学检测试剂盒(北京中杉金桥生物技术有限公司),DAB显色试剂盒(北京中杉金桥生物技术有限公司),β-actin(proteintech),BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),TTC(2,3,5-氯化三苯基四氮唑)(Sigma)。
1.3 模型制备 采用改良的线栓法制作模型[10]:大鼠在术前禁食12 h,不禁水,取大鼠称重,用7%水合氯醛(0.5 ml/100 g)腹腔注射麻醉,钝性分离皮下组织,暴露右侧颈总动脉,分离出颈内动脉、颈外动脉,采用从颈总动脉向颈内动脉进线的方法,插入鱼线(线头端蘸硅胶)至大脑中动脉,缝合切口,消毒颈部皮肤,单笼放置。2 h再灌注,拔线栓,不要把鱼线全部拔出,以免出血。大鼠出现前爪内收和(或)眼睛horner征,则是模型成功的标志。假手术组,线栓只插入距颈总动脉分叉处6 mm处,不阻断大脑中动脉,其余同模型组。
1.4 实验分组及干预方法 将SD大鼠随机分为假手术组、模型组、微压香氧预处理组,假手术组15只,模型组和微压香氧预处理组每组35只,除假手术组外其余各组根据再灌注后时间点不同又分为6 h、12 h、24 h 3个亚组,6 h、12 h每组10只,24 h组15只。微压香氧预处理组术前14 d,每天进行一次MHBO-AT干预45 min。具体方法如下:把SD大鼠放入一长宽高约为50 cm的方形的实验桶内,实验桶放到氧舱里,用湿化瓶把精油和氧结合到一起,流量计控制氧的流速为3 L/min,湿化瓶里滴入精油6 滴/10 只大鼠,加蒸馏水至8 ml,使桶内的大鼠以吸嗅方式吸入香氧。模型组和假手术组不进行任何干预。
1.5 TTC染色 每组取5只大鼠用10%水合氯醛(0.4 ml/100 g)进行腹腔深度麻醉,开胸充分暴露心脏,在心尖部插入灌注针头,剪开右心耳,用生理盐水灌注至肝脏颜色发白。取脑,-20 ℃冰箱中速冻20 min,均匀切取脑片5片。将脑片置于TTC染色液中,放入37 ℃温箱15~30 min,观察脑组织颜色变化,正常脑组织呈红色,缺血组织呈苍白色。把脑片按脑解剖顺序重新排列,用扫描仪将正反面扫描后输入电脑,用Image J图像分析软件计算每片脑片梗死灶面积和脑片面积。梗死灶体积=[(各片正面梗死面积之和+各片反面梗死面积之和)/2]×每片厚度。同样方法计算出全脑体积。脑梗死体积百分比=(梗死灶体积/全脑体积)×100%。
1.6 免疫组织化学法检测梨形皮质Apaf-1蛋白表达 每组于再灌注后6 h、12 h、24 h随机取5只大鼠,动物用10%水合氯醛(0.4 ml/100 g)腹腔麻醉后,先用生理盐水灌注心脏,再用4%多聚甲醛灌注,迅速取脑,切取右侧大脑半球,经4%多聚甲醛固定24 h后,常规脱水、透明、浸蜡及石蜡包埋,连续脑组织冠状切片(3 μm)进行免疫组织化学染色,常规脱蜡至水,采用SP法检测Apaf-1表达,具体操作步骤按照常规操作进行。兔多克隆抗体Apaf-1按1∶60稀释,PBS代替一抗作为阴性对照,4 ℃过夜加二抗,新鲜配置的DAB液显色,苏木素复染,酒精梯度脱水、二甲苯透明,中性树胶封片,烘干,镜下观察结果,用Image J图像分析软件分析。
1.7 Western blot法检测梨形皮质Apaf-1蛋白含量 每组取5只SD大鼠,断头取脑后置于冰上迅速分离右侧梨形皮质,-80 ℃速冻保存。取出冰冻的脑梨形皮质称重50 mg,经裂解液裂解、冰冻离心机离心后提取总蛋白,根据其蛋白浓度(BCA法测定)配平使各样本蛋白等量,取30 μg蛋白样品,用6%分离胶分离,分离的蛋白采用半干转膜法转移至PVDF膜上,5%脱脂奶粉封闭60 min后,分别加入1∶1000兔多克隆抗体Apaf-1,4 ℃冰箱中孵育过夜。用TBST漂洗3次,每次10 min,加入二抗(1∶5000),室温缓慢摇动1~2 h,TBST漂洗3次,显影,显影液现配现用(A液∶B液=1∶1),放于显影仪成像并扫描,Image J软件进行灰度分析。以目的条带与内参条带灰度的比值表示待测蛋白含量。
2 结 果
2.1 TTC染色结果 大鼠脑缺血再灌注后都出现了不同程度的梗死灶,与模型组比较,微压香氧预处理组梗死体积明显缩小,差异有显著性(P<0.05)(见图1)。
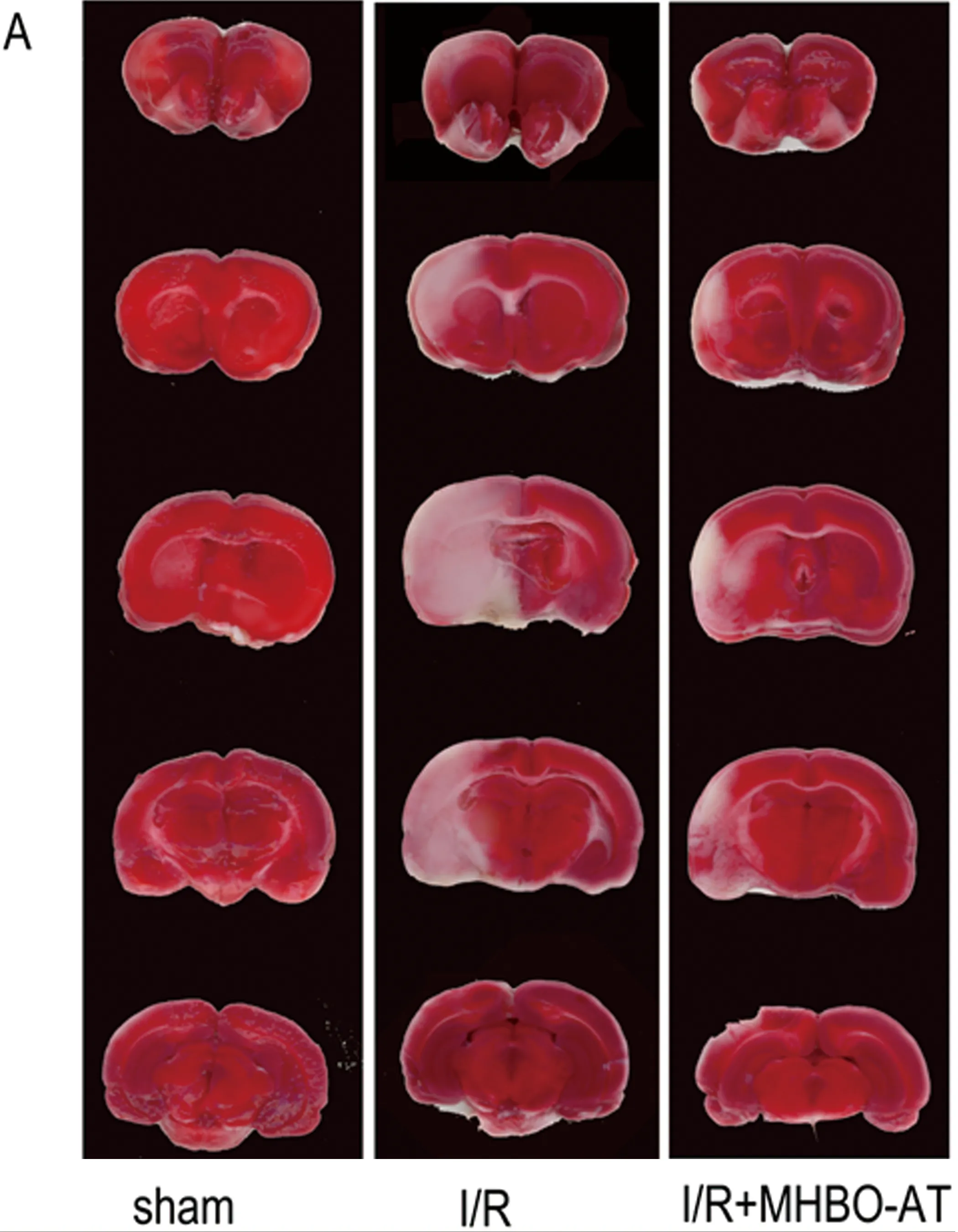
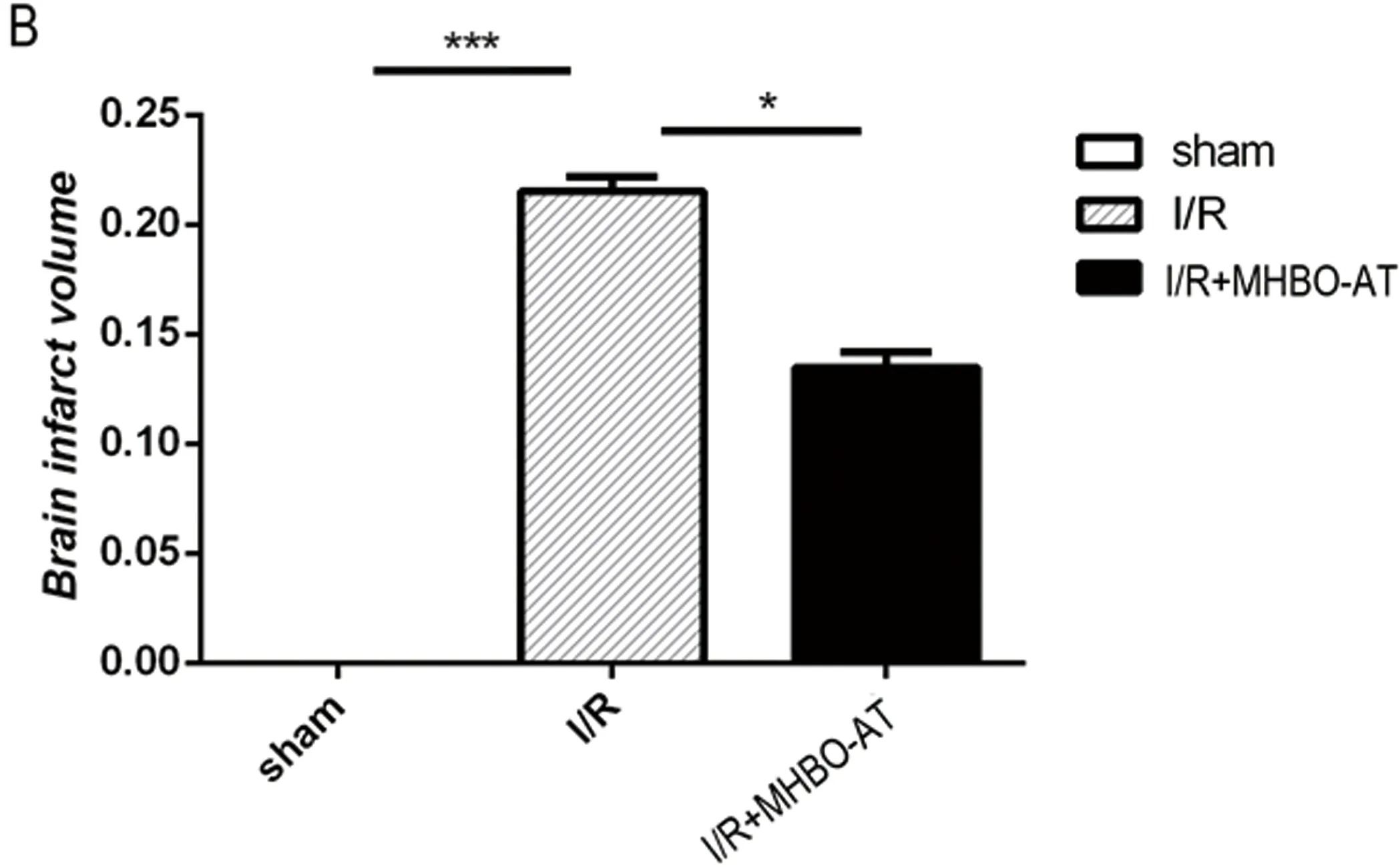
图1 TTC染色显示大鼠脑组织梗死灶大小。Sham:假手术组;I/R:模型组;I/R+MHBO-AT:微压香氧预处理组。1A:TTC染色图片。1B:各组脑梗死体积比(mean±SD,n=5),***P<0.01,*P<0.05 VS模型组
2.2 微压香氧预处理对脑缺血再灌注大鼠脑梨形皮质Apaf-1蛋白表达的影响 免疫组化结果显示,Apaf-1蛋白表达阳性反应为神经细胞胞浆呈棕黄色。假手术组大鼠脑梨形皮质神经细胞排列整齐,形态正常,有少量细胞胞浆黄染;模型组大鼠脑梨形皮质神经细胞排列不规整,细胞胞体缩小,有的核固缩,大量细胞胞浆黄染;微压香氧预处理组大鼠脑梨形皮质神经细胞形态较模型组有很大的改善,有轻微核固缩,神经细胞胞浆部分黄染。与假手术组相比,模型组各时点Apaf-1蛋白表达阳性细胞数均增高(P<0.01);与模型组相比,微压香氧预处理组各时点Apaf-1蛋白表达阳性细胞数均降低(P<0.05)(见图2)。
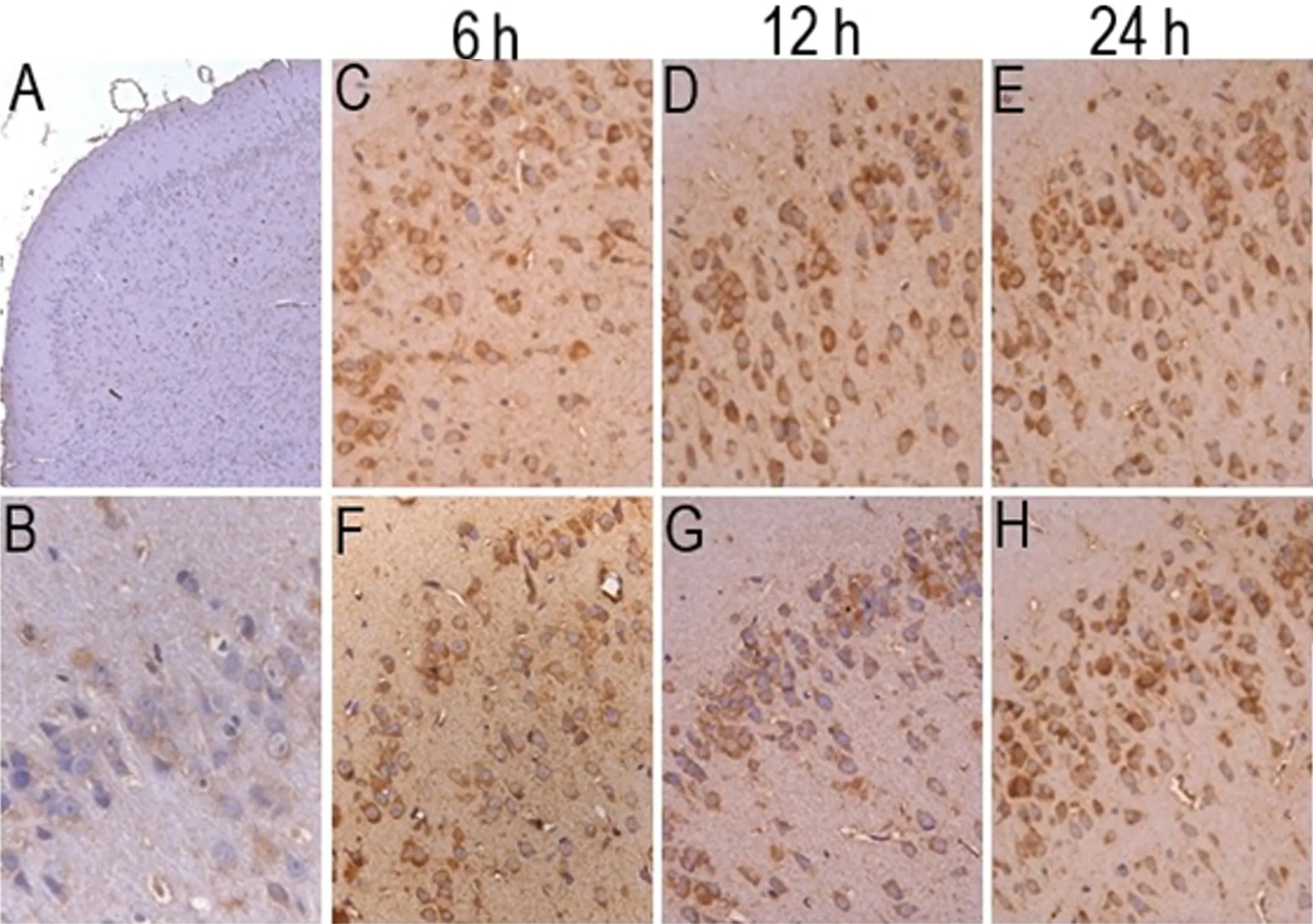

图2 免疫组化测定Apaf-1蛋白表达。A:假手术组(SP×50);B:假手术组(SP×400);C、D、E:模型组6 h、12 h、24 h(SP×400);F、G、H:微压香氧预处理组6 h、12 h、24 h(SP×400);I:各组Apaf-1蛋白阳性细胞数(mean±SD,n=5),Sham:假手术组;I/R:模型组;I/R+MHBO-AT:微压香氧预处理组。***P<0.01,*P<0.05 VS模型组
Western blot结果显示,模型组各时点Apaf-1蛋白平均灰度值均较假手术组增高(P<0.01);与模型组相比,微压香氧预处理组的各时点Apaf-1蛋白灰度值均明显降低(P<0.05)(见图3)。
3 讨 论
本实验中,第一次把氧气疗法与芳香疗法结合使用,证明了MHBO-AT预处理对大鼠脑缺血再灌注损伤能产生神经保护作用。图1TTC染色结果显示微压香氧预处理组中脑梗死体积明显缩小,缺血半暗区几乎没有梗死灶。图2、图3显示,Apaf-1蛋白表达水平从6 h~24 h依次增强,微压香氧预处理组中蛋白表达水平低于模型组。
大脑动脉血流阻断时,引起脑组织缺血及缺氧,缺血缺氧环境使蛋白质和脂质变性、线粒体功能障碍[3]。而再灌注过程中,线粒体因功能发生障碍,使电子传递链中氧分子供应不足,导致大量的ROS产生[11],ROS对细胞器和细胞造成损伤,最终导致细胞大量凋亡。过多的ROS又能引起线粒体损伤,使线粒体膜通透性发生改变[12]。线粒体作为细胞凋亡的中心环节,构成了凋亡的信号转导途径。脑缺血再灌注损失后,线粒体释放细胞色素C进入细胞浆后在ATP的协同作用下与凋亡酶激活因子1(Apoptotic protease-activating factor 1,Apaf-1)结合,以使其分子结构改变来激活caspase-9前体,形成凋亡体,并进一步激活其下游caspase-3等酶系列,启动caspase级联反应,最终导致细胞凋亡[13]。内源性Apaf-1是一种可溶蛋白,分子量130 kDa,具有颗粒状的胞质分布[14]。在细胞浆中与细胞色素C结合,参与线粒体凋亡途径,是凋亡体的核心。Apaf-1蛋白表达升高促进了神经元的凋亡,是脑缺血再灌注损伤的发生机制之一[15],这可能成为预防该类疾病新的分子靶点,为探索预防该类疾病的方法开辟了新的研究方向。
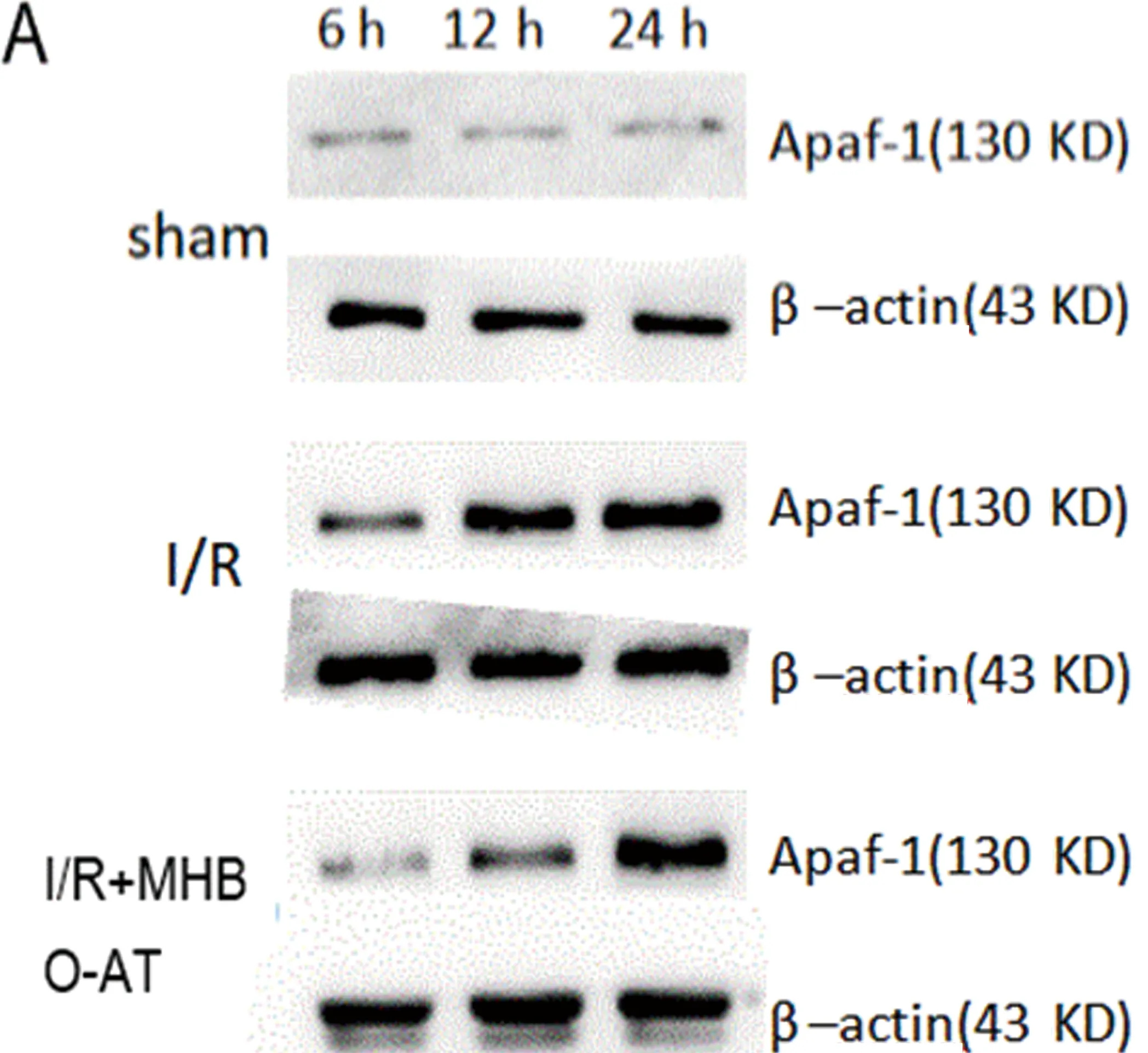
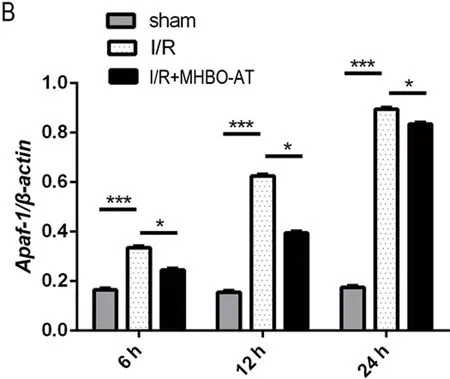
图3 Western blot测定Apaf-1蛋白表达(mean±SD,n=5),Sham:假手术组;I/R:模型组;I/R+MHBO-AT:微压香氧预处理组。A:各组6 h、12 h、24 h蛋白表达条带;B:各组6 h、12 h、24 h Apaf-1/β-actin蛋白表达相对灰度值。***P<0.01,*P<0.05 VS 模型组
众所周知氧与线粒体之间密不可分的联系,线粒体是产生能量的主要场所,而氧是帮助产生能量的。当线粒体功能障碍时,氧气疗法能帮助恢复线粒体功能而且不会增加ROS水平[16]。MHBO-AT利用压力把氧气输送到缺血水肿处的组织中、氧增加组织的弥散半径,使精油分子更好的通过嗅觉通路在中枢神经系统发挥作用。迷迭香精油是从迷迭香植物的叶、花、茎中提取的芳香开窍类物质,主要成分有迷迭香酸、迷迭香酚、黄酮、黄酮苷、蒎烯、桉叶素、樟脑等,可以刺激嗅觉,在大脑中减少脂质过氧化、抑制ROS生成[17]。李健等研究发现迷迭香吸入对脑卒中后抑郁样行为有明显的改善,可能与气味信号作用于情绪环路有关[18]。可见迷迭香精油在保护缺血性脑损伤中发挥重要作用。
嗅觉传导通路,精油分子作用起效快、生物利用度高,避免了胃肠道反应及首关消除。精油分子由嗅感觉细胞接受气味信息,产生动作电位传递到嗅神经,通过嗅球的整合以嗅束的方式投射到嗅皮质的前嗅核、嗅结节、梨形皮质及部分内嗅区皮质,再到次级皮质中枢,产生药理作用[19]。其中梨形皮质是哺乳动物处理嗅觉信息的主要部位,是处理嗅觉信息过程中到达的初级皮质,是感知气味至关重要的旧皮质。因此,观察大鼠脑梨形皮质中神经细胞蛋白的表达能够说明MHBO-AT是否对脑缺血再灌注损伤有保护作用。免疫组化和WB结果均说明微压香氧预处理组蛋白表达比模型组降低。由此可以得出,MHBO-AT预处理对大鼠脑缺血再灌注损伤产生神经保护作用,通过抑制脑梨形皮质中Apaf-1蛋白的表达可能是其作用机制,能预防脑卒中的发生。MHBO-AT在使用上强调一种时效关系,下一步将把研究重点放在MHBO-AT干预缺血再灌注损伤的最佳有效剂量上。

