非肿块样乳腺导管癌的临床特点
王 宁,陈 平,刘 军,黄林平
(中日友好医院 普通外科,北京 100029)
临床工作中有一部分乳癌患者,表现不典型,没有明确的肿块:可能只是乳腺疼痛;或者一片增厚变硬,没有明确的边界。超声下亦无明确的低回声影,只是腺体结构紊乱。如果加做钼靶检查,也许能见到腺体内大量砂砾样钙化。核磁共振检查偶见某些病变的非肿块样强化的描述,最后病理确定为乳腺癌。检索文献,临床上关于非肿块样乳癌的研究较少。本研究通过回顾性病例分析,旨在探讨非肿块样乳腺癌的临床特点,以指导今后的治疗。
1 资料与方法
1.1 临床资料
回顾性分析2012年~2017年间中日友好医院普通外科收治的228例女性共233处乳腺导管癌病例,其中5人双侧(同时或异时发现)。入组标准:(1)病理类型为乳腺导管癌,包括浸润性导管癌和导管原位癌;(2)病变的超声和钼靶资料齐全,经完整的手术治疗;(3)病理资料完整。排除标准:(1)曾行乳癌新辅助治疗;(2)导管癌内混合其他病理类型。
将病例分为2组:肿块组和非肿块组。肿块组:(1)体检可触及明确孤立肿块;(2)因肿物微小,体检不可触及,但是影像(超声和/或钼靶)发现孤立小肿块就诊者。非肿块组:(1)查体腺体片状增厚或未触及异常;(2)超声下无明显肿物影,但可见局部腺体结构紊乱、和/或片状导管扩张;(3)查体阴性,超声阴性,钼靶大片砂砾样钙化。
1.2 研究方法
比较2组患者的年龄分布、砂砾样钙化、含有导管内癌情况、核级别情况、ER(-)及Her-2()、脉管癌栓、腋窝淋巴结转移情况,并进行统计学分析。
1.3 统计学方法
应用SPSS15.0软件进行数据分析。组间比较采用t检验或u检验。
2 结果
肿块组患者年龄27~86岁,非肿块组年龄30~61岁。2组患者各项指标比较见表1。可见,非肿块样乳癌患者平均年龄显著低于肿块样乳癌患者(44.97±9.91/55.34±12.65),在原位癌成分(93.75%/31.34%)、微钙化(62.50%/37.81%)、高级别核(59.38%/36.82%)、脉管癌栓(31.25%/4.98%)比率上,非肿块样乳癌均显著高于肿块样乳癌(均Ρ<0.05)。在ER(-)(28.13%/26.87%)、Her-2()(31.25%/20.40%)、淋巴结转移(31.25%/40.80%)比率上,2组间无显著性差异(均Ρ>0.05)。
3 典型病例
非肿块样肿瘤发病年龄较轻,绝大部分含有导管内癌,砂砾样钙化多见。关于以上几个特性,有3个病例比较典型。
病例1:31岁女性,发现右侧乳腺片状增厚就诊,钼靶可见右乳大片砂砾样钙化,病理中低分化浸润性导管癌,大片导管内癌,脉管癌栓,ER(-),PR(-),Her-2()。腋窝淋巴结 21/23。2年后以左乳片状增厚就诊,钼靶见砂粒样钙化,病理:中级别浸润性导管癌,大部分高级别导管原位癌。ER(弱+),PR(-),Her-2()。腋窝淋巴结无转移(0/21)。钼靶资料未保留。

表1 非肿块样导管癌和肿块样导管癌临床特点比较
本例年轻女性,双侧乳腺相继发生非肿块样肿瘤,临床表现类似,钼靶类似,病理类似。
病例2:37岁女性,乳腺疼痛当地就诊,触诊(-),超声阴性,诊断为乳腺增生,服药无效。到上级医院就诊,钼靶片(图1,见封二)发现乳腺区段分布的砂砾样微钙化。病理:高级别导管原位癌,多灶浸润,脉管癌栓。ER(+),PR(+),Her-2(+)。腋窝淋巴结(10/31)。
病例3:例2患者妹妹,35岁,来医院看护姐姐期间检查乳腺。查体局部偏硬,无肿物感,超声发现两三个<1cm的低回声影,钼靶片(图2,见封二)可见沿导管分布的砂砾样钙化。病理:浸润性导管癌,大量高级别导管内癌。ER(+),PR(+),Her-2()。腋窝淋巴结(0/21)。
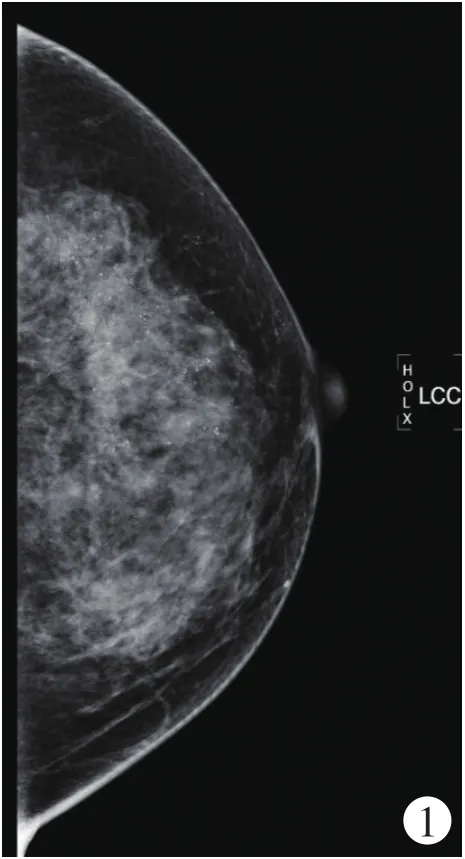
图1 可见区段分布微钙化。
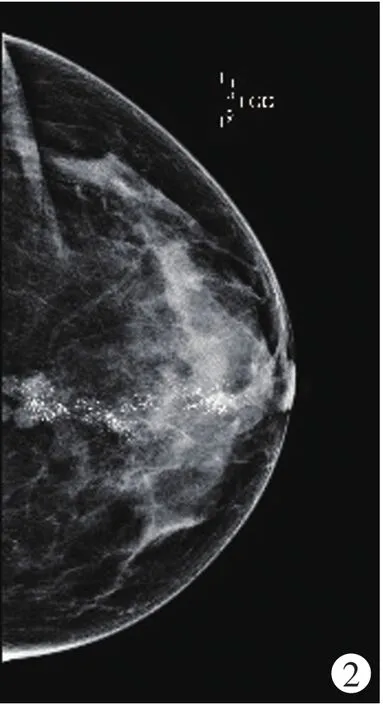
图2 可见沿导管分布微钙化。
病例2和病例3是一对姐妹,青年发病,非肿块样肿瘤,临床表现类似,钼靶类似,病理类似。
非肿块样肿瘤高级别核比例较高,ER阴性率和Her-2过表达率高于肿块型肿瘤,但本研究这三项上两者差异无统计学意义。
虽然非肿块样肿瘤多含有大量导管内癌成分,却有较高的概率合并脉管癌栓,远超肿块样乳癌。然而淋巴结转移率却没有相应升高。
4 讨论
非肿块样乳癌有很多特性,检索文献中却发现,这些特性很少和非肿块样肿瘤直接连接,而是各种特征之间直接或间接地互相关联。
4.1 关于年轻患者和导管内癌
Kitchen PR提出具有广泛导管内癌成分的乳癌患者年龄较轻[1]。反之亦有人说,年轻患者的乳癌更容易有导管内癌成分[2]。而非肿块样肿瘤绝大部分都是导管内癌,年龄轻,正与以上2种说法印证。
Cronin[3]进行一项Meta分析,统计了2996例行保乳手术的乳腺导管内原位癌(ductal carcinoma in situ,DCIS)病例,复发风险随年龄升高而降低。年龄<40岁的女性10年浸润癌复发率16%,>40岁复发率6.5%。21%的<40岁的女性发现远处转移。保乳复发说明肿瘤切除不净,非肿块样分布的肿瘤由于范围广,手感不明显,边界不易确定,极易切除不净。
我们的患者中,非肿块样乳癌多见于年轻女性,多含有大量导管内癌或者全部为导管内癌成分,多脉管癌栓。
大量导管内癌成分表现为癌灶片状蔓延,是癌灶非肿物样发病的原因。
4.2 关于导管内癌
临床上有时见到几毫米的结节,是浸润性导管癌。比如Bae MS曾报道超声检出的小体积乳腺癌多为病变局限的浸润性癌[4]。有时乳腺腺体大片癌变,却是导管原位癌。说明有些导管内癌会很快浸润成为肿块,有些却趋向于长期像树枝一样沿导管蔓延,范围广大,形成非肿块样病变。
Shusma[5]研究弥漫性单纯性导管内癌和伴有浸润性癌的导管内癌,发现二者某些和细胞的粘附、转移和肌上皮的侵袭有关的基因表达有所不同。那些单纯性导管内癌因此不易浸润,局限在导管内生长。这或许可以解释导管内癌浸润趋向不同的原因。不易浸润的容易形成广泛分布的非肿块样乳癌。
但是即便在弥漫分布的非肿块样的乳腺中,仍有一部分是单纯原位癌,一部分是导管内癌伴浸润甚至有脉管癌栓。如果导管内癌向浸润癌发展是基因累积介导的结果[6],那么在单纯的导管内癌和合并浸润癌的导管内癌之间,是存在基因的进一步差异还是只是发病早晚的问题,值得进一步探讨。
4.3 关于砂砾样钙化
Lee MH[7]发现钼靶可见钙化的导管内癌79%可以被超声检测到,而钼靶无钙化的导管内癌97%可被超声检测到。能被超声检测到说明是肿块性病变,不能检测到的符合本文定义的非肿块样肿瘤。这从另一个角度告诉大家:非肿块样肿瘤的导管内癌容易出现钙化,肿块性肿瘤的导管内癌钙化率较低。所以,钼靶引进后,导管内癌的检出率升高,一部分原因就是非肿块样隐匿的导管内癌的检出率提高。
这种非肿块样乳癌多合并砂砾样微钙化。临床上,砂砾样钙化也多提示导管内癌。可是浸润性癌都是由导管内癌发展而来的,为什么浸润癌会比导管内癌钙化少?通过非肿块样肿瘤和肿块样肿瘤的对比,笔者发现,非肿块样肿瘤内多导管原位癌,多出现导管内钙化,肿块样肿瘤导管内癌少,钙化少。不仅支持以上说法,同时提示大家:容易合并钙化的是长期在导管内蔓延的肿瘤。短暂的原位阶段后即进展为浸润性肿块的导管癌钙化少。
4.4 关于高级别核
据统计,针尖状线样或分支样钙化[8]、树枝样或区段分布的微钙化多和高级别导管内癌相关,不定型钙化和低级别导管内癌相关[9,10],低级别导管内癌又和肿块样肿瘤相关[9~11]。反之,Bae 等[4]也发现超声能检出的乳癌(肿块型肿瘤),低级别核较多,提示了肿块状肿瘤某些方面的惰性。而非肿块样肿瘤以高级别核多见,意味着恶性程度高。
4.5 关于ER、PR、Her-2
关于ER、PR、Her-2的生物学指标,文献报道:超声检出的乳癌ER、PR阳性多见,钼靶检出的乳癌Her-2阳性多见;砂砾样钙化的乳癌ER阴性、Her-2过表达者多见;年轻患者Her-2过表达者多见[4]。笔者观察的非肿块样乳癌多含砂砾样钙化、多见年轻患者,但ER阴性和Her-2过表达概率虽高,尚没有统计学意义。随着标本量扩大,不知可否得出阳性结论。
4.6 关于脉管癌栓
虽然导管内癌成分多,我们的数据却显示非肿块样乳癌,容易伴有脉管癌栓。脉管癌栓提示将来复发转移的高危。
非肿块样肿瘤长期沿导管内蔓延,难以及时发现,会给浸润和脉管癌栓形成以充足的时间。肿瘤能够沿导管长期蔓延,说明浸透导管基底膜的能力较弱,但是一旦浸透,侵犯血管,播散能力却很强。这或许可以解释非肿块样肿瘤内脉管癌栓发生率高的现象,如典型病例2。
4.7 关于淋巴结转移
为什么非肿块样肿瘤脉管癌栓发生率高,淋巴结转移率却不高?结合Cronin[3]的Meta分析,年轻女性的DCIS远处转移高于40岁以上女性。而远处转移多由血行转移导致。结合非肿块样肿瘤多DCIS多年轻女性,我们有理由相信:脉管癌栓和淋巴结转移发生率的不平行,也许提示非肿块样肿瘤容易血行转移,肿块型肿瘤容易淋巴转移。需要长期随访。
Narod[12]认为导管内癌分不同的亚型,其中约20%的导管内癌包含一些高风险因素(年轻,黑人,ER、PR阴性,Her-2阳性,高级别核,体积>5cm),预后差,死亡率高。这些风险因素,除了种族,和笔者总结的非肿块样乳癌的性质多有吻合。随着导管内癌的检出率升高,关于治疗的争议也随之增多[13]。在保证切缘阴性的前提下,能保乳的多可以保乳[14]。当然,能够保乳的,必然是肿块状肿瘤,这样才能够判断肿瘤边缘。
而笔者所见的非肿块样乳癌,虽然多含导管内癌成分,但多发年轻患者,发病隐袭,弥漫性,范围广,易伴癌栓,似可进一步细分为一类特殊类型的乳癌,并得到和浸润性癌一样积极的治疗。也可将其进一步分为单纯导管内癌无转移,和有浸润有转移者进一步研究,找到二者差别的原因。
临床上片状分布的非肿块样乳腺癌具有某些共同特征:年轻发病,长期沿导管内蔓延,分泌性钙化,触诊和超声表现不典型,容易漏诊误诊,容易形成脉管癌栓,提示预后可能较差。

