肾门水平下腔静脉渐进性梗阻犬动物模型的建立
陈昌裕 黄庆波 李秋洋 彭程 杜松良 巫胜攀 沈东来 顾良友 牛少曦 喻垚王海屹 刘凤永 张旭 王保军 马鑫
肾癌伴静脉瘤栓形成占肾癌的4%~10%[1],常见的侵犯部位为肾静脉和下腔静脉。肾癌伴下腔静脉瘤栓可造成肾门水平的下腔静脉渐进性梗阻,主要引起双侧下肢静脉、盆腔静脉及性腺静脉回流受阻,临床上可出现下肢和会阴部坠胀、疼痛及水肿等,其严重程度和侧支静脉建立程度有关[2-3]。肾癌致下腔静脉渐进性梗阻后侧支循环的建立规律、血流动力学的改变及相关机制对于制定肾癌伴下腔静脉瘤栓手术策略及肾功能保护,具有重要的临床意义[4-6]。因此有必要建立稳定的肾门水平下腔静脉渐进性梗阻的动物模型,以模拟人体肾癌致下腔静脉梗阻形成的病理生理过程,为研究肾癌致下腔静脉梗阻的发病机制、病程进展及干预措施奠定基础。国内尚无类似实验研究,我们引进了Ameroid缩窄环(ameroid constrictor),利用 Ameroid缩窄环内层酪蛋白缓慢吸水膨胀使下腔静脉逐渐狭窄的特点[7],成功建立了肾门水平下腔静脉渐进性梗阻动物模型,现报告如下。
1 材料与方法
1.1 实验动物
健康成年雄性比格犬2只,体重分别为15.1 kg、14.4 kg,由中国人民解放军总医院实验动物中心提供。经普通饲料喂养,自由饮水。
1.2 动物模型制作方法
1.2.1 实验仪器 Ameroid缩窄环(Ameroid Constrictor,Research instrument RW,USA),内径为6.0 mm和7.5 mm两个规格;Philips iU22型彩色多普勒超声诊断仪,凸阵探头,频率3~5 MHz;德国Siemens SOMATOM Definition CT机。
1.2.2 造模方法与过程 ①对实验犬初始静脉注射3%戊巴比妥钠30 mg/kg,麻醉成功后,将犬仰卧固定于手术台,犬头偏向一侧。犬一侧上肢建立静脉通路,以1~2滴/s持续滴注生理盐水。实验过程中根据动物麻醉程度,适时静脉推注3%戊巴比妥钠1~2 mL。②用超声观察肾脏大小、质地,并测量下腔静脉的直径、血流速度。③手术野皮肤常规消毒铺巾,取上腹正中切口,长约20 cm,进腹后暴露、游离肾静脉和下腔静脉(图1)。将Ameroid缩窄环置于实验犬的下腔静脉的肾门水平,距离下腔静脉的左肾静脉入口上方约2 cm(图2),使下腔静脉初始截面积至少减少50%。④关腹前检查腹腔内有无活动性出血、胃肠颜色及蠕动,情况良好后再逐层关闭腹腔,术后给予肌内注射青霉素320万U×3 d,以预防腹腔及切口感染。
1.3 动物模型检测方法
1.3.1 一般情况观察 分别于术后每周观察实验犬的腹壁静脉曲张情况和体重变化。
1.3.2 超声检查 术后每周均在麻醉下超声观察肾脏大小、质地,置入的Ameroid缩窄环的位置,并测量下腔静脉的直径和血流速度。
1.3.3 CT检查 术后第6周,将实验犬麻醉后行多排螺旋CT检查。
1.3.4 下腔静脉造影检查 术后第6周,对实验犬静脉注射3%戊巴比妥钠30 mg/kg,麻醉成功后,将犬仰卧固定于操作台,犬一侧上肢建立静脉通路,右腹股沟区备皮消毒,铺无菌巾,采用改良Seldinger技术穿刺右侧股静脉并置入F4导管鞘,经导管鞘置入猪尾导管行下腔静脉造影(一次快速推入碘海醇20 mL左右),待造影结束后撤出导管鞘,按压穿刺点5 min。

图1 术中显露下腔静脉和双侧肾静脉
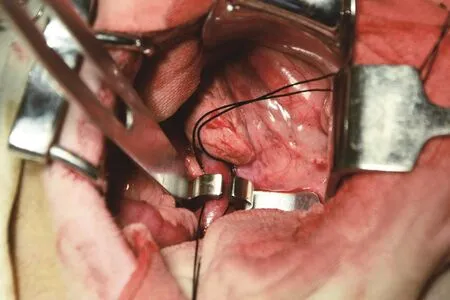
图2 术中放置Ameroid缩窄环
2 结果
2.1 腹壁静脉曲张情况
2只实验犬术前均无腹壁浅静脉曲张,术后均出现了腹壁浅静脉曲张(图3)。术后第2周,肉眼即可观察到曲张的腹壁浅静脉,随访过程中,腹壁曲张静脉逐渐变粗增多,数量达4~6条,呈树枝状或网格状,少数迂曲成团,直径最粗可达6 mm。术后4周后腹壁曲张静脉未再明显变粗增多。
2.2 超声检查结果
超声显示实验犬术前及术后 1、2、3、4、5、6、7周平均下腔静脉直径分别为:1.10、1.15、1.28、1.35、1.41、1.38、1.30、1.26 cm,说明术后下腔静脉管径先逐渐增粗,再缩小,最终仍大于术前的管径,另外下腔静脉测速图显示血流速度明显减慢(图4,图5)。

图3 实验犬腹壁浅静脉曲张(术后第4周)

图4 术前犬下腔静脉纵切面超声检查

图5 术后第4周犬下腔静脉纵切面超声检查
2.3 CT检查结果
CT检查结果显示,Ameroid缩窄环仍位于原放置部位,无滑脱移位(图6)。腹腔未见明显积液,下腔静脉管径较粗,肾脏有淤血性改变,肠道无明显水肿(图7)。
2.4 下腔静脉造影检查
术后第6周,2只比格犬均进行了下腔静脉造影检查。用高压注射器注入造影剂后,造影显示下腔静脉主干均完全闭塞,回流速度明显减慢,血液主要经增粗的腰静脉、奇静脉、半静脉、膈下静脉回流至右心房,右侧的回流侧支较左侧多且粗(图8,图9)。
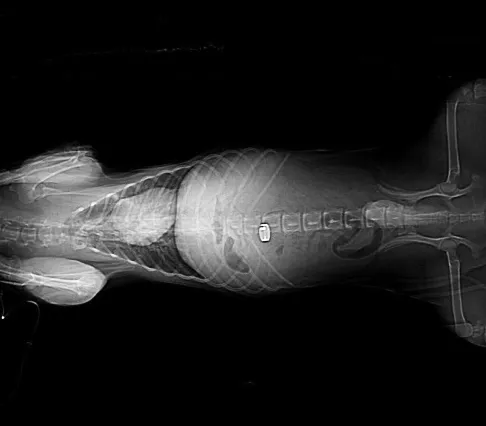
图6 比格犬术后第6周正位片

图7 比格犬术后第6周腹部CT图像
2.5 手术安全性评价
2只比格犬术后均正常存活,精神状态良好,与术前相比,比格犬1术后体重轻度下降,比格犬2术后体重无明显改变(图10),均未出现感染、腹水、肾功能不全等并发症。

图8 比格犬1术后第6周下腔静脉造影图

图9 比格犬2术后第6周下腔静脉造影图
3 讨论
本研究首次将Ameroid缩窄环应用于犬的下腔静脉,以引起肾门水平下腔静脉渐进性的梗阻,从而模拟肾癌致肾门水平下腔静脉渐进性梗阻的病理生理过程。在研究中,比格犬术后第2周开始均出现了明显的腹壁浅静脉曲张,这与Ameroid缩窄环缩窄的速度先快后慢的特点[8]相符合,术后前2周下腔静脉狭窄速度较快,造成置环处以下下腔静脉回流受阻明显,出现腹壁浅静脉曲张的表现。之后Ameroid缩窄环继续收缩,造成下腔静脉梗阻程度进一步加重,使下腔静脉的侧支相应增粗,建立和开放侧支循环来适应下腔静脉回流受阻的状态。但此时下腔静脉和其回流支的向心回流阻力仍很高,因此术后4周时腹壁浅静脉曲张情况仍较重,之后腹壁曲张静脉直径和数量无明显增加,可能与开始形成较广泛的侧支循环有关。造模手术后,术后超声的检查结果显示下腔静脉的管径在术后前4周进行性增粗、流速减慢,说明该造模方法效果明显,能成功模拟肾门水平下腔静脉渐进性梗阻的过程。而术后4周后下腔静脉不再增粗,反而有所缩小,可能与术后4周时已形成较多侧支循环有关。术后第6周的CT检查结果表明该方法具有置入物位置固定,不易滑脱的优点,肾脏淤血性改变和较粗的下腔静脉表明肾门水平下腔静脉存在梗阻。术后第6周的下腔静脉造影检查更加直观地证明该方法能成功造成肾门水平下腔静脉梗阻,并且有广泛的侧支循环形成。
Ameroid缩窄环分为内外两层,内层由酪蛋白材料组成,外层为不锈钢环。一旦缩窄环套置在血管上,酪蛋白材料即吸收周围的液体,使内腔逐渐变窄,模拟血管的缓慢狭窄,最终导致血管完全闭塞[7]。Ameroid缩窄环已被广泛用于建立慢性心肌缺血、慢性心梗、门静脉高压等疾病的动物模型[9-11]以及动物先天性肝外门体分流术的治疗[12]等。采用Ameroid缩窄环构建肾门水平下腔静脉渐进性梗阻动物模型有以下优点:①缩窄环内层的吸水材料可在4~5周时间内缓慢收缩,从而真实地模拟下腔静脉瘤栓逐渐阻塞下腔静脉的渐进性过程,同时也可避免一次性完全阻塞下腔静脉造成实验动物的高死亡率。②本方法只需通过一次开腹手术置入Ameroid缩窄环即可完成造模,操作简单,无需介入操作,技术门槛低。③造模周期短,只需4~6周即可。④本实验中没有动物在术后死亡,也没有在术后出现感染、腹水及肾功能不全等并发症,说明这种造模方法安全性好,造模成功率高。
不过本研究也存在不足之处:在建立模型过程中并没有考虑肾癌细胞对下腔静脉的影响;样本量少。后续研究中可以将肾癌细胞的影响纳入动物模型的建立过程,从而更加真实、全面地模拟肾癌致肾门水平下腔静脉渐进性梗阻的过程。本模型的效果仍需更多样本的随机对照研究进一步验证。
总之,本研究采用Ameroid缩窄环成功建立的肾门水平下腔静脉渐进性梗阻的比格犬模型,不仅有助于研究肾癌致下腔静脉梗阻的发病机制和病程进展,还可用于对下腔静脉梗阻相关干预措施的疗效进行实验评价。此外,还可以为腹部肿瘤直接侵犯包裹或腹腔淋巴结转移压迫造成肝段以下下腔静脉狭窄或梗阻的研究提供研究基础,值得在相关动物实验中进一步推广和应用。

