超高效液相色谱法测定啶酰菌胺和咯菌腈在番茄与土壤中的残留
冯玉洁 潘飞 谢圣华 梁延坡 冯青

摘 要 应用超高效液相色谱仪建立一种同时检测番茄和土壤中啶酰菌胺和咯菌腈残留的分析方法。样品经乙腈提取,乙二胺-N-丙基硅烷(PSA)吸附净化,以乙腈和水为流动相等度洗脱,采用可变波长紫外检测器检测,外标法定量分析。结果表明,啶酰菌胺和咯菌腈在0.05~1 μg/mL范围内呈现良好的线性关系,相关系数R2均为0.999,方法的检出限均为0.01 mg/kg,定量限为0.1 mg/kg;在0.1~1 mg/kg范围内,添加回收率在82.8%~102.8%和86.5%~115.3%之间,相对标准偏差(RSD)在4.1%~8.7%和4.9%~9.1%之间。该方法简单可靠、重现性好,适用于番茄和土壤中啶酰菌胺和咯菌腈的残留检测。
关键词 番茄;土壤;啶酰菌胺;咯菌腈;超高效液相色谱;残留
中图分类号 S481.8 文献标识码 A
啶酰菌胺是一种新型烟酰胺类内吸性杀菌剂,属呼吸作用抑制剂,对灰葡萄孢分子孢子萌发和真菌菌丝生长均有较强的抑制作用,对番茄灰霉病和菌核病、白粉病等具有较好的防治效果[1]。咯菌腈是苯基吡咯类非内吸性杀菌剂,为酶抑制剂,通过抑制分裂蛋白活化激酶/组氨酸激酶活性,影响分生孢子萌发、细菌芽管伸长及菌丝生长等,对番茄灰霉病有良好的防治效果,且不易与腐霉利、多菌灵等杀菌剂间存在交互抗药性[2-3]。啶酰菌胺和咯菌腈目前正广泛应用于防治蔬菜、水果的灰霉病、茎腐病和菌核病,随着其大量使用所引发的农药残留问题不容忽视。
目前,啶酰菌胺的定性定量检测方法主要有气相色谱法、气相色谱-质谱法、液相色谱法及液相色谱-质谱法。2011年,张玉婷等[4]采用气相色谱仪-电子捕获检测器(GC-ECD)分析了葡萄和土壤中啶酰菌胺的残留动态;2015年,杨莉莉等[5]采用气质联用仪(GC-MS)研究了啶酰菌胺在草莓和土壤中的残留量及消解动态,方法的定量限(LOQ)分别为0.05和0.1 mg/kg;2012年,郑尊涛等[6]采用GC-MS法研究啶酰菌胺在草莓和土壤中的残留量及消解动态,所采用的方法最低检出限(LOD)为0.3 ng/kg,在番茄和土壤中的定量限为0.01 mg/kg;汤永娇等[7]采用超高效液相色谱法(HPLC)分析了芒果中啶酰菌胺的残留,方法检出限为0.002 mg/kg;2012年郭庆龙等[8]采用液质联用仪(LC-MS/MS)分析了蔬果中啶酰菌胺的残留,方法检出限和定量限分别为0.295 μg/kg和1.32 μg/kg。咯菌腈主要使用HPLC法和GC法进行分析。2012年占绣萍等[9]采用HPLC测定蔬菜中咯菌腈等农药的残留量,仪器最小检出量为1 ng,最低检测浓度为0.1 mg/kg;2015年张文[10]采用气相色谱仪-氮磷检测器(GC-NPD)检测了咯菌腈在葡萄和土壤中的残留量及消解动态,方法最低检出量为0.13 ng,在葡萄和土壤中的最低检出质量浓度均为0.1 mg/kg。
但目前关于同时测定啶酰菌胺和咯菌腈在番茄及土壤中残留的方法尚未见报道。本研究利用分散固相萃取净化结合超高效液相色谱(UPLC),建立了番茄与土壤中啶酰菌胺和咯菌腈的快速检测方法,可用于番茄和土壤中啶酰菌胺和咯菌腈的残留检测。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 番茄对照样品采自海南省农业科学院澄迈永发基地,生长过程未使用任何农药,检测实际番茄样品购自海口当地农贸市场,切块制成糜样于18 ℃冰箱中冷冻保存,备用。
啶酰菌胺标准品(99.0%)、咯菌腈标准品(99.0%),德国Dr. Ehrenstorfer公司;乙腈(色谱纯),美国Thermo Fisher公司;乙二胺-N-丙基硅烷(PSA)、C18吸附剂,美国Varian公司;无水硫酸镁(农残级)、氯化钠,国药集团。无水硫酸镁使用前于400 ℃烘干备用。
1.1.2 仪器与设备 Agilent 1290超高效液相色谱仪,美国Agilent公司;高速冷冻离心机,美国Thermo公司;涡旋混匀器,海门市其林贝尔仪器有限公司;Milli-Q超纯水仪,德国Millipore公司;0.22 μm微孔滤膜,上海安谱科学仪器有限公司;AUY220型电子分析天平,日本岛津公司。
1.2 方法
1.2.1 标准溶液配制 称取适量啶酰菌胺和咯菌腈标准品用乙腈溶解配置成1000 μg/mL母液,移取适量母液至容量瓶,用乙腈稀释成质量浓度分别为0.05、0.1、0.2、0.5、1 μg/mL系列混合标准溶液,混匀后放入4 ℃冰箱保存备用。
1.2.2 前处理方法 称取番茄和土壤样品各10.0 g(精确至0.01 g),分别置于50.0 mL离心管中,加入20.0 mL乙腈和5.0 g氯化钠,剧烈震荡2.0 min,加入6.0 g无水硫酸镁,经涡旋混匀器提取2.0 min后,4000 r/min离心5.0 min,准确吸取上清液5.0 mL到装有200 mg PSA、500 mg无水硫酸镁的离心管中,涡旋2.0 min后,5000 r/min离心3.0 min,取上清液过0.22 μm微孔滤膜,进UPLC分析。
1.2.3 色谱条件 色谱柱为ZORBAX Eclipse Plus C18色谱柱(2.1 mm×50 mm,1.8 μm),柱温35 ℃,流动相为乙腈∶水=50∶50(V/V),流速0.20 mL/min,可变波长紫外检测器,检测波长260 nm,进样量2.0 μL。
2 結果与分析
2.1 检测波长的确定和标准曲线
通过紫外光谱检测,啶酰菌胺和咯菌腈的最大吸收波长分别是205 nm和268 nm,但考虑到低波段对目标峰有干扰和两种农药吸收波长的选择,选择260 nm为实际检测波长。
在质量浓度为0.05~1 μg/mL范围内,以峰面积(y)为纵坐标,进样浓度(x)为横坐标,绘制标准曲线,外标法定量。2种农药的质量浓度和峰面积间呈线性关系,啶酰菌胺和咯菌腈的保留时间分别为2.977、3.675 min,2种农药的UPLC谱图见图1。以3倍信噪比作为方法检出限(LOD),以最小添加浓度作为方法的定量限(LOQ),结果见表1。
2.2 样品前处理条件的优化
通过比较2种组合(组合1:PSA 200 mg;组合2:PSA 200 mg与C18 25 mg)净化效果,结果表明,PSA可有效去除番茄中有机酸、色素和
糖类等杂质,净化效果良好,且对检测无干扰,添加C18后对净化效果没有太大改善,故本研究采用PSA作为净化剂进行分散固相萃取。在加标浓度为0.5 mg/kg的5 mL乙腈提取液中分别加入0.05、0.10、0.15、0.20、0.30 g 的PSA,考察PSA用量对净化效果的影响。结果表明,加入0.2g PSA时,溶液无色透明,净化效果良好,对目标物测定无干扰,回收率为94.2%,符合农药残留检测要求。
2.3 回收率、精密度与检出限
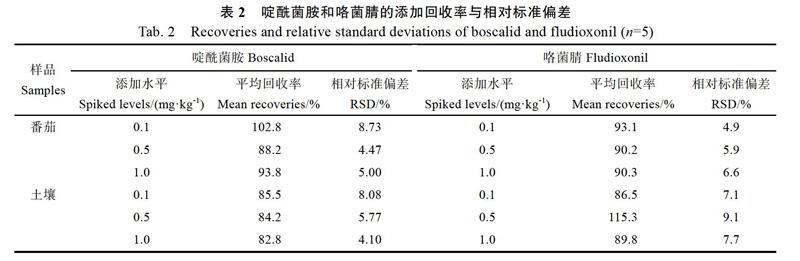
在空白的番茄和土壤样品中分别按照0.1、0.5、1 mg/kg 3个水平添加啶酰菌胺和咯菌腈,每个添加水平重复5次。添加回收实验结果表明,在0.1~1 mg/L 3个添加水平下,番茄中,啶酰菌胺平均回收率在88.2%~102.8%,相对标准偏差(RSD)为4.5%~8.7%;咯菌腈平均回收率在90.2%~93.1%,RSD为4.9%~6.6%(表2)。土壤中,啶酰菌胺平均回收率在82.8%~85.5%,RSD为4.1%~8.1%;咯菌腈平均回收率在86.5%~ 115.3%,RSD为7.1%~9.1%。番茄和土壤中啶酰菌胺的定量限(LOQ)均为0.1 mg/kg,咯菌腈的LOQ均为0.1 mg/kg。
2.4 实际样品的检测
本研究随机抽取了市售7份番茄样品和5份土壤样品进行检测,啶酰菌胺和咯菌腈残留量均低于检出限。
3 讨论
基于安全考虑,很多国家均规定了啶酰菌胺和咯菌腈在各类食品中最高残留限量,国际食品法典委员会(Codex Alimentarius Commission,CAC)、欧盟(European Union,EU)和日本限量值在0.02~40 mg/kg和0.01~50 mg/kg之间[11-13],日本规定了啶酰菌胺和咯菌腈在番茄上MRL值分别为5 mg/kg和2 mg/kg,CAC规定了咯菌腈在番茄上的最大残留限量值(MRL)为0.5 mg/kg。我国于2016年12月发布的新版《国家食品安全标准 食品中农药最大残留限量》[14](GB 2763-2016)中规定了啶酰菌胺在苹果、黄瓜、甜瓜、草莓、葡萄等食品中5项残留限量,限量值为2~5 mg/kg;咯菌腈在棉籽的残留限量值,限量值为0.05 mg/kg,二者在番茄中的残留限量仍在制定中。现行的检测食品中啶酰菌胺和咯菌腈的国家标准只有3个,即GB 23200.68-2016[15]、GB/T 20769-2008[16] 和GB 23200.8-2016[17],而国标GB 23200.68-2016、GB/T 20769-2008仅制定了食品中啶酰菌胺的检测方法且定量限均为0.01 mg/kg,国标GB 23200.8-2016中制定了水果和蔬菜中咯菌腈的检测方法其定量限为0.06 mg/kg,但不能同时检测啶酰菌胺含量。国标GB 23200.68-2016采用液/液分配和固相萃取(SPE)两次净化,GB/T 20769-2008和GB 23200.8-2016采用SPE净化,并用大量溶剂洗脱,每个样品净化时间达到30~40 min,消耗相当长时间和大量溶剂,并对检测人员健康造成潜在危害。
超高效液相色谱法(UPLC)的技术核心是在非常高的压力下(其柱压最高可达到18 000 psi),通过降低固定相的粒度,提高流动相线速度的方法,对复杂样品进行高效、快速地分离和分析,其分离度、灵敏度和分析速度相比传统的高效液相色谱(HPLC)分别提高了1.7倍、3倍和9倍[18]。传统HPLC在进行多组分分析时,需消耗相当长时间和大量溶剂,而利用UPLC技術可以在很大程度上缩短分析时间,提高效率,并减少溶剂的使用量,降低分析成本。
本研究通过优化QuEChERS前处理方法的分散固相萃取技术,建立了番茄和土壤中啶酰菌胺和咯菌腈残留的超高效液相色谱检测方法。优化实验表明以PSA为吸附剂对番茄和土壤样品提取液进行净化效果最好。添加回收试验的平均回收率在82.8%~115.3%之间,RSD小于9.1%。该方法对啶酰菌胺和咯菌腈的检出限均为0.01 mg/kg。本方法具有操作简单、节省溶剂用量、分析速度快等特点,能够满足番茄和土壤中啶酰菌胺和咯菌腈的残留分析的要求。
参考文献
刘长令. 世界农药大全: 杀菌剂卷[M]. 北京: 化学工业出版社, 2006: 237.
纪军建, 张小风, 韩秀英, 等. 8种杀菌剂对番茄灰霉病菌的毒力及田间番茄灰霉病菌对咯菌腈的敏感性[J]. 植物保护, 2012, 38(6): 144-146.
王 智, 朱 赫, 祁之秋, 等. 辽宁省不同地区番茄灰霉病菌对咯菌腈的敏感性[J]. 植物保护, 2016, 42(5): 214-216.
张玉婷, 郭永泽, 刘 磊, 等. 啶酰菌胺在葡萄及土壤中的残留动态[J]. 农药, 2011, 50(1): 51-52.
杨莉莉, 金 芬, 杜欣蔚, 等. 啶酰菌胺在草莓和土壤中的残留及消解动态[J]. 农药学学报, 2015, 17(4): 455-461.
郑尊涛, 孙建鹏, 简 秋, 等. 啶酰菌胺在番茄和土壤中的残留及消解动态[J]. 农药, 2012, 51(9): 672-674.
汤永娇, 袁宏球, 朱 珠, 等. 超高效液相色谱法测定芒果中啶酰菌胺和吡唑醚菌酯[J]. 食品科学, 2014, 35(20): 175-179.
郭庆龙, 崔淑华, 段 浩, 等. 高效液相色谱串联质谱法测定蔬果中啶酰菌胺和环酰菌胺残留[J]. 食品科学, 2012, 33(10): 255-259.
占绣萍, 余淑红. 液相色谱法测定蔬菜中咯菌腈_溴虫腈和虱螨脲等农药的残留量[J]. 农药科学与管理, 2012,33(4): 31-34.
张 文. 62%嘧菌环胺· 咯菌腈水分散粒剂在葡萄上的残留分析及消解动态研究[D]. 贵阳: 贵州大学, 2015.
庄无忌. 國际食品饲料中农药残留限量法规: 第1卷[M]. 北京: 化学工业出版社, 2010: 108.
庄无忌. 国际食品饲料中农药残留限量法规: 第2卷[M]. 北京: 化学工业出版社, 2010: 148-149.
庄无忌. 国际食品饲料中农药残留限量法规: 第3卷[M]. 北京: 化学工业出版社, 2010: 452-454.
中华人民共和国国家卫生和计划生育委员会, 中华人民共和国农业部, 国家食品药品监督管理总局. 食品安全国家标准 食品中农药最大残留限量: GB 2763-2016[S]. 北京: 中国标准出版社, 2016.
中华人民共和国国家卫生和计划生育委员会, 中华人民共和国农业部, 国家食品药品监督管理总局. 食品安全国家标准 食品中啶酰菌胺残留量的测定 气相色谱-质谱法: GB 23200.68-2016[S]. 北京: 中国标准出版社, 2016.
中华人民共和国国家质量监督检验检疫总局. 水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱-串联质谱法: GB/T 20769-2008[S]. 北京: 中国标准出版社, 2008.
中华人民共和国国家卫生和计划生育委员会, 中华人民共和国农业部, 国家食品药品监督管理总局. 食品安全国家标准 水果和蔬菜中500种农药及相关化学品残留量的测定 气相色谱-质谱法: GB 23200.8-2016[S]. 北京: 中国标准出版社, 2016.
安 蓉, 薄美萍. 超高效液相色谱(UPLCTM)与质谱联用技术-改善药物和代谢分析的结果质量[J]. 现代科学仪器, 2006, 1: 20-23.