绝经后女性铁蓄积与骨代谢及机体炎症反应的相关性研究
程千 刘起富 金铭 赵国阳 徐又佳
1.上海交通大学医学院附属同仁医院,上海 200050 2.江苏大学附属医院,江苏 镇江 212000 3.山东省青州市人民医院,山东 潍坊 262500 4.苏州大学附属第二医院,江苏 苏州 215000
铁是维持人体生理功能所必需的微量元素之一[1-2],铁的缺乏可导致骨质的流失,进而诱发骨质疏松的发生[3-4]。然而,研究表明[5],体内的高铁负荷对成骨细胞具有毒性作用,过量的铁通过抑制成骨细胞的增殖和分化,促进破骨细胞的生成[6],诱发骨质疏松的形成。实验表明[7],铁蓄积可加重去势动物骨量减少。
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是一种全身性骨代谢疾病,表现为女性绝经后进行性的骨质疏松[8]。以往研究[9]表明,铁仅在雌激素缺乏的情况下影响骨量。然而,笔者研究[10]发现,铁蓄积是绝经后骨质疏松症的一个独立危险因素。本研究对绝经后女性体检者的相关数据进行了回顾性分析,探讨绝经后女性铁蓄积与骨代谢及机体炎症反应之间的相关性。

图1 PCA分组验证Fig.1 Verification of grouping by principal component analysis
1 材料和方法
1.1 资料来源
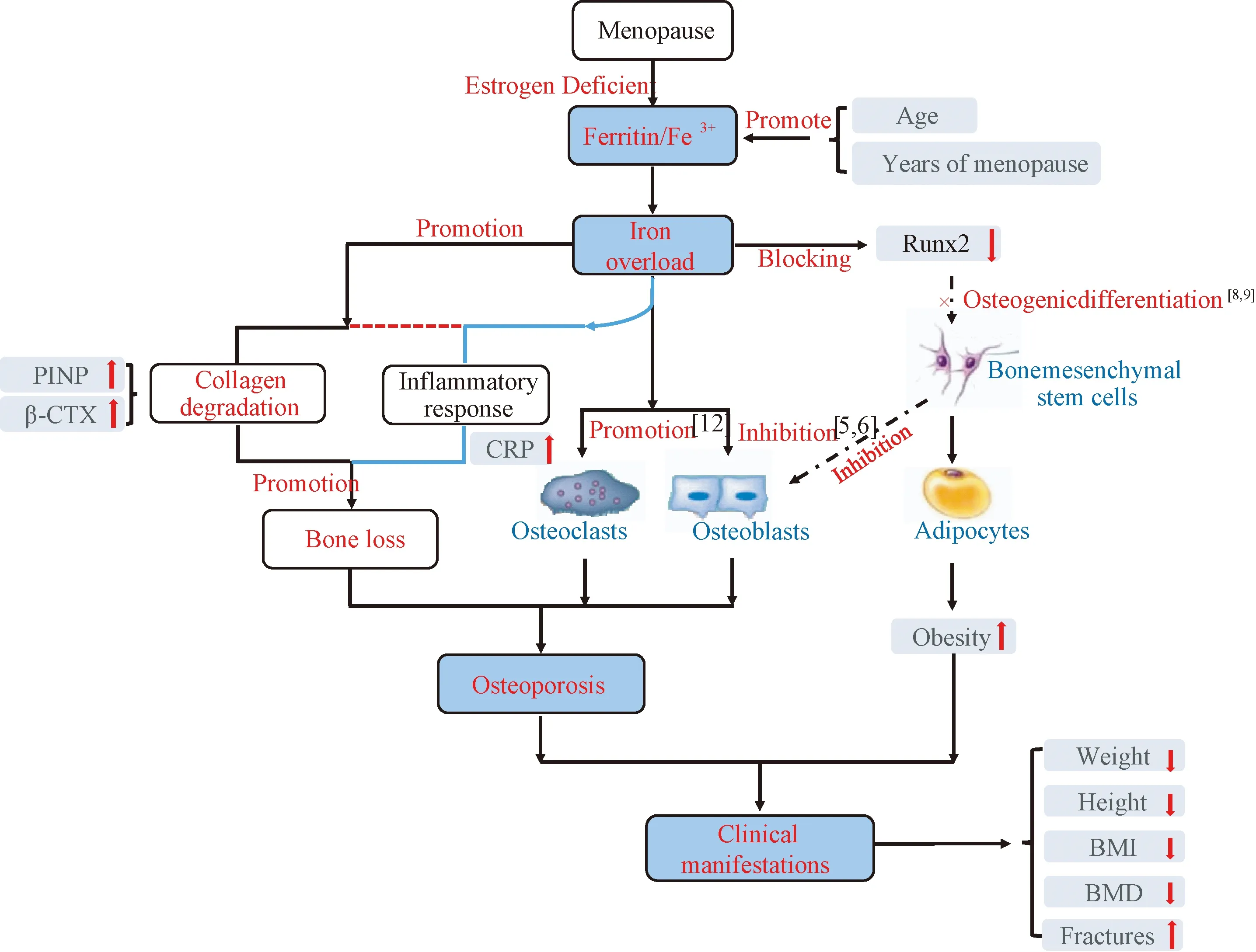
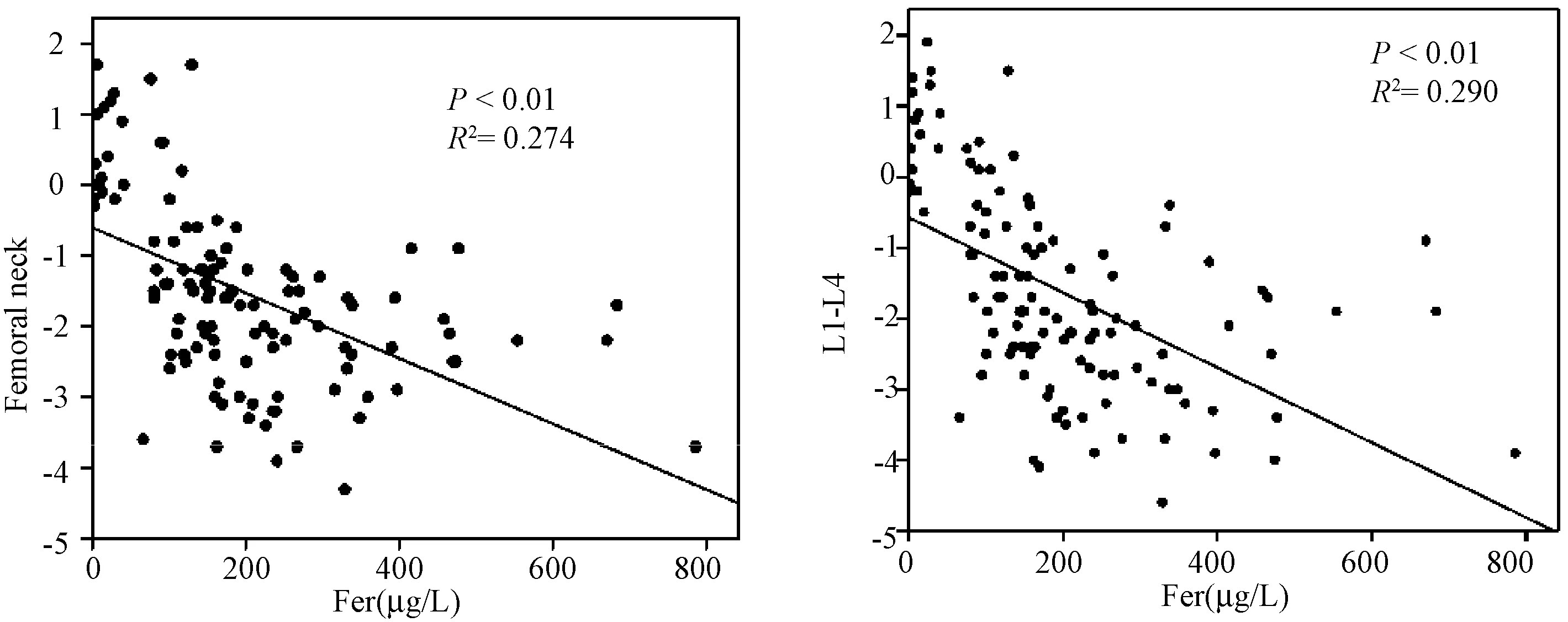
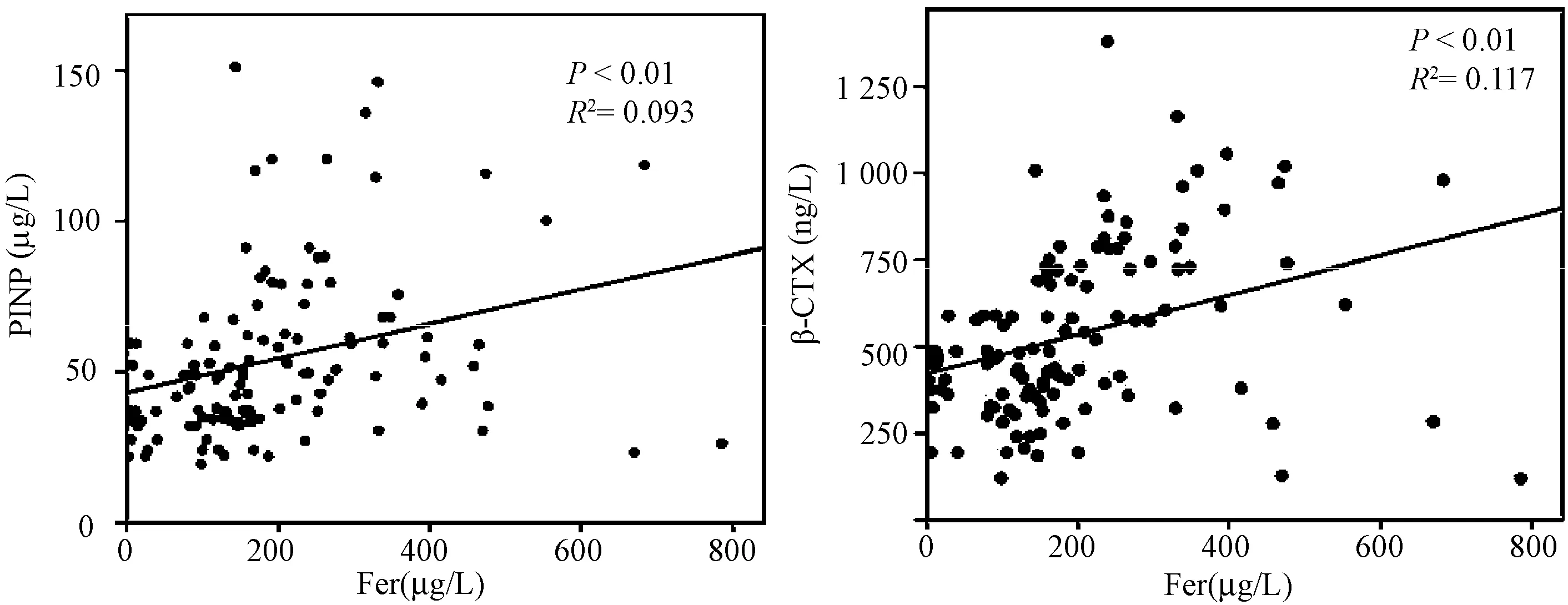
本研究收集了117名绝经后女性体检者资料,排除患有继发性骨质疏松症、小肠吸收不良或其他营养缺乏疾病。所有体检者均记录其身高、体重、体质量指数(bone mass index,BMI)、骨密度(bone mineral density, BMD),同时完善相关的血液指标检查。根据世界卫生组织WHO诊断标准[21],确定患有骨质疏松症的诊断标准为:T≥-1(骨量正常),-2.5 所有体检者均测定:血清生化指标[钙、磷、25(OH)D、血红蛋白、CRP、白细胞、肌酐、尿酸、丙氨酸氨基转移酶、谷草转氨酶、空腹血糖]、铁代谢指标[血清铁蛋白(Fer)、转铁蛋白(TRF)]、骨代谢指标[Ⅰ型胶原代谢产物(β-CTX、PINP)]。每位体检者在禁食一夜后(10 h或更长时间),抽取肘前静脉血,根据检验结果绘制图表。采用电化学发光检测血清Fer和TRF含量;通过电化学阻抗法检测血常规;其他生化指标采用酶动力学法测定(AU 5400,OLYMPUS, Japan);β-CTX、PINP也用标准ELISA方法评估。 将117名绝经后女性体检者,按照骨密度值分成3组,骨量正常组、骨量减少组和骨质疏松组。采用PCA进行分组验证,以保证分组的合理性和后续数据的准确性。其中需要考虑的因素有年龄、绝经年限、T值(股骨颈及L1~4)、血红蛋白、肌酐、尿酸、甘油三酯、总胆固醇、BMI、Fer、TRF、25(OH)D、β-CTX、PINP、Ca、P、CRP、WBC、AST、ALT、葡萄糖。用Dunnett’s多重分析检验正常组与骨量减少组、正常组与骨质疏松组的骨代谢指标的相关性。采用回归分析法分析血清铁蛋白、基线特征及骨代谢指标的相关性。 按照股骨颈和腰椎(L1~4)部位的T值,将117名绝经后女性体检者,分成正常组(n=28)、骨量减少组(n=71)和骨质疏松组(n=18)。采用PCA进行分组验证(图1),结果与按照T值分组一致,说明分组是准确的,具有统计学意义。就基线特征而言 (表1),从正常组到骨质疏松组,BMI呈下降趋势,女性随着年龄和绝经年限增加,体内出现铁蓄积,患骨质疏松症的风险增加,血清铁蛋白水平与BMD呈显著负相关(P<0.01),见图2;骨质疏松组在年龄、绝经年限、BMI、CRP等方面与正常组相比,有统计学意义(P<0.05);血清铁蛋白不仅与绝经年限呈正相关(P<0.01),同时与CRP水平呈正相关(P<0.05),见图3。 表1 正常组、骨量减少组和骨质疏松组的基线特征比较Table 1 Baseline characteristics in normal, bone loss, and osteoporosis group 注:与正常组相比,▲*P<0.05;与正常组相比,**P<0.01。 图2 血清铁蛋白与BMD的相关性Fig.2 The correlation between serum iron and BMD注:与正常组相比,▲*P<0.05;与正常组相比,**P<0.01。 图4 正常组、骨量减少组与骨质疏松组的血清铁蛋白、转铁蛋白、β-CTX、PINP的相关性Fig.4 Correlation among serum iron, β-CTX, and PINP in different groups 图5 血清铁蛋白与PINP、β-CTX的相关性Fig.5 Correlation between serum iron and β-CTX and PINP 正常组、骨量减少组和骨质疏松组的血清铁蛋白平均值分别为(120.96±43.18)、(223.37±130.27)、(307.50 ±161.48)μg/L,转铁蛋白平均值分别为(2±0.22)、(1.95±0.36)、(1.62±0.29)g/L。由图4可见,与正常组相比,骨量减少组和骨质疏松组的血清铁蛋白值显著升高(P<0.05),转铁蛋白值下降(P<0.05);骨质疏松组β-CTX平均值[(667.90±316.55)ng/L]高于正常组[(406.06±112.12)ng/L],P<0.05;PINP平均值[(78.03±37.31)μg/L]明显高于正常组[(37.60±13.17)μg/L],P<0.01。血清铁蛋白与骨代谢指标Ⅰ型胶原代谢产物β-CTX、PINP呈显著正相关(P<0.01,图5)。 骨组织中17%~20%的成分为胶原蛋白[11],其中最常见的为I型胶原蛋白。胶原蛋白的存在提高了骨的韧性,降低了骨的脆性,致使骨强度增加[12]。大约30%的胶原蛋白是由成骨细胞分泌的[13],其成分的改变加速了疾病的进展[14]。I型胶原蛋白由I型胶原氨基端延长肽(PINP)与Ⅰ型胶原羧基端肽(CTX)组成[15],它们是I型胶原蛋白的降解产物[16-17],是骨基质合成的生物标志物。其中PINP在血清中以两种形式存在,一种是与前胶原蛋白的天然分离产物相对应的完整的三聚肽,另一种是前胶原蛋白的降解产物单体肽[18]。I型胶原蛋白在骨吸收时释放CTX到血液中[19],包括α-CTX和异构化的β-CTX,前者只能在尿液中测出[20]。笔者首次报道了铁蓄积对胶原蛋白降解的影响,其通过促进I型胶原降解来增加骨吸收。统计结果显示,血清铁蛋白与PINP、β-CTX呈正相关。通过PubMed检索相关文献发现,金属离子的确能够促进或抑制胶原蛋白的降解,如Osorio等[21]发现体内锌过载,可抑制基质金属蛋白酶介导的胶原蛋白降解。 BMD是临床中诊断骨质疏松症的最重要的指标[22]。然而,单纯依靠BMD的T值进行分组,尚不能准确的描述样本的总体信息。如果样本分组错误,组与组之间的比较就会不准确,结果可能是错误的。PCA是一个多变量的数据分析,可以用来比较复杂的样本之间的相似点和不同点[23-25]。因此,笔者依据BMD的T值分组后,再使用PCA进行分组验证,如果得出的结果不一致,就要重新调整样本分组。但是通过结果观察到,经过PCA 验证,各组之间并没交叉,进一步证实了根据T值分成3组的合理性和可行性。因此,后续对各组之间的指标进行比较,就具有统计学意义。 我国女性的绝经年龄一般在50岁左右[26],通常年龄越大,绝经年限越长,体内的雌激素水平就越低。女性绝经后,随着年龄的增大,骨量逐渐减少,继而发生骨质疏松。骨质疏松症患者的身高和体重呈显著下降趋势,最终导致BMI明显降低。研究表明[27],铁盐能抑制羟磷灰石晶体的生长,说明了铁对骨形成有直接抑制作用。骨质疏松症患者的血清铁蛋白升高,BMD显著下降,绝经年限越长,铁蓄积越严重。 研究表明[28-29],小鼠体内铁蓄积与血清铁蛋白升高、Runx2 mRNA水平降低、成骨间质干细胞分化的抑制密切相关。根据临床相关数据分析,随着女性绝经年限的增加,其体内血清铁蛋白水平显著升高,铁蓄积促进I型胶原蛋白的降解,诱导体内炎症反应,同时增强破骨细胞活力,导致骨吸收增加,继而加速骨质疏松进程。所有这些过程均表现为身高的降低,体重下降,BMI及BMD下降,最终导致骨质疏松症(图6)。 图6 PMOP铁蓄积机制Fig.6 Mechanism of iron overload on PMOP CRP是体现机体炎症反应的重要指标,本实验发现,CRP值在骨量减少组和骨质疏松组明显升高,表明此时机体存在慢性炎症反应[30]。多项临床对照研究[31]表明,骨量减少与机体的慢性炎症状态有一定的相关性。女性绝经后,体内出现铁蓄积,机体处于慢性低度炎症状态,继而出现骨质疏松症,CRP随着血清铁蛋白的增加而升高,二者呈正相关。因此,研究炎症与骨质疏松症的相关性,或许会成为治疗骨质疏松症的新方法。 随着女性年龄的增大,血清铁蛋白逐渐升高,骨密度逐渐下降,二者之间存在显著相关性。血清铁蛋白升高时,骨量减少、骨质疏松的发生率增大,同时机体伴随着慢性炎症反应,加速I型胶原蛋白的降解,继而促进骨质疏松的进程。然而铁蓄积促进I型胶原蛋白降解的机制,炎症反应与骨质疏松症的相关机制仍不明确。后续笔者将继续研究胶原蛋白降解调控酶、炎症反应与血清铁蛋白具体调控酶之间的相互作用,为临床治疗骨质疏松提供新的思路。1.2 方法
1.3 统计学处理
2 结果
2.1 铁蓄积与骨质疏松及机体慢性炎症反应的相关性


2.2 铁蓄积与骨代谢指标的相关性
3 讨论