吡格列酮对糖尿病大鼠肾脏组织中干细胞标志物表达的影响*
张业, 严瑞,2, 李华, 刘畅, 周兴艳, 朱春玲,2**
(1.贵州医科大学, 贵州 贵阳 550004; 2.贵州医科大学附院 肾内科, 贵州 贵阳 550004)
糖尿病肾病(diabetic nephropathy,DN)作为糖尿病最常见的并发症,可引起进行性肾脏纤维化,最终发展为终末期肾病[1-2]。上皮细胞向间质细胞转化(epithelial-mesenchymal transition,EMT)是促使多种器官纤维化发生的重要进程,使正常组织及肿瘤组织中产生具有干细胞特性的细胞[3]。已有研究表明,成年人肾含有肾脏干(祖)细胞(kidney stem cell),这些细胞既可表达小管细胞标记物,又可表达足细胞标记物[4]。近来对噻唑烷酮类化合物(thiazolidinediones,TZDs)吡格列酮(pioglitazone)及其受体 PPAR-γ 的研究表明,TZDs 可通过减轻胰岛素抵抗、改善糖脂代谢及一些独立于降糖外的作用直接减轻肾脏疾病[5]。因此,本研究以糖尿病大鼠(DM)为研究对象,观察肾组织中干细胞标志物及肾脏纤维化指标的表达变化,同时观察吡格列酮是否会影响上述指标的表达水平,为吡格列酮治疗DN提供新的理论依据。
1 材料和方法
1.1 主要材料与试剂
SPF 级SD大鼠(雄性),体质量(185±15)g(购自华阜生物有限公司,许可证号SCXK(京)2009-0004),链脲佐菌素(STZ,美国Sigma公司),BCA蛋白浓度测定试剂盒(北京碧云天生物公司),预染Marker(Thermo Scientific公司)、rabbit-anti-β-actin ( 巴傲得生物科技有限公司)、rabbit-anti-CD24(Proteintech公司) 、rabbit-anti-CD133(abcam公司)、rabbit-anti-Fibronectin、rabbit-anti-E-cadherin、rabbit-anti-α-SMA(Proteintech公司),总RNA提取试剂盒(天根生化科技公司),引物合成(上海生工公司),real-time PCR试剂盒(Takara公司)
1.2 方法
1.2.1动物模型建立及实验分组 SD大鼠共24只,随机均分为正常组(NC组)、糖尿病组(DM组)及吡格列酮治疗组(DP组)。DM及DP组大鼠禁食(不禁水)12 h后,将1%STZ按照55 mg/kg腹腔注射,72 h后通过其尾静脉检测血糖,当血糖≥16.7 mmol/L提示达到成模标准。NC组给予同等体积的柠檬酸钠缓冲液腹腔注射。DP组模型大鼠饲养3周后,给予吡格列酮10 mg/(kg·d) 灌胃治疗8周,每周休息1 d;NC、DM组予同等量的生理盐水灌胃。3组大鼠饲养至16周时,大鼠禁食(不禁水)12 h,麻醉后取股动脉血,4 ℃离心后分离出血清,测定血清葡萄糖含量;之后处死大鼠,解剖、摘除双侧肾脏用于后续检测。
1.2.2肾组织CD24、CD133、E-cadherin、α-SMA及Fibronectin蛋白测定 取大鼠肾组织皮质部分,加入蛋白裂解液研磨后提取出总蛋白,蛋白浓度通过BCA法测定。将各组蛋白质样品加至SDS-PAGE凝胶中,经电泳、转膜、5%脱脂牛奶封闭后,用CD24、CD133、E-cadherin、α-SMA、FN及 β-actin 对应的一抗(分别按照1∶800、1∶600、1∶1 000、1∶600、1∶1 000 及1∶6 000稀释)孵育转有蛋白的PVDF膜,将其放置于摇床上,并在4 ℃冰箱中轻度摇晃过夜;TBST洗膜3次后,加入Goat Anti-Rabbit二抗稀释液(1∶6 000)后在室温中孵育1 h;再次用TBST洗膜3次,ECL 显色,最后曝光成像。实验结果用 Imaje J 软件检测出不同分组、不同蛋白所得条带的灰度值,以β-actin的灰度值作为内参,得出目的蛋白的相对含量。
1.2.3肾组织中CD24和CD133 mRNA测定 应用Trizol法提取大鼠肾组织的总RNA并测定其浓度,步骤参照北京天根公司提供说明书;选取20 μL作为反转录的反应体系合成模板cDNA,应用上海生工公司提供的PCR引物,采用SYBR premix Ex TaqII进行荧光定量PCR。目的基因引物序列见表1。
1.3 统计学方法


表1 目的基因引物序列Tab.1 Primer sequence in real time RT-PCR
2 结果
2.1 肾组织中的CD24和CD133mRNA表达
与NC组比较,DM组大鼠肾组织CD24、CD133 mRNA表达增多,差异有统计学意义(P<0.05),DP组差异无统计学意义(P>0.05)。与DM组比较,DP组两种mRNA表达显著减少(P<0.05)。见图1。
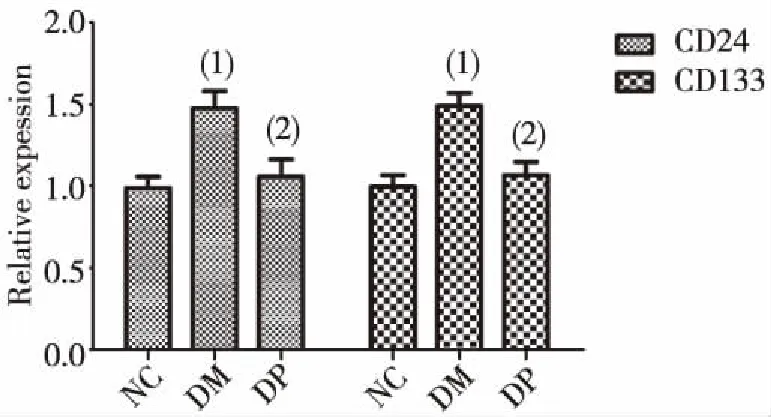
(1)与NC组比较,P<0.05; (2)与DM组比较, P<0.05图1 各组大鼠肾组织CD24和CD133 mRNA表达Fig.1 Expression of CD24 mRNA and CD133 mRNA in kidney tissue in each group
2.2 CD24和CD133蛋白表达
与NC组比较,DM组大鼠肾组织CD24、CD133蛋白表达增多,差异有统计学意义(P<0.05),DP组差异无统计学意义(P>0.05)。与DM组比较,DP组大鼠肾组织两种蛋白表达均减少,差异有统计学意义(P<0.05)。见图2。
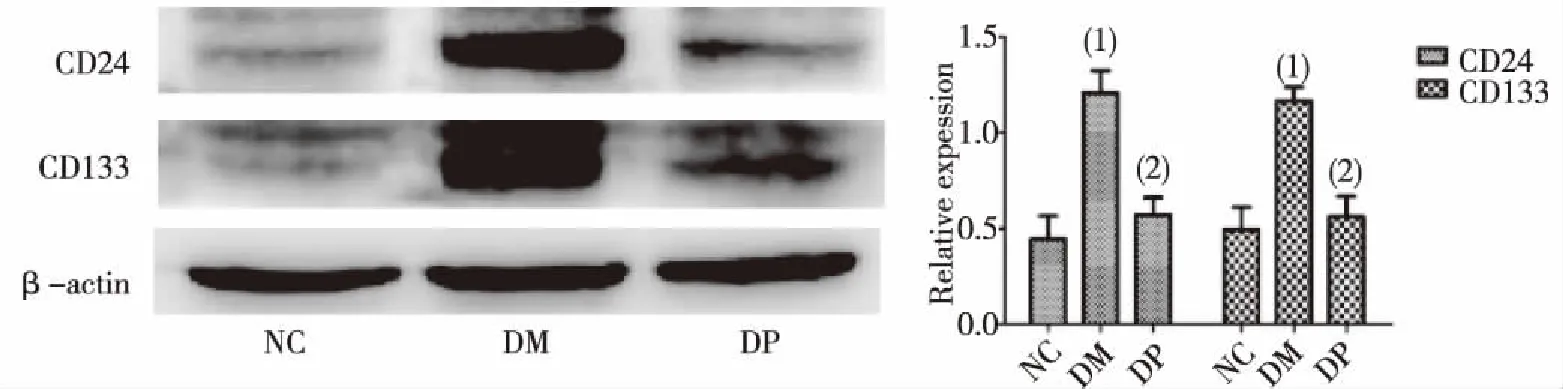
(1)与NC组比较,P<0.05;(2)与DM组比较, P<0.05图2 各组大鼠肾组织CD24和CD133蛋白表达Fig.2 The protein expression of CD24 and CD133 in renal tissues in each group
2.3 肾组织中E-cadherin、α-SMA及Fibronectin蛋白表达
与NC组比较,DM组大鼠肾组织Fibronectin、α-SMA蛋白表达增多,E-cadherin表达减少,差异有统计学意义(P<0.05),DP组差异无统计学意义(P>0.05)。与DM组比较,DP组大鼠肾组织Fibronectin、α-SMA蛋白表达减少,E-cadherin表达增多,差异有统计学意义(P<0.05),见图3。
3 讨论
糖尿病肾病的病理发展包括肾小球硬化和肾小管间质的纤维化。在促纤维化因子及炎性因子作用下可发生肾小管EMT[6],并引起细胞外基质(extracellularmatrix,ECM)的过度沉积。纤维蛋白是细胞外基质的框架,主要包括胶原蛋白(collagen)、纤连蛋白(fibronectin)和弹性蛋白(elastin),它们可作为预测ECM沉积的因子[7]。有研究证实[4,8],成年人肾脏组织中存在干/祖细胞区室,如Bowman’ s 囊中的CD24+CD133+细胞。在不同的急性肾损伤(AKI)小鼠模型中都证实了此类细胞在肾脏修复中的作用:输注后可以降低小鼠的死亡率,改善肾功能[9]。在阿奇霉素所致慢性肾损伤小鼠模型中证实,上述细胞可产生新的肾小管上皮细胞及足细胞,并且在急性或慢性肾脏损伤的患者肾脏组织中发现CD24+CD133+细胞增殖活跃[10]。但目前对肾脏干细胞的研究大多集中在对胚胎肾、急性肾损伤模型及外源性干细胞治疗方式,在成体及慢性肾损伤中是否存在干细胞仍有争议[11]。Kusaba[12]通过对细胞损伤和修复的克隆分析认为,干细胞标记物的产生是由于终末分化的上皮细胞在损伤后发生了去分化,使其在间充质状态期间发生了再表达,而不是干细胞群的功能体现。CD24、CD133可表达于多种细胞,并作为多数器官和肿瘤组织中干/祖细胞的表面抗原标志物[13]。
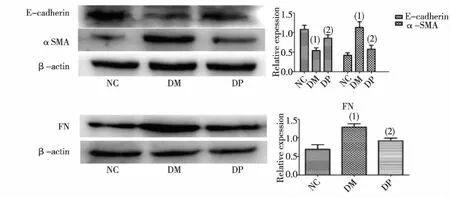
(1)与NC组比较,P<0.05; (2)与DM组比较, P<0.05图3 各组大鼠肾组织中E-cadherin、α-SMA及Fibronectin的表达Fig.3 The protein expression of E-cadherin、α-SMA and Fibronectin in kidney tissues in each group
EMT 分为1 型参与胚胎形成及器官发育,2 型参与组织再生与创伤、炎症后的修复和3 型参与肿瘤相关疾病3种类型[14]。有研究证实,在肺组织[15]、乳腺组织[16]及皮肤组织[16]中,EMT的发生可诱导细胞获得干性特征,使已分化的细胞表现出类似干/祖细胞增殖克隆和自我更新的特性,但它们的增殖种类与分化方向不定[17]。在EMT发生过程中,具有上皮表型特征的E-钙黏蛋白(E- cadherin)可表达下调,具有成纤维表型特征的α-平滑肌肌动蛋白(α- SMA)可上调[18]。 大量研究证实,在STZ诱导的糖尿病鼠中,噻唑烷二酮类药物可通过调节糖代谢、脂代谢对肾脏产生间接保护作用[19];还可通过直接保护肾脏血管内皮细胞及减轻足细胞损伤,抑制肾脏系膜的增生,防止肾小球硬化,抑制肾小管的间质纤维化[20]。而在DM大鼠中,吡格列酮是否可通过抑制EMT的进程,减轻肾脏纤维化,并影响肾脏干细胞标志物的表达目前尚不清楚。
因此,为了探讨吡格列酮对肾脏中干细胞标志物表达的影响,本研究采用腹腔注射STZ的方法复制大鼠DN模型,用Westernblot、Real-time PCR的方法检测CD24、CD133、E-cadherin、α-SMA、Fibronectin蛋白及CD24、CD133mRNA的表达变化。实验发现,DM大鼠肾组织中肾脏纤维化标志物Fibronectin蛋白表达增加,肾小管上皮细胞表型标志物E-cadherin蛋白减少而纤维细胞标志物α-SMA蛋白大量表达,与之伴随的是CD24、CD133蛋白及mRNA表达上调;而在DP大鼠肾组织中发现Fibronectin、α-SMA蛋白、CD24、CD133蛋白及mRNA表达均下降,E-cadherin蛋白表达增多。因此,本实验认为CD24、CD133参与了肾脏纤维化的进程。由此猜测,在糖尿病大鼠肾组织中,EMT的发生可诱导已分化的上皮细胞转分化至间充质细胞,这类细胞获得了扩增和迁移等干细胞特征,并且可表达干细胞标志物,它们可能分化成了肌成纤维细胞,分泌细胞外基质,导致肾脏纤维化的发生。同时,成体肾脏干细胞只有在肾脏发挥修复作用时才可由静止状态转向增殖状态[21]。Lasagni等[22]发现,在局灶性肾小球硬化症的小鼠模型中,阻断 Notch 通路可减轻肾小球损伤,但会引起干细胞的增殖减少。随着糖尿病肾病的进展,可能使CD24+CD133+细胞等肾脏干细胞的激活,这类细胞在体内发生了增殖与分化,一定程度上参与修复肾脏固有细胞的损伤,最终大鼠肾脏纤维化的程度可能取决于肾脏固有细胞的死亡与肾脏干/祖细胞的再生之间的平衡。而吡格列酮可能通过抑制EMT进程,使具有干性特征的间充质细胞及其分化的肌成纤维细胞减少,从而减轻了肾脏纤维化程度,同时也使肾脏干细胞的增殖减少。
综上,在DN条件下,大鼠肾组织中干细胞标志物CD24、CD133的表达变化可能与EMT有关,同时证实了吡格列酮可抑制EMT、减轻肾脏纤维化并影响肾脏干细胞标物的表达水平。今后,将通过体外实验及基因干预的方法,从而较为全面、直接地研究肾脏干细胞的作用及吡格列酮在其中发挥的作用。

