胆总管结扎术大鼠血清通过调控AP-2α对骨髓间充质干细胞旁分泌功能影响的实验研究*
兰 凯,王让周,钱燕芳, 陈 杨,木 森△
1.陆军第75集团军医院麻醉科(大理 671000);2.陆军军医大学第一附属医院麻醉科(重庆 400038)
肝肺综合征(Hepatopulmonary syndrome, HPS)病死率高、防治困难。近年报道发现病理性肺血管新生在HPS的发生发展中起到重要作用[1]。同时动物实验也证实血管内皮生长因子(VEGF)、基质细胞衍生因子-1(SDF-1)以及血小板衍生生长因子-BB(PDGF-BB)等血管新生相关因子在HPS大鼠外周血和肺组织中表达增高[2]。这些因子一方面可通过直接作用于微血管内皮细胞促进其增殖,另一方面可以通过募集干细胞及单核细胞的间接促进HPS大鼠肺病理性血管新生[3-4]。激活蛋白AP-2是一种序列特异性的转录因子,由AP-2α、AP-2β、AP-2γ、AP-2δ 和 AP-2ε等几个关系密切、结构保守的成员组成。在乳腺癌相关的研究中发现AP-2α对在维持乳腺癌管腔样表型中起重要作用[5];且AP-2α还可以通过HIF-1α信号通路促进鼻咽癌细胞的生长[6]。另外有研究发现,人肺的非癌肺正常组织、腺癌组织和鳞癌组织有AP-2α的表达,显示AP-2α在人存在于人肺组织中存在[7]。由此可见,AP-2在调控多种基因的表达中发挥广泛的生理和病理生理作用。本研究拟通过建立应用HPS动物模型,应用动物模型的血清刺激体外培养的骨髓间充质干细胞(BM-MSCs)并通过siRNA抑制AP-2α表达,检测各组细胞AP-2α表达及旁分泌SDF-1、VEGF、PDGF-BB水平。
材料与方法
1 实验动物 SPF级健康雄性SD大鼠,体重200~220 g,购自第三军医大学野战外科研究所,饲养于有灯光控制、分12 h白昼变换的房间,自由饮水和进食标准食物。实验前至少1周在该房间适应环境。
2 实验分组及HPS大鼠模型的建立 将实验动物分为两组,每组12只:Sham手术组(S组)、胆总管结扎(CBDL)手术组(C组),每组均于12 h、24 h和48 h三个时间点以血清刺激,即分为三个亚组,每亚组样本数为4例。在实验之前,大鼠禁食12 h,仅给自由饮水。麻醉方法:腹腔注射5% 水合氯醛麻醉(0.08ml/kg)。CBDL大鼠手术方法:沿上腹正中线切开皮肤,剪开皮下组织、腹膜进腹;沿肝十二指肠韧带寻找胆总管,于胰腺上方近十二指肠处游离胆总管,双重结扎,并于两结扎线之间切断;连续缝合腹膜、皮下组织、皮肤、关腹;待复温至动物苏醒后,移入动物房,术后动物自由饮食。Sham组手术方法:仅行一个简单的剖腹手术,分离胆总管但并不结扎,术后4周分离各组大鼠外周血,离心获取血清保存于-80℃待用。
3 Western blot检测AP-2α的表达 大鼠称重麻醉后,将双下肢皮肤剥离后离断并放入含有青霉素-链霉素溶液的PBS中漂洗。在无菌条件下去除肌肉及附着软组织,剪开长骨两端,用注射器将骨髓冲入无菌小烧杯中并加入10 ml完全培养基吹打混匀,使用200目的细胞滤网过滤悬液以去除大块组织。向每个T25细胞培养瓶中加入4~5 ml细胞悬液并置于37℃、5%CO2培养箱中培养。随后将获取的细胞破碎后用裂解液裂解,使用BCA法测定组织样品蛋白浓度,按每孔20 μg上样并进行SDS-PAGE分析,转膜后,5%脱脂奶粉封闭,一抗孵育过夜,TBST洗3次后,二抗孵育2 h,TBST洗3次、后ECL显色后置于Bio-rad成像仪中分析条带吸光度值。
4 SDF-1、VEGF和PDGF-BB的检测 获取各组细胞培养液,采用ELISA法按照试剂盒说明书检测各组细胞在不同时间点各组细胞旁分泌SDF-1、VEGF和PDGF-BB的水平。
5 BM-MSCs转染AP-2α siRNA 通过Ribobio生物公司购买AP-2α特异性siRNA(5'-GATCGAACTGACCGCCCGCGGCCCGT-3')和对照siRNA(5'-GCAAATATCACCCAGGCCCAT-3')。 根据试剂说明,使用转染试剂分别将AP-2α siRNA(50nmol/L)和对照RNA(50nmol/L)转染到BM-MSCs中。 然后,将BM-MSCs与正常大鼠血清或HPS大鼠血清一起温育48 h,通过Western blot检测转染效率。
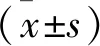
结 果
1 S组和C组细胞各时间点AP-2α表达及旁分泌SDF-1、VEGF、PDGF-BB水平 与S组相比,C组血清刺激体外培养的BM-MSCs后,AP-2α的表达以及SDF-1、VEGF的分泌在各个时间点均明显升高且呈递增趋势(P<0.05),而PDGF-BB的分泌仅在C组血清刺激后48h明显升高(P<0.05)。见表1(图1)。
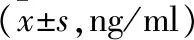
表1 CBDL大鼠血清刺激后各时间点BM-MSCs旁分泌 细胞因子水平
注:与0 h组比较,*P<0.05
2 Western blot检测AP-2αsiRNA转染效率 Western blot结果显示,与对照siRNA相比AP-2α siRNA转染能明显降低S组和C组细胞中AP-2α的表达水平(P<0.05,图2)。

图1 CBDL大鼠血清刺激后BM-MSCs各时间点AP-2α表达

与S组+对照siRNA比较,*P<0.05;与C组+对照siRNA比较,#P<0.05
图2siRNA转染后各组BM-MSCs的AP-2α表达
3 siRNA抑制AP-2α表达后检测各组细胞旁分泌SDF-1、VEGF和PDGF-BB的水平 ELISA试验结果显示,siRNA降低AP-2α的表达后能明显抑制C组血清刺激48 h引起的SDF-1、VEGF、PDGF-BB分泌增加(P<0.05),见表2。
讨 论
肝肺综合征是慢性肝病的严重肺部并发症,最近的研究表明,病理性肺血管新生在 HPS 的发生发展中起到重要作用[1],然而其发生机制还没有完全阐明。AP-2α作为一种序列特异性的转录因子,既往的研究发现其可以促进病理性血管新生,从而参与多种癌症细胞的生长过程中[5-6]。本研究通过观察肝肺综合征动物模型CBDL大鼠血清对骨髓间充质干细胞(BM-MSCs)旁分泌功能的影响,并探索转录因子AP-2α在其中的相关机制后发现:与对照组相比,C组(CBDL大鼠)血清刺激体外培养的BM-MSCs后,AP-2α的表达以及SDF-1、VEGF的分泌在各个时间点均明显升高且呈递增趋势,而PDGF-BB的分泌仅在C组血清刺激后48 h明显升高。而AP-2α siRNA转染可明显能明显抑制C组血清刺激引起的SDF-1、VEGF、PDGF-BB分泌增加。以上结果表明HPS血清刺激体外培养的BM-MSCs可能通过激活转录因子AP-2α从而增强其旁分泌功能,且该结果也表明AP-2α可能在HPS肺血管新生中起到重要作用。

表2 siRNA转染后各组BM-MSCs旁分泌相关细胞因子水平
注:与S组+对照siRNA比较,*P<0.05;与C组+对照siRNA比较,#P<0.05
既往研究发现,干细胞对促进血管新生过程具有重要作用[8-9],然而在不同疾病状态下主要动员的干细胞类型和调控机制有所不同。在急性肺损伤模型中,参与修复性血管新生的细胞主要来源于肺组织自身来源的EPCs和MSCs[10-11]。在慢性疾病的病理性血管新生过程中,由于病理性因子的持续刺激,来源最丰富的BM-MSCs动员并归巢到作用部位发挥主要效应作用。MSCs 的旁分泌功能增强是一个众多细胞因子和信号通路参与的过程,组织损伤后释放大量促血管生成因子,如血管内皮生长因子A (Vascular endothelial growthfactor-A, VEGF-A)、基质细胞衍生因子-1(Stromal cell derived factor-1,SDF-1)、血小板衍生生长因子-BB(Platelet-derived growth factor,PDGF-BB)、成纤维细胞生因子(Fibroblast growth factor, FGF)等。SDF-1是小分子的细胞因子,属于趋化因子蛋白家族,其特异受体是CXCR4。CXCR4是CXC趋化因子亚家族的受体,为高度保守的具有7次跨膜结构组成的G蛋白耦联受体,在体内大部分组织和器官上都有表达。研究表明,SDF-1 通过与CXCR4 N端区域和细胞外环-2(Extracellular loop,ECL)结合启动下游PI3K/Akt、MAPK/ERK、JAK/STAT等信号通路来调控细胞的运动、趋化、黏附和分泌功能表达[12]。研究发现在血小板减少的小鼠中,血浆中SDF-1升高及CXCR4+、VEGFR1+细胞的动员和组织修复严重受损,在给予血小板后或加强SDF-1表达后,则能够重新进行血管新生,说明SDF-1在血管新生中和组织修复中起到重要作用[13]。另外发现SDF-1/CXCR4趋化信号轴在介导BM-MSCs细胞参与HPS肺血管新生中起到重要的作用,该研究也显示SDF-1可通过激活下游信号促进细胞旁分泌VEGF功能增强[3]。同时,Fallon等人的研究团队发现CX3CL1可趋化单核细胞在肺内聚集,最后通过促进VEGF的表达从而促进引起HPS动物模型后期肺微血管的炎性增生。我们既往的研究表明,HPS状态下CBDL大鼠的骨髓间充质干细胞的动员增多,并可通过旁分泌SDF-1、VEGF以及PDGF-BB等细胞因子促进HPS肺血管新生[14]。以上研究提示,SDF-1、VEGF以及PDGF-BB均在病理性血管新生中起到重要作用,通过抑制这些血管新生因子以控制血管新生对HPS起到治疗作用。针对这些血管新生因子进行调控可控制HPS血管新生进程从而对HPS起到治疗作用。
在本次研究中,我们进一步发现了HPS状态下转录因子AP-2α明显上调并促进了BM-MSCs旁分泌相关细胞因子的功能。表明针对AP-2α这一治疗靶点进一步探索HPS新的治疗方式具有重要意义。然而在本研究中,AP-2α的敲低并未完全消除CBDL血清对本研究中BM-MSCs旁分泌功能的影响,这可能是由于HPS状态下BM-MSCs旁分泌功能的变化受到多种机制的调控,例如文献报道HPS状态下可机体通过激活氧化应激因子Nrf 2增强BM-MSCs促血管新生相关功能[12]。因此提示,仅仅抑制HPS的致病靶点之一是不够的,应进一步研究HPS联合治疗方式以达到治疗目的具有重要意义。然而,我们的研究也存在一些局限性:首先,我们没有进行体内试验来阐明AP-2α是如何调控BM-MSCs从而参与HPS的肺血管生成;其次,我们的本研究结论还需要进一步的临床试验验证证据支持。尽管需要进一步完善相关机制的探索,但综上所述,我们的本研究发现AP-2α在HPS的潜在作用并为其进一步针对HPS肺血管新生的相关的HPS治疗提供了依据基础。

