高效液相色谱-串联质谱法测定大鼠组织中的吡蚜酮
于 巍,陈立峰,王智琴,韩 静
(1.沈阳药科大学,辽宁 沈阳 110016;2.沈阳化工大学,辽宁 沈阳 110142;3.辽宁千一测试评价科技发展有限公司,辽宁 本溪 117000)
吡蚜酮属于吡啶类或三嗪酮类杀虫剂,是全新的非杀生性杀虫剂。关于吡蚜酮在农作物中的残留量测定已有很多报道,如,冯义志等[1]研究了吡蚜酮在小麦中的含量测定方法;徐金丽等[2]研究了吡蚜酮在烟草中的含量测定方法;刘建华、吴亚坚等[3-4]研究了吡蚜酮不同剂型的含量测定方法;齐畅等[5]研究了果蔬中吡蚜酮的测定方法。目前,尚未见吡蚜酮在大鼠组织等生物样品中测定方法的报道。
本研究拟采用高效液相色谱-串联质谱法(HPLC-MS/MS)测定大鼠组织中的吡蚜酮,探讨最高非致死染毒剂量下吡蚜酮原药在大鼠体内的组织分布特征,考察大鼠主要脏器中吡蚜酮浓度的动态变化过程,并验证HPLC-MS/MS法的专一性、准确性及可靠性,以期为吡蚜酮的慢性毒性以及致癌性研究的剂量选择提供依据,为其安全性评价提供数据支持。
1 实验部分
1.1 主要仪器与装置
LC-20A/API4000高效液相色谱-三重四极杆串联质谱仪:美国AB Sciex 公司产品,配有电喷雾离子源(ESI)及Analyst 软件;电子天平:德国Sartorius公司产品;超纯水仪:美国Millipore公司产品,配有0.22 μm终端过滤膜;台式高速冷冻离心机:德国Sigma公司产品,配有1.5 mL 转子;高速分散机:德国IKA公司产品;移液器、电动移液器:德国Eppendorf 公司产品;-20 ℃低温冷冻储藏箱:海尔公司产品;大鼠代谢笼:上海辛迪实验器材有限公司产品。
1.2 主要材料、试剂与实验动物
吡蚜酮原药:纯度99.3%,沈阳科创化学品有限公司产品;吡蚜酮、内标吡虫啉标准品:纯度均大于99.8%,北京万佳首化生物科技有限公司产品;乙腈、50%甲酸:色谱纯,美国Thermo Fisher公司产品;实验用水:由Millipore Synergy UV型超纯水机制备。
SPF级SD大鼠,质量(200±20) g,许可证号为SCXK(辽)2010-0001,由辽宁长生生物技术有限公司提供。动物引入后,饲养于辽宁千一测试评价科技发展有限公司屏障环境动物实验室。
1.3 实验条件
1.3.1色谱条件 色谱柱:Phenomenex Luna C18柱(50 mm×4.6 mm×5 μm),100 A;流动相:A为0.1%甲酸水溶液,B为0.1%甲酸-乙腈溶液;流速:0.5 mL/min;柱温:35 ℃;进样量:10 μL;梯度洗脱程序:0~0.5 min(95%A),0.5~2.0 min(95%~5%A),2.0~3.0 min(5%A),3.0~3.1 min(5%~95%A),3.1~5.0 min(95%A)。
1.3.2质谱条件 电喷雾离子源(ESI源);多反应监测(MRM)正离子模式(ESI+);定量离子对:m/z218.3>105.3(吡蚜酮),m/z256.1>175.1(内标吡虫啉);离子源温度:500 ℃;喷雾电压(IS):5 000 V;碰撞气(CAD):20.7 kPa;去簇电压(DP):41 V;辅助加热气(GAS1):344.7 kPa;雾化气(GAS2):379.2 kPa;气帘气(CUR):172.3 kPa;碰撞能量(CE):30.0 eV。
1.4 实验方法
1.4.1溶液配制 准确称取吡蚜酮原药,用0.5%羧甲基纤维素钠水溶液配成100 g/L供试品溶液,需在24 h内使用。用乙腈配制1.00 g/L吡蚜酮标准储备液,于4 ℃密闭保存,使用时用乙腈逐级稀释成标准工作溶液。用乙腈配制1.00 g/L吡虫啉标准储备液,于4 ℃密闭保存,使用时用乙腈稀释成500 μg/L内标溶液。
1.4.2剂量设计及染毒 根据吡蚜酮在大鼠体内的毒代动力学实验结果[6],兼顾雄性大鼠急性经口毒性半数致死剂量LD50大于5 000 mg/kg,将给药剂量1 000 mg/kg设为上限[7-8]。随机取21只雄性大鼠,分成6组:1组空白对照(1只),其余大鼠分成5组,每组4只,按设计剂量开始投药,投药前须禁食约18 h。以经口胃投法一次给足设计剂量,给药后将大鼠放回代谢笼内,自由进食、饮水。
1.4.3样品采集 给药前将空白对照组大鼠解剖,给药后分别在10 min、2 h、96 h、120 h、144 h时间点解剖一组动物(4只)。采用CO2麻醉,腹主动脉放血后解剖,取心、肝、脾、肺、肾、脑、肌肉、睾丸、脂肪等脏器,分别用生理盐水和蒸馏水冲洗后,滤纸吸干水分,装入惰性塑料袋中,置于-20 ℃冷冻,待测。
1.4.4样品前处理 取约1.00 g室温解冻后的大鼠脏器样品(睾丸除外,取一侧睾丸全部处理),不足1.00 g的脏器全部处理,准确称其质量;将样品剪碎后,加入两倍量的乙腈,置于匀浆机匀浆至均匀,即为组织匀浆液。移取适量组织匀浆液至1.5 mL离心管中,以15 000 r/min离心10 min,取200 μL上清液,加入200 μL内标溶液,混匀,待仪器分析。
超过定量上限的样品,采用空白组织基质稀释后,再依照上述方法进行处理和分析。
2 结果与讨论
2.1 分析方法验证
2.1.1标准曲线、定量范围、准确度与精密度
依据文献[9-10]方法考察了吡蚜酮在肝组织基质中浓度的标准曲线、定量范围,同时考察了吡蚜酮在心、肝、脾、肺、肾、脑、肌肉、脂肪、睾丸等组织基质中的准确度和精密度。
用乙腈将吡蚜酮标准储备液稀释成浓度分别为1.0、2.0、4.0、8.0、20、80、160、200 mg/L标准曲线工作溶液,用空白肝组织匀浆液稀释标准曲线工作溶液,配制成浓度分别为50、100、200、400、1 000、4 000、8 000、10 000 μg/L标准曲线样品。按1.4.4节方法将样品处理后进行仪器分析。吡蚜酮的保留时间约2.3 min,内标吡虫啉的保留时间约2.9 min,吡蚜酮的最小检出量为0.5×10-9g,最小检出浓度为50 μg/L。以吡蚜酮与其内标吡虫啉峰面积之比为纵坐标,二者浓度之比为横坐标,进行线性回归,得到回归方程为y=ax+b,结果列于表1。结果表明,吡蚜酮在50~10 000 μg/L范围内的线性关系良好,标准曲线的相关系数大于0.98。吡蚜酮标样的典型色谱图示于图1,空白组织色谱图示于图2,给药后的组织样品色谱图示于图3。
用乙腈将吡蚜酮标准储备液稀释成浓度分别为1.6、16、160 mg/L质控样品工作溶液,用空白心、肝、脾、肺、肾、脑、肌肉、睾丸、脂肪组织匀浆液序列稀释质控样品工作溶液,配制成浓度分别为80 μg/L(LQC)、800 μg/L(MQC)、8 000 μg/L(HQC)质控样品,每个浓度重复5次,经前处理后进行测定,结果列于表2。3个浓度的质控样品准确度在80%~120%之间,批内精密度相对标准偏差(RSD)均小于15%,说明该方法有较好的准确性和重现性。

表1 吡蚜酮肝组织基质线性方程参数Table 1 Linear equation parameters of pymetrozine in liver tissue matrix

注:a.吡蚜酮;b.内标图1 吡蚜酮标样色谱图 (肝组织基质,1 000 μg/L)Fig.1 Standard chromatograms of pymetrozine (liver tissue matrix, 1 000 μg/L)
注:a.吡蚜酮;b.内标图2 空白肝组织基质色谱图Fig.2 Chromatograms of blank liver tissue matrix

注:a.吡蚜酮;b.内标图3 给药10 min后大鼠肺组织样品色谱图Fig.3 Chromatograms of rat lung tissue sample after administration
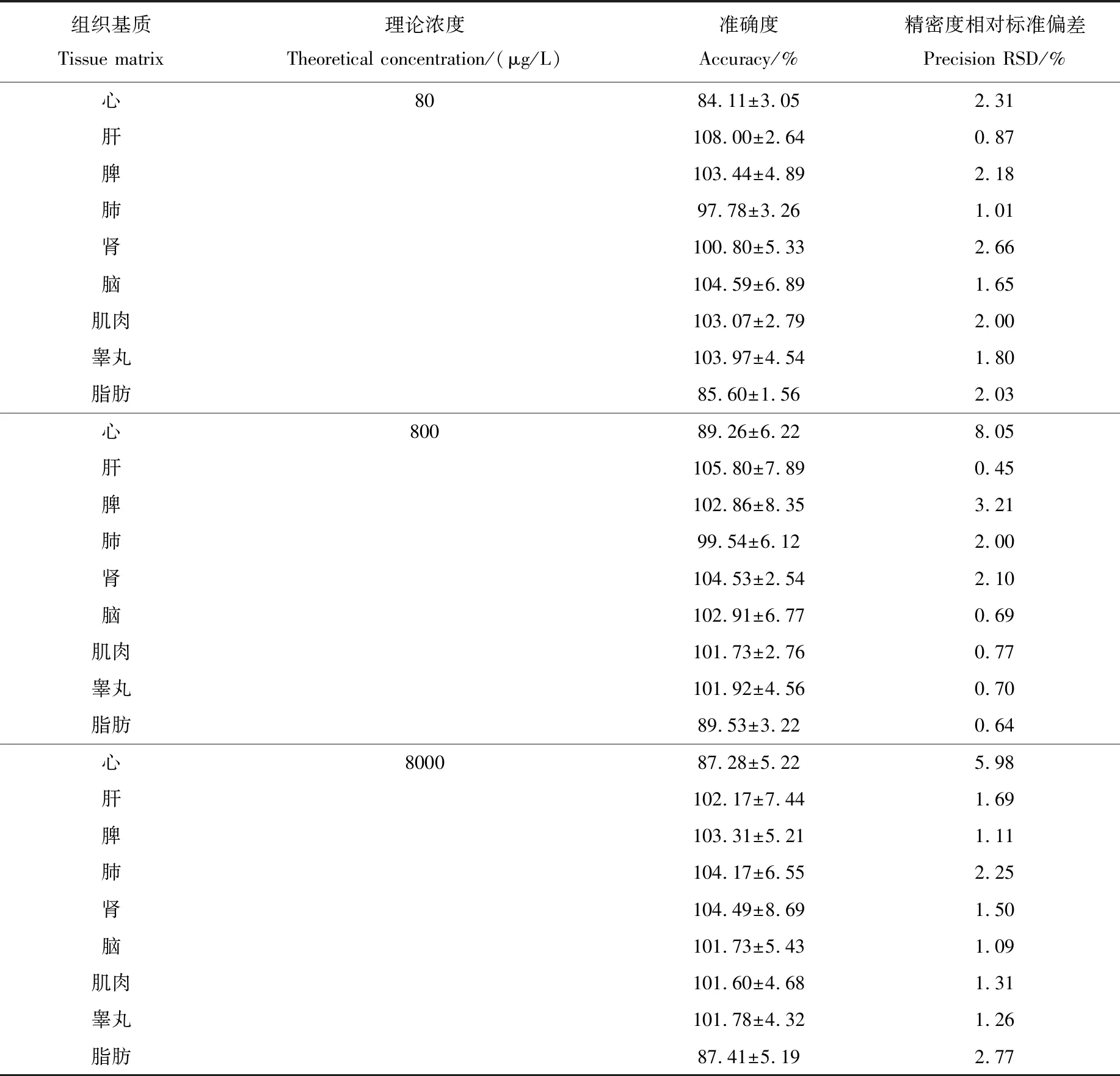
组织基质Tissue matrix理论浓度 Theoretical concentration/(μg/L)准确度Accuracy/%精密度相对标准偏差Precision RSD/%心8084.11±3.052.31肝108.00±2.640.87脾103.44±4.892.18肺97.78±3.261.01肾100.80±5.332.66脑104.59±6.891.65肌肉103.07±2.792.00睾丸103.97±4.541.80脂肪85.60±1.562.03心80089.26±6.228.05肝105.80±7.890.45脾102.86±8.353.21肺99.54±6.122.00肾104.53±2.542.10脑102.91±6.770.69肌肉101.73±2.760.77睾丸101.92±4.560.70脂肪89.53±3.220.64心800087.28±5.225.98肝102.17±7.441.69脾103.31±5.211.11肺104.17±6.552.25肾104.49±8.691.50脑101.73±5.431.09肌肉101.60±4.681.31睾丸101.78±4.321.26脂肪87.41±5.192.77

2.1.3生物样品稳定性 因组织样品采集后不能及时进行处理和分析,需考察实际操作储存条件下吡蚜酮组织样品的稳定性。配制理论浓度分别为80 μg/L和8 000 μg/L的肝组织基质样品,每个浓度配制3个平行样品,分为3组。将第1组生物样品3次冻融循环,即于-20 ℃条件下冷冻超过48 h后取出,室温解冻放置12 h,再次冷冻—解冻,共循环3次,按照1.4.4节方法处理和分析;将第2组样品于室温放置6 h,按照1.4.4节方法处理和分析;将第3组样品于-20 ℃条件下放置15天以上,室温解冻,按照1.4.4节方法处理和分析。每一组样品与新配制的LQC及HQC样品各测3个平行样,考察3组稳定性样品峰面积与新配制样品峰面积之比,结果列于表3。结果表明,稳定性样品与新配制样品的峰面积比值均在80%~120%之间,说明吡蚜酮在本研究考察的储存条件下较稳定[9]。
2.2 吡蚜酮在大鼠组织中的分布研究
分析1.4.3节获取的生物样品中吡蚜酮的浓度,得到吡蚜酮在大鼠各脏器组织中的动态分布结果[11-12],列于表4。可见,吡蚜酮在大鼠体内各脏器组织中均有分布,10 min时,肺中药物浓度最高,脾、心、肌肉和脑次之。比较不同脏器组织中药物浓度随时间的变化可以发现,脑和肌肉中药物浓度峰值出现在10 min,其他组织出现在2 h,比较各组织中药物浓度峰值,按照由高到低顺序排序为:肝>脾>心>肺>肾>肌肉>脑>睾丸>脂肪。在药物浓度达到峰值后,各脏器组织内药物浓度随时间延长逐渐下降,至144 h时,除肝内可检出少量吡蚜酮外,其他各脏器组织中均无检出。
表3 吡蚜酮在肝组织基质中的稳定性Table 3 Stability of pymetrozine in liver tissue matrix n=3)
注:表中数据=(稳定性样品峰面积/理论样品峰面积)×100%

表4 大鼠经口染毒吡蚜酮后在不同组织中的动态分布结果Table 4 Dynamic distribution of pymetrozine in rats after oral administration n=4 μg/L)
注: 以上结果表明,吡蚜酮广泛分布于大鼠全身各脏器组织中,其在组织中的分布动态变化趋势与在血浆中的变化趋势基本一致[6],并且消除较快,无蓄积倾向。同时,吡蚜酮可迅速通过血脑屏障到达脑组织,也可通过血睾屏障进入睾丸组织,但至144 h时,已消除至低于最低检测限,更进一步证明其无致畸作用[13]。 本研究采用HPLC-MS/MS法测定大鼠组织中吡蚜酮浓度,并对分析方法进行确证。结果表明,该方法准确度高、重现性好、线性范围较宽。吡蚜酮组织生物样品在不同储存条件下均较稳定,进一步证实了本研究测试条件的可靠性。 由吡蚜酮在大鼠组织中的分布结果可知,该除草剂经口染毒后,在动物组织中的浓度迅速达到峰值,随后迅速下降,至144 h已经基本完全消除,不存在蓄积倾向,因此是一种较安全的除草剂。 本研究只考察了吡蚜酮原型在大鼠体内的分布状态,尚未考察是否存在代谢产物,因此还需进一步开展深入研究。3 结论

