Sin-QuEChERS结合UPLC-MS/MS同时检测茶叶中10种有机磷农药残留
兰 韬,初 侨,郝东宇,,刘松南,席兴军,潘灿平,张维冰
(1.中国标准化研究院,北京 100191;2.齐齐哈尔大学,黑龙江 齐齐哈尔 161006;3.北京市茶叶质量监督检验站,北京 100162;4.中国农业大学,北京 100083)
茶叶是我国传统饮品,富含茶多酚、氨基酸、黄酮、茶多糖等营养物质[1],具有降低胆固醇、提高免疫力、减肥瘦身等保健功效,深受人们的喜爱。但茶叶中农药残留问题制约了我国茶叶产业的发展[2-5]。有机磷农药是一类含有磷原子的有机酯类化合物或硫羟衍生物,因其具有药效高、品种多、防治范围广、成本低、选择性好、药害小、可降解、残毒低等优点,已成为茶叶种植中广泛使用的一类农药[6-7]。目前,各类有机磷农药中毒事件频发,如日本的马拉硫磷污染食品事件[8]、印度的久效磷中毒惨案[9]等,都说明了有机磷农药的残留毒害问题日益严重,需要加大对其管控的力度。
近年来,我国对茶叶中有机磷农药残留进行了较严格的规定。如2017年实施的GB 2763—2016[10]中规定:甲胺磷等农药的限量值为0.05 mg/kg,接近大部分检测方法的极限。由于有机磷农药具有升温分解的特性,这对农残提取净化方法的准确度、灵敏度提出了更高的要求。茶叶中含有大量的茶多酚、咖啡因、叶绿素等多酚、嘌呤和色素类物质[11],具有很强的基质效应,严重影响茶叶中痕量农药残留的检测[12]。目前,茶叶中农药残留检测的样品前处理方法主要有固相萃取法[13]、固相微萃取法[14]、液-液萃取法[15]、加速溶剂萃取法[16]、基质固相分散法[17]等,这些传统方法在一定程度上能够满足基本的茶叶样品前处理需求,但操作方法以及试剂消耗还有待简化。
QuEChERS(Quick、Easy、Cheap、Effective、Safe)方法是由美国农业部Anastassiades教授于2003年开发的一种用于农产品检测的快速样品前处理技术[18]。即先将样品粉碎,然后用乙腈提取,加入无水MgSO4等盐类去除水分,再加入乙二胺-N-丙基硅烷(PSA)等吸附剂除杂后,取上清液进行检测。该方法具有简便、回收率高等优点[19],结合高灵敏的液相色谱-质谱联用法,已成为目前农药和兽药残留检测的主流方法[20-29]。
Sin-QuEChERS方法是对QuEChERS方法的改进,即采用Sin-QuEChERS净化小柱可对样品溶液实现一步净化[30],结构图示于图1。将具有较大比表面积的多壁碳纳米管与PSA、C18等固相材料及优化柱体结构相结合,制成Sin-QuEChERS小柱。将样品置于离心管后,加入乙腈涡旋振荡、离心,将Sin-QuEChERS小柱插入离心管内,按压Sin-QuEChERS小柱得上清净化液,净化液可直接进样。该方法能够改善基质干扰的去除效果,如对色素、脂类、部分糖类甾醇类等的净化效果有明显提高,色谱图干扰明显减小。与其他提取净化方法相比,具有操作简单、对杂质净化效果明显、对农药吸附少、结果准确等优点,能够极大地缩短分析时间。同时,由于该方法不涉及加热环节,非常适用于分析升温分解的有机磷农药。目前,Sin-QuEChERS前处理技术还处于起步阶段,尚未被用于药物残留(特别是有机磷农药)检测领域。
本研究拟采用Sin-QuEChERS方法结合超高效液相色谱-串联质谱(UPLC-MS/MS)法,检测茶叶中有机磷农药残留。针对茶叶样品具有较强基质效应以及有机磷农药升温易分解的特点,对Sin-QuEChERS样品前处理技术进行改进。选取GB 2763—2016中对茶叶制定了限量要求的氧化乐果(OME)、敌百虫(DIP)、甲胺磷(MET)、内吸磷(DEM)等4种有机磷农药,以及乐果(DIM)、亚胺硫磷(PHO)、马拉硫磷(MAL)、喹硫磷(QUI)、敌敌畏(DIC)、久效磷(MON)等6种容易在茶树上超范围使用的有机磷农药为研究对象,进行UPLC-MS/MS检测。希望为快速、简易、准确地评价茶叶的质量安全奠定基础。

图1 Sin-QuEChERS净化小柱结构图Fig.1 Diagram of the Sin-QuEChERS purification column
1 实验部分
1.1 主要仪器与装置
ACCELA高效液相色谱仪、TSQ Quantum Access MAX三重四极杆质谱仪:赛默飞世尔科技有限公司产品;高速万能粉碎机:天津市泰斯特仪器有限公司产品;循环水式多用真空泵:郑州长城科工贸有限公司产品;旋转蒸发器:上海亚荣生化仪器厂产品;固相萃取仪:上海汗诺仪器有限公司产品;VM200旋涡振荡仪:托摩根生物科技有限公司产品;JJ 500电子天平(感量0.01 g):常熟双杰测试仪器厂产品;Eppendorf Research移液器(量程20~200 μL):Eppendorf中国有限公司产品;Sin-QuEChERS固相萃取小柱:北京绿绵科技有限公司产品。
1.2 主要材料与试剂
空白茶叶样品(不含待检10种有机磷农药):婺源茗眉绿茶样品,由江西省出入境检验检疫局技术中心提供;乐果、氧化乐果、亚胺硫磷、马拉硫磷、喹硫磷、敌百虫、甲胺磷、内吸磷、敌敌畏和久效磷标准品:浓度均为100 mg/L,北京坛墨质检科技有限公司产品,于4 ℃冰箱保存;乙腈和甲醇:色谱纯,德国Merck公司产品;甲酸(分析纯):上海阿拉丁生化科技股份有限公司产品。
1.3 茶叶中有机磷农药残留的前处理方法
分别称取20 g各品种茶叶,经粉碎后过80目筛,装袋密封备用,于4 ℃冷藏保存。
提取方法:称取3 g(精确至0.01 g)粉碎后的茶叶粉末于50 mL离心管中,加入10 mL乙腈,旋涡振荡2 min,以5 000 r/min离心5 min。
净化方法:将Sin-QuEChERS小柱插入离心后的离心管内,按压Sin-QuEChERS小柱直至小柱内的待测液达4 mL,取小柱内的上清液过0.22 μm有机滤膜后上机检测。
1.4 溶液配制
空白基质溶液:称取3 g(精确至0.01 g)空白茶叶样品,采用Sin-QuEChERS方法对此样品进行粉碎、提取、净化,所得上清液即为空白基质溶液,将该溶液置于4 ℃冰箱保存,备用。
农药标准储备溶液:分别取100 μL乐果、氧化乐果、亚胺硫磷、马拉硫磷、喹硫磷、敌百虫、甲胺磷、内吸磷、敌敌畏和久效磷的标准品于10 mL容量瓶中,用乙腈定容至刻度线,配制1 000 μg/L的10种有机磷农药混合标准溶液,现配现用。
基质农药标准储备溶液:分别取100 μL乐果、氧化乐果、亚胺硫磷、马拉硫磷、喹硫磷、敌百虫、甲胺磷、内吸磷、敌敌畏和久效磷等标准品于10 mL容量瓶中,以空白基质溶液定容至刻度线,配制1 000 μg/L的10种有机磷农药混合标准品,现配现用。
1.5 标准曲线
用乙腈将标准储备溶液稀释成1、5、10、50、100、250、500 μg/L,经HPLC-MS/MS分析,绘制标准储备溶液的标准曲线。
用空白基质溶液将基质标准储备溶液稀释成1、5、10、50、100、250、500 μg/L,经HPLC-MS/MS分析,绘制基质标准储备溶液的标准曲线。
1.6 加标回收实验
称取3 g(精确至0.01 g)空白茶叶样品粉末,分别加入60、300、900 μL农药标准储备溶液,使粉末中农药含量分别达到20、100、300 μg/kg,按照1.3节方法,将上清液过0.22 μm有机滤膜后上机检测。
1.7 色谱条件
Zorbax SB-C18色谱柱(4.6 mm×250 mm×5 μm);柱温25 ℃;进样量10 μL;流速1.8 mL/min;流动相:A为0.1%甲酸-水溶液,B为乙腈;梯度洗脱程序:0~6 min(5%~40%B),6~9 min(40%~80%B),9~10 min(80%~100%B),10~13 min(100%B)。
1.8 质谱条件
电喷雾离子源正离子模式,多反应监测(MRM)模式扫描,雾化气为液氮,毛细管温度320 ℃,雾化气温度300 ℃,鞘气压力6 125 kPa,辅助气压力875 kPa,离子喷雾电压3 200 V,CID压力0.2 kPa。
2 结果与讨论
2.1 色谱条件的优化
本研究选用三通管路分流模式,当柱流速为1.8 mL/min时,流入质谱端的流速为0.39 mL/min,既满足了质谱仪对流速的要求,又能在保证柱压处于安全范围内的前提下,达到快速分离的目的。所以本实验选用流速1.8 mL/min。
本研究对比了乙腈-0.1%甲酸水溶液和甲醇-0.1%甲酸水溶液两种流动相体系对10种有机磷农药的分离效果,结果示于图2。在乙腈-0.1%甲酸水溶液流动相体系下,各组分出峰时间较快,峰形尖锐,10种农药组分均达到基线分离,示于图2a。而在甲醇-0.1%甲酸水溶液流动相体系下,各组分出峰时间延迟,峰展宽明显,分离度较差,示于图2b。综上,本研究选用乙腈-0.1%甲酸水溶液流动相体系进行后续实验。
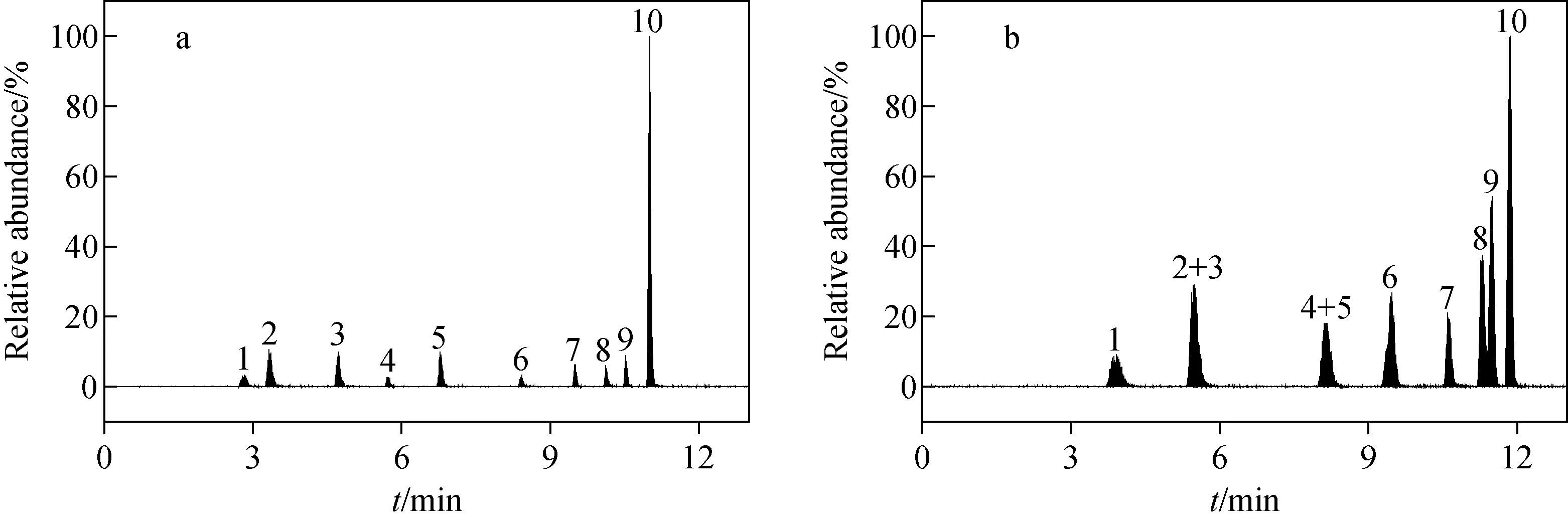
注:a.乙腈-0.1%甲酸水溶液;b.甲醇-0.1%甲酸水溶液;1.甲胺磷;2.氧化乐果;3.久效磷;4.敌百虫;5.乐果;6.敌敌畏;7.内吸磷;8.亚胺硫磷;9.马拉硫磷;10.喹硫磷图2 两种流动相体系对10种有机磷农药分离对比Fig.2 Separation and comparison of 10 kinds of organophosphorus pesticides by two mobile phase systems
本研究所涉及的其他色谱条件,如色谱柱填料、色谱柱温等均参考国家标准GB 23200.13—2016[31],其中流动相梯度洗脱程序在此标准基础上进行了微调,以满足各种农药的基线分离,具体条件参见1.7节。
2.2 质谱条件的优化
本实验向流动相中加入0.1%甲酸以提高目标物的离子化程度。校准仪器后,取农药标准品,用乙腈稀释成1 mg/L的标准溶液,经蠕动泵注入质谱仪中,选择MRM模式,并选取各农药的2对离子对,系统自动得到优化的碰撞能和套管透镜补偿电压,10种有机磷农药的质谱参数列于表1。
2.3 提取方法的优化
目前,在茶叶农残检测中,对提取方法中是否使用水存在较多争议。有研究者[32]认为,当样品含水量少于25%时,需要补充水分来增加细胞通透性,提高前处理过程中农药残留的析出。但向样品中加水易造成大量基质溶出,影响检测的准确性。国家标准GB 23200.13—2016《食品安全国家标准茶叶中448种农药及相关化学品残留量的测定 液相色谱-质谱法》[31]和AOAC发布的食品中农药残留检测方法[33],均直接通过乙腈提取样品。另外,庞国芳等[34]通过比对16个实验室的检测结果,证实茶叶中农药残留提取无需加水。为验证提取样品过程是否需要加水,本研究基于Sin-QuEChERS方法,分别考察了样品加水和不加水的提取效果。选取加标水平均为300 μg/L的10种有机磷混合标准品,第一组为不加水,以10 mL乙腈提取;第二组为加水提取,当加入5 mL水时,不足以浸润3 g茶叶样品,当加入10 mL水时,会稀释样品,所以,选择加入7 mL水和10 mL乙腈作为提取溶剂。两组的后续净化方法一致,回收率列于表2。
由表2可见,是否加水对方法回收率的影响显著,不加水与加水提取的回收率分别为71.6%~99.6%、47.5%~116.9%,且不加水提取3次测试结果的相对标准偏差(RSD)明显优于加水提取。

表1 10种有机磷农药的质谱参数Table 1 Mass spectrometric parameters of 10 organophosphorus pesticides
注:*表示定量离子对

表2 加水和不加水提取的回收率对比Table 2 Comparison of recoveries of Sin-QuEChERS method with water extraction and without water extraction
以滇红茶一等品为例,按照Sin-QuEChERS的提取方法对茶叶进行提取,比较加水与不加水提取时的溶液颜色。结果表明,加水提取的上层清液颜色明显比不加水提取的颜色深,说明加水提取后大量色素类物质溶出,其基质影响明显高于不加水提取,不利于后续的净化过程,造成提取回收率较差,所以本实验采用不加水提取的方法。
2.4 基质效应
在实际农药残留检测中,当存在基质效应时,使用纯溶剂标准曲线进行校准,常会引起分析结果偏差和样品回收率的错误计算。对基质效应不明显的化合物,基质标准曲线与溶剂标准曲线基本重合。本研究通过对比不含基质的标准工作溶液标准曲线(A)和含基质(浓度3 g/mL)的标准工作溶液标准曲线(B)的斜率,以表征10种有机磷农药的基质效应,结果列于表3。结果表明,敌敌畏、喹硫磷、马拉硫磷、内吸磷、乐果等5种农药的基质效应不明显,敌百虫、甲胺磷、亚胺硫磷等3种农药存在明显的基质减弱效应,氧化乐果存在一定的基质增强效应,久效磷的基质增强效应非常明显。鉴于部分农药存在较明显的基质效应,后续均需基于基质溶液进行实验。

表3 10种有机磷农药的基质效应对比Table 3 Comparison of matrix effect on 10 organophosphorus pesticides
2.5 方法的线性范围、灵敏度、检出限、定量限
10种有机磷农药的线性方程、线性范围、检出限、定量限列于表4。10种有机磷农药3次检测的线性范围均为1~500 μg/L,峰面积与样品浓度之间的线性关系良好,线性相关系数在0.999 4~1.000 0之间。以定量离子对的3倍信噪比(S/N)确定方法的检出限(LOD)为0.08~1.38 μg/kg,以定量离子对的10 倍信噪比(S/N)确定方法的定量限(LOQ)为0.27~4.60 μg/kg。
2.6 方法的回收率与精密度
为验证方法的可靠性,本研究对空白茶叶样品进行加标回收实验,加标水平分别为20、100和300 μg/kg的混合标准品,每个加标水平做5次平行实验,方法回收率和精密度列于表5。加标水平为20、100、300 μg/kg时,10种农药的平均回收率为77.6%~110.7%、74.6%~108.4%、71.6%~99.6%,RSD分别小于13.6%、11.9%、14.5%。该结果表明,本研究建立的Sin-QuEChERS方法在不同加标水平下,平均回收率均处于71.6%~115.0%之间,RSD小于14.5%,具有较高的回收率和良好的精密度,能够满足多种茶叶农残检测的要求。

表4 10种有机磷农药的线性方程和线性范围(n=3)Table 4 Linear equations, linear ranges for 10 organophosphorus pesticides (n=3)

表5 方法的回收率(n=5)Table 5 Recoveries of the method for adding pesticides (n=5)
2.7 Sin-QuEChERS方法与国家标准方法的比较
以绿茶为例,将国家标准方法GB 23200.13—2016[31](敌敌畏参照SN/T 1950—2007行业标准[35])中的10种有机磷农药的回收率作为理论数值,考察Sin-QuEChERS方法的回收率,结果列于表6。结果表明,Sin-QuEChERS方法的回收率在71.6%~115.0%之间,国家标准方法的回收率在60.9%~118.5%之间,二者的回收率差异较小。在国家标准方法中,每个样品需要增加旋转蒸发步骤,整个样品前处理时间一般需要约1.5 h。而在本研究中,Sin-QuEChERS方法的样品前处理仅需10 min,可在0.5 h内完成1个样品检测。该方法既保证了实验结果的稳定性,又大大提升了检测效率。另外,Sin-QuEChERS方法提供了久效磷的回收率范围,可为标准方法提供补充。

表6 Sin-QuEChERS 方法和国家标准方法对10种有机磷农药回收率的对比Table 6 Comparison of recoveries of 10 pesticeids between Sin-QuEChERS and the national standards
2.8 实际样品检测
采用本研究建立的Sin-QuEChERS结合HPLC-MS/MS方法,检测市售的黄山毛峰、碧螺春、龙井茶、祁门红茶、滇红茶、正山小种红茶、白毫银针、白牡丹、安吉白茶、安化黑茶一等品和二等品共20种茶叶中的10种有机磷农药,结果列于表7。

表7 20种茶叶样品中有机磷农药的检测结果Table 7 Detection results of organophosphorus pesticides in 20 kinds of tea
注:—表示未检出
由表7可见,市售茶叶中有机磷农药的检出量较少,均低于欧盟标准中最高0.010 mg/kg的限量要求,说明我国对于茶叶中有机磷农药的管控较严格。
3 结论
本研究针对茶叶样品具有较强的基质效应以及有机磷农药升温易分解的特点,对Sin-QuEChERS样品前处理技术进行改进,并结合UPLC-MS/MS技术建立了同时检测茶叶中10种有机磷农药残留的方法。在优化的Sin-QuEChERS方法条件和UPLC-MS/MS检测条件下,样品前处理时间可控制在10 min以内,每个样品能够在0.5 h内完成分析。10种有机磷农药的线性范围为1~500 μg/L,检出限为0.08~1.38 μg/kg,定量限为0.27~4.60 μg/kg。在不同的加标水平下,平均回收率均在71.6%~115.0%之间,RSD小于14.5%,具有较高的回收率和良好的精密度。与传统样品预处理方法相比,本方法在保证了方法的灵敏度、精密度和普适性的基础上,极大地提升了方法的易用性和分析效率。将该方法应用于空白茶叶样品加标分析和20种市售茶叶中有机磷农药的检测,证明了方法的可行性。该方法能够为快速、简易和准确地检测茶叶中多种有机磷农药残留提供新途径。

