NG108-15细胞系作为小鼠神经内分泌细胞模型的适合性
夏九成 龙廷 秦达念
(1攀枝花学院生物与化学工程学院,四川 攀枝花 617000;2汕头大学医学院生理教研室)
神经系统与内分泌系统之间存在紧密联系,而下丘脑在整个神经内分泌系统中处于核心地位〔1〕。随着年龄的增长,生物各部分功能出现衰退,下丘脑的神经内分泌功能发生紊乱,可诱发机体能量代谢失衡、肥胖、自主神经功能混乱、高血糖、高血压、胰岛素抵抗和性功能勃起障碍等多种代谢综合征;同时糖尿病(高血糖)、高血压和高脂血症等常见的老年疾病所产生的炎症因子又会反过来作用于下丘脑细胞,加重中枢神经内分泌系统功能的失调,推动衰老的不可逆发展〔2,3〕。利用大鼠、小鼠等下丘脑原代细胞作为的神经内分泌失调研究的细胞体外模型是目前研究热点之一〔4〕。但由于原代细胞培养复杂、耗时且细胞均质性差。所以用恰当的细胞株系代替原代细胞作为神经元的研究模型是一个不错的选择〔5~8〕。NG108-15细胞是一个由小鼠神经母细胞瘤与大鼠神经胶质瘤细胞杂交后获得细胞系。在其分化后,细胞可以形成类似于神经突触的突起。因此,许多研究均采用NG108-15细胞系作为研究神经元功能的重要细胞模型〔9,10〕。然而由于其杂合性,因此很难确定其细胞的神经内分泌特性是偏向于小鼠还是大鼠,从而给相关的细胞分子生物学研究带来困难。为了使细胞试验与动物试验结果吻合,提高研究结果的价值。本研究设计了两组分别来自大鼠和小鼠神经内分泌基因的引物序列来分析基因表达的特性,以确定该细胞系的适合性。
1 材料与方法
1.1试验试剂与材料 NG108-15细胞系(汕头大学医学院生理教研室),新生大鼠(汕头大学医学院试验动物中心,合格证号No.20170803),新生小鼠(汕头大学医学院试验动物中心,合格证号No.20170803),DMEM培养基、胎牛血清、双抗(青霉素+链霉素,Gibco),双丁酰环磷酸腺苷(dc-AMP,Sigma),胰酶,神经元专用培养基(neurobasal medium),B27,L-谷氨酸,阿糖胞苷(Sigma),磷酸盐缓冲液(PBS)缓冲液,RNA提取试剂盒(Takara),RNA逆转录试剂盒(Takara),SYBR荧光定量PCR试剂盒(Takara),琼脂糖,溴化乙锭。
1.2方法
1.2.1NG108-15细胞的分化培养 将NG108-15细胞按1×104个/ml密度接种到直径为35 mm的细胞培养板上,加入1 ml DMEM培养基进行培养。培养2 d后,加入含1 mmol/L双丁酰环磷酸腺苷的DMEM培养基进行分化培养。此后每隔3 d换液1次,7 d后待细胞完全分化出细胞突触后,收集所培养细胞待用。
1.2.2原代细胞的培养 分别将刚出生的小鼠和大鼠带回实验室,用解剖工具在低温无菌条件下快速取出下丘脑组织,并用胰酶在37℃下将下丘脑组织消化为单细胞悬液。将此细胞悬液按1×104个/ml密度接种到直径为35 mm的细胞培养板上,加入1 ml含B27的neurobasal medium培养基进行培养,培养第2天加入含阿糖胞苷的培养基进行培养48 h后,换回含B27的neurobasal medium培养基继续进行培养,此后每3天换液1次,直到第7天原代细胞培养成熟,收集所培养的原代细胞待用。
1.2.3逆转录PCR 将上述收集的各组细胞,先用PBS进行清洗,然后各加入0.5 ml RNA提取试剂进行总RNA的提取,并用50 μl双蒸水溶解所提取RNA后,放于-70℃冰箱保存待用。每组取7 μl总RNA按照逆转录试剂盒的操作要求,将其逆转录为20 μl的cDNA,并放于20℃保存待用。每组取1 μl cDNA,按照SYBR荧光定量PCR试剂盒的操作要求,在ABI7500上进行PCR扩增和检测分析。扩增产物,进一步通过琼脂糖电泳进行成像分析。PCR反应引物系列见表1,其中β-actin为内参基因,其余的瘦素受体基因(lepr)、前阿黑皮素原基因(pomc)、神经肽Y基因(npy)和刺鼠相关蛋白基因(agrp)均与下丘脑的神经内分泌相关。
1.3统计学方法 应用SPSS22.0软件行t检验、χ2检验。

表1 荧光定量PCR的引物序列
2 结 果
2.1细胞形态 NG108-15细胞,大鼠及小鼠的下丘脑原代培养细胞在按各自的培养条件培养7 d后的结果见图1。从图1可以看出三类细胞均有神经元的突触分化,但NG108-15细胞体积较大,成分散生长。大鼠和小鼠的原代培养细胞,则体积较小,细胞成簇生长,细胞间有明显的突触联系。
2.2两组引物的PCR扩增结果 利用由大鼠基因设计的引物序列,检测NG108-15细胞和大鼠原代细胞的基因扩增效率,结果见表2和图2A。内参基因β-actin的扩增在两组细胞内扩增正常且无差异,说明两组细胞的起始模板量相等。但剩余的所有基因却只能在大鼠原代细胞中正常扩增,而在NG108-15细胞却扩增失败。利用小鼠基因设计的引物序列,检测NG108-15细胞和小鼠原代细胞的基因扩增效率,结果见表3和图2B。所有基因能在NG108-15细胞和小鼠原代细胞中进行扩增,且扩增效率差异无统计学意义(P>0.05)。
利用小鼠和大鼠的两组引物序列,同时检测NG108-15细胞的基因扩增效率,结果见表4和图3。所有来自小鼠的引物序列扩增正常,而来自大鼠的引物序列则除了内参基因β-actin 扩增正常外,其他均扩增失败或扩增效率低下。
从以上结果可以看出,尽管NG108-15细胞是由大鼠胶质瘤细胞与小鼠神经母细胞通过细胞融合所得的杂交瘤细胞株系,但其有关神经内分泌有关的细胞分子生物学特性则更多的与小鼠原代细胞相近而与大鼠的差异较远。

图1 各组细胞的形态(×100)
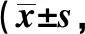
表2 大鼠基因设计的PCR引物序列在NG108-15细胞与大鼠下丘脑原代细胞中的荧光定量PCR结果次,n=3)
UD*为无法检测;表4同
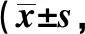
表3 小鼠基因设计的PCR引物序列在NG108-15细胞与小鼠下丘脑原代细胞中的荧光定量PCR结果次,n=3)

A:由大鼠基因设计的PCR引物(β-actin,lepr,pomc,npy,agrp)在大鼠下丘脑原代细胞和NG108-15细胞中的PCR扩增结果,第1泳道为DNA分子标记,其余奇数泳道为大鼠下丘脑原代细胞,偶数泳道为NG108-15细胞;B:由小鼠基因设计的PCR引物(β-actin,lepr,pomc,npy,agrp)在小鼠下丘脑原代细胞和NG108-15细胞中的PCR扩增结果,第1泳道为DNA分子标记,其余奇数泳道为小鼠下丘脑原代细胞,偶数泳道为NG108-15细胞图2 由大、小鼠基因设计的PCR引物
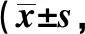
表4 由小鼠基因和大鼠设计两组PCR引物在NG108-15细胞中的荧光定量PCR结果次,n=3)

第1泳道为DNA分子标记,其余奇数泳道为依据小鼠基因设计的引物序列,偶数泳道为依据大鼠基因设计的引物序图3 大鼠与小鼠基因的引物序列
3 讨 论
新分离的原代神经细胞是研究神经元生理及病理变化功能的最佳选择。但存在的缺点主要是细胞分离培养复杂耗时,细胞死亡率较高,细胞存在异质性。细胞系则具有培养方法简单高效,均质性好等优点。因此,细胞系是研究细胞功能的理想工具。NG108-15细胞系是一个重要的神经细胞模型〔11,12〕。NG108-15细胞系可用于研究神经细胞的离子通道、膜受体和神经递质等生理生化特性。张柱霞等〔13〕研究了5-氮-2′脱氧胞苷对神经细胞系NG108-15细胞周期的作用及相关机制,发现5-aza-cdR可以抑制NG08-15细胞的增殖,其抑制作用可能是通过降低DNMT1表达实现的。
双丁酰环磷酸腺苷可以刺激NG108-15细胞分化,比如细胞直径和神经突起增长。许多研究均采用分化的NG108-15细胞作为研究神经元离子通道和膜受体的重要工具〔14,15〕。但是很少有人考虑该杂合细胞的生化特性是偏向于大鼠还是小鼠细胞特性。本研究结果发现,在多个与神经内分泌相关基因的表达研究方面,该细胞系更适合为小鼠的体外细胞研究模型。由此可以看出若要将NG108-15细胞系作为神经内分泌失调研究的体外模型,其研究结果更适合与小鼠动物试验相结合。

