运用数据挖掘和网络药理学探讨肝衰竭用药规律及机制分析
吕建林,柳琳琳,张文富,王光耀,胡振斌,毛德文*
(1.广西中医药大学第一附属医院, 广西南宁530023; 2.广西中医药大学, 广西南宁530001)
肝衰竭(liver failure,LF)是临床常见的多种因素形成的肝功能严重障碍性疾病,具有极高病死率[1]。由于形成LF病因较多,如肝炎病毒、药物(肝毒性物质)、胆道疾病及代谢异常等多因素均可引起LF,一旦发病即出现一系列如黄疸、腹水、肝性脑病等临床症候群,现代医学对LF的治疗多为对症治疗,尚未有特效药物[2]。根据LF症状体征,多属中医急黄、臌胀及黄疸等范畴。随着各代中医家对LF的病因认识与治疗,逐步形成解毒化瘀、补阳祛瘀解毒、清热祛湿解毒等治法[3-5]。因此运用现代技术挖掘现有各代中医家治疗LF的文献资料,得出治疗LF的用药规律,同时结合网络药理学从微观层面分析所得组方用药核心药团的作用机制,有助于发现中医处方药物配伍的潜在机制,以期为LF的临床及实验研究作出贡献。
1 数据与方法
1.1 数据(处方)来源
以“肝衰竭”、“中医治疗”、“中药治疗”、“中医药治疗”、“中医”、“中药”、“中医药”、“liver failure”, “LF”,“traditional Chinese medicine treatment”, “traditional Chinese medicine”, “traditional Chinese medicine”, “traditional Chinese medicine”等为主题词,检索PubMed、Embase、Cochrane Library、中国知网(CNKI)、中国生物医学文献数据库(CBM)、万方(WanFang)和维普(VIP)数据库所有与肝衰竭相关的文献。
1.2 纳入标准
运用中药处方治疗LF的临床研究,明确提供中医大家配伍用药经验及全部中药处方组成的期刊文献。
1.3 排除标准
排除基础研究及非临床研究,排除中西医结合治疗LF的临床研究,排除重复中药处方及无具体中药处方的期刊文献。
1.4 数据处理
经筛选后得154篇期刊文献,154剂/张临床中药处方数据,参考《中药大辞典》和《中药学》(十二五教材)对所得处方用药名称、功能分类进行统一规范整理,遵循客观原则进行信息提取,将所得数据使用 Excel软件建立“肝衰竭(LF)处方用药”数据库,通过二分类变量形式录入处方用药信息,为确保处方用药信息录入准确无误,数据的录入以数据员1及数据员2交叉核对的形式进行。
1.5 数据分析
1.5.1 数据挖掘分析
运用Excel软件对数据进行频数统计;SPSS Modeler对数据进行关联规则分析,获得治疗肝衰竭(LF)核心药团;SPSS Statistics对数据进行因子分析。
1.5.2 网络药理分析
在TCMSP、 SymMap、TCM-ID数据库平台检索肝衰竭(LF)核心药团的所有化学成分,根据口服生物利用度(oralbioavailability,OB)≥30 %及类药性(drug—likeness,DL)≥0.18的药物筛选标准选取药物活性成分;通过Pharmmapper数据库筛除重复靶点,并将肝衰竭(LF)核心药团的化合物潜在靶点上传至UniProt数据库中筛选物种为“Homo sapiens”的靶点作为核心药团作用于肝衰竭(LF)的有效作用靶点;将所得肝衰竭(LF)核心药团潜在靶点信息上传STRING获得蛋白互作网络图;根据STRING数据库上所获得的数据导入Cytoscape 软件进行可视化分析,并行拓扑学网络分析和评估节点在全网络中的重要程度;筛选TTD、Genecards数据库综合得出肝衰竭(LF)相关靶点,利用Venn分析工具,将两者与肝衰竭(LF)核心药团潜在靶点进行比对分析;筛选David数据库,对核心药团对肝衰竭(LF)的作用靶点进行GO及KEGG分析,且利用“富集因子=目标基因集中属于该通路的基因数量/背景基因集中该通路所有基因的数量”计算出富集因子,最后绘制气泡图。
2 数据挖掘方面
2.1 用药频次统计
将所纳入期刊文献中154首临床处方的全部中药按降序排列,共有186种中药,累计出现8 040次。在154首临床处方中,使用频次≥20次的中药共有20种,累计频率3 060次,包含有清热药(兼凉血、解毒、燥湿、泻火)6味,利湿药(兼退黄、消肿)5味,补气药3味,活血化瘀药2味,温里药1味,泻下药1味,解表药1味,开窍药1味。使用频次最多的前10味中药分别是茵陈(119次)、赤芍(94次)、大黄(87次)、栀子(59次)、丹参(59次)、茯苓(57次)、白术(51次)、郁金(42次)、甘草(42次)及虎杖(38次)。使用频次≥20次的中药见表1。
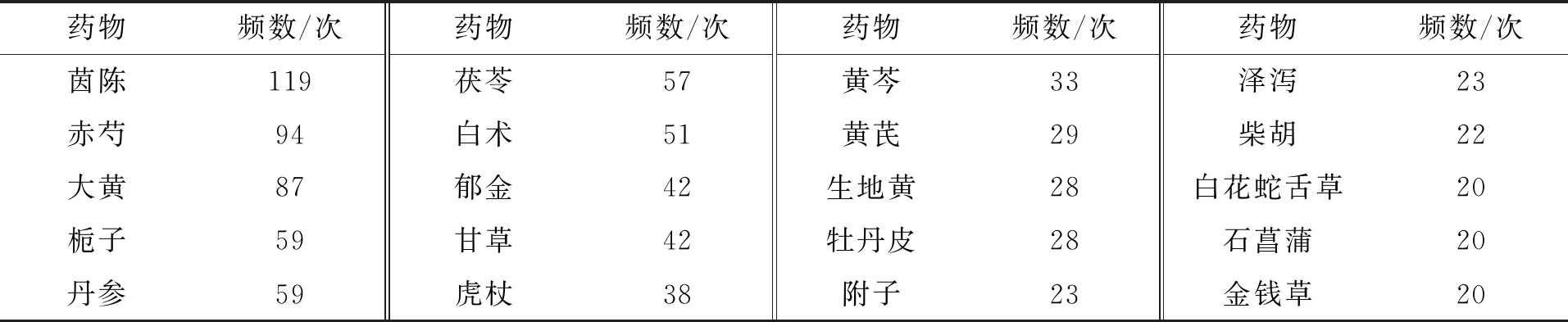
表1 中药用药频次1Tab.1 Frequency of Chinese medicine
注1:频次≥20次。
2.2 高频中药关联分析
高频中药关联通过SPSS Modeler软件运用Aprioi算法对高频中药(频次≥20次)进行关联分析,设置前项数为5,最低条件支持度为10 %,最小规则置信度为100 %,共得到10个高频中药组合,其中支持度最高的肝衰竭(LF)核心药团(13.725 %)是茵陈→白术→大黄,所得高频中药组合的提升度均>1 %,均具有统计学意义。高频中药关联组合见表2,高频中药间关联网络见图1。
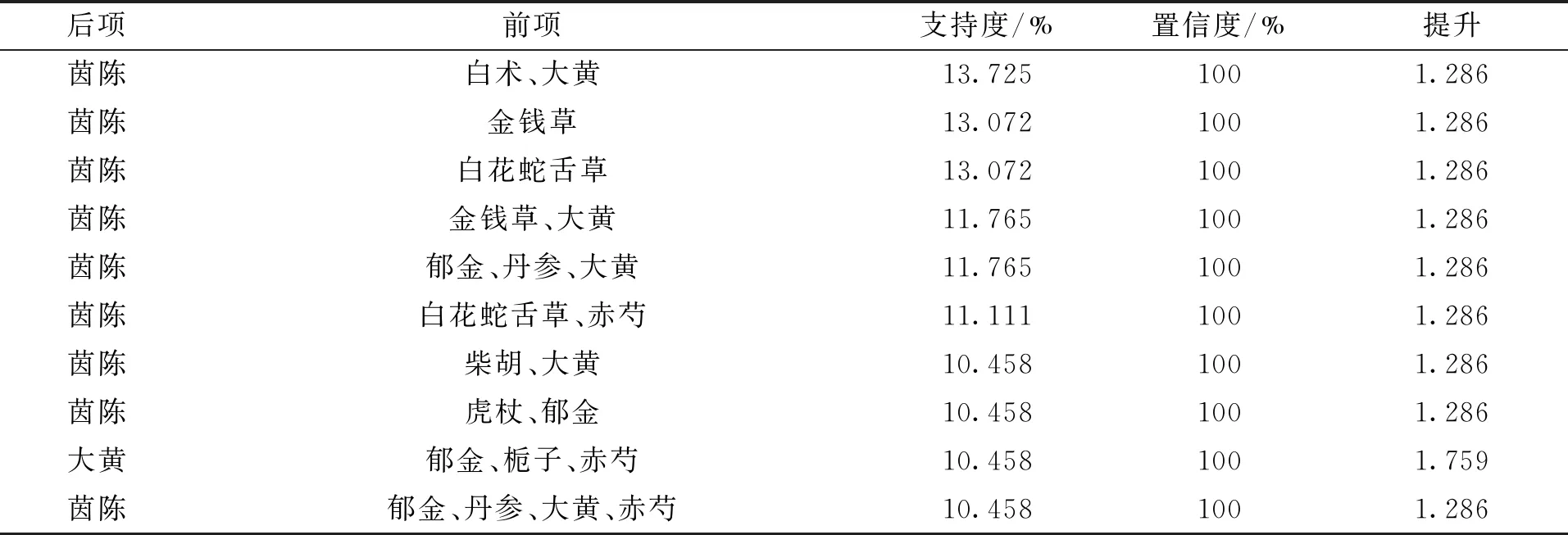
表2 高频中药关联分析Tab.2 Analysis of association rules of high frequency Chinese medicine
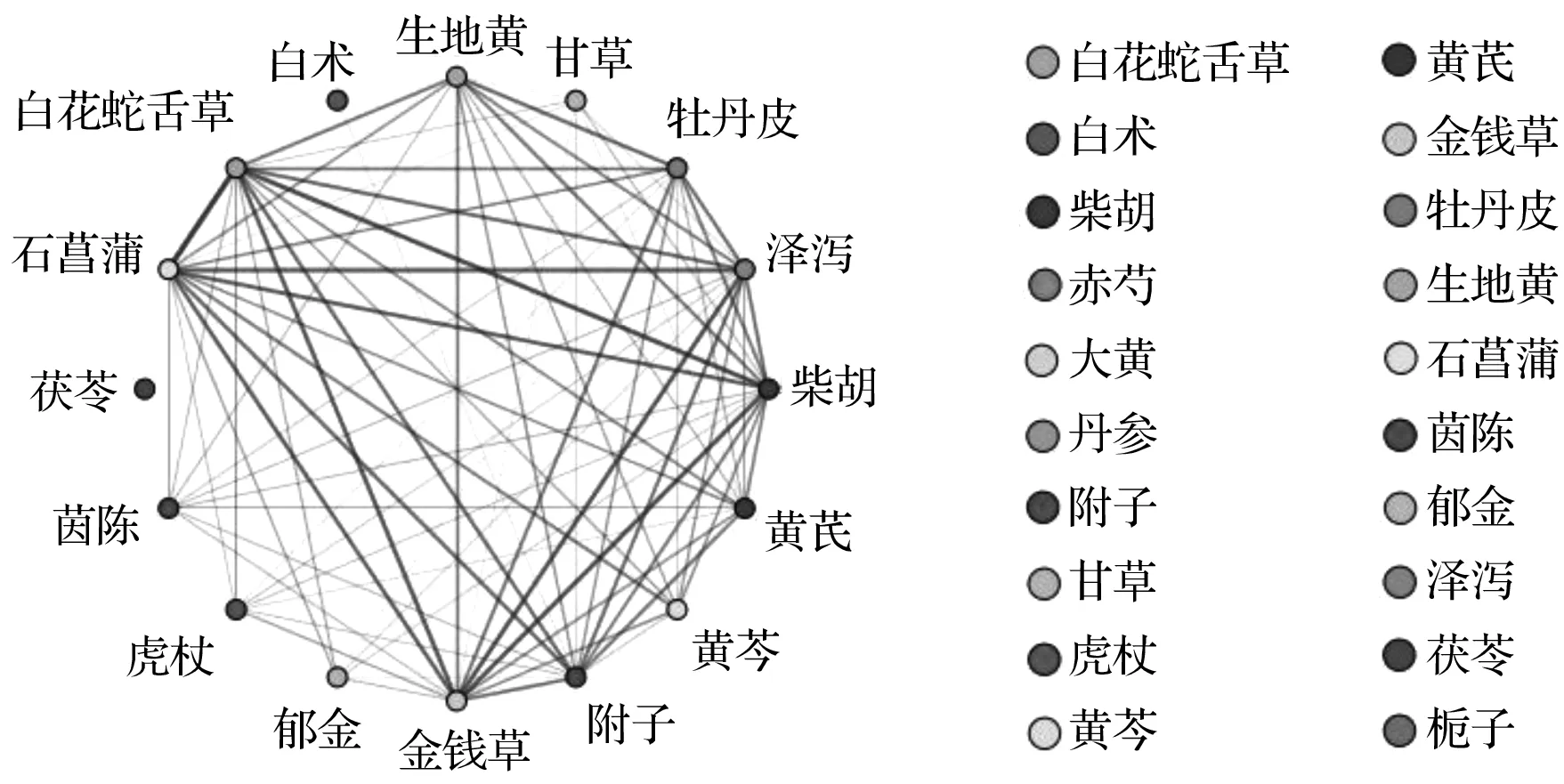
图1 高频中药间关联网络
Fig.1 Association network display between high frequency Chinese medicine
2.3 高频中药因子分析
对高频中药(频次≥20)运用SPSS Statistic进行因子分析,统计得出KMO量数为0.538,巴特利特检验中,P=0.000,提示因子分析可行。取初始值大于1的成分共有8个,因子累计贡献率为64.546 %,显示该因子分析结果可包涵大部分信息,使用全体旋转法得出旋转矩阵成分图(图2)。将中药归于因子贡献率最高的公因子中,可得8个公因子,具体见表3。
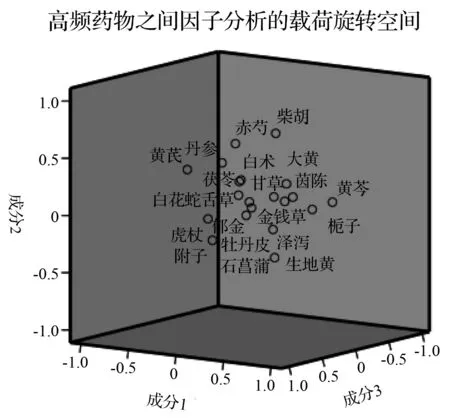
图2 因子分析成分图Fig.2 Factor analysis composition diagram
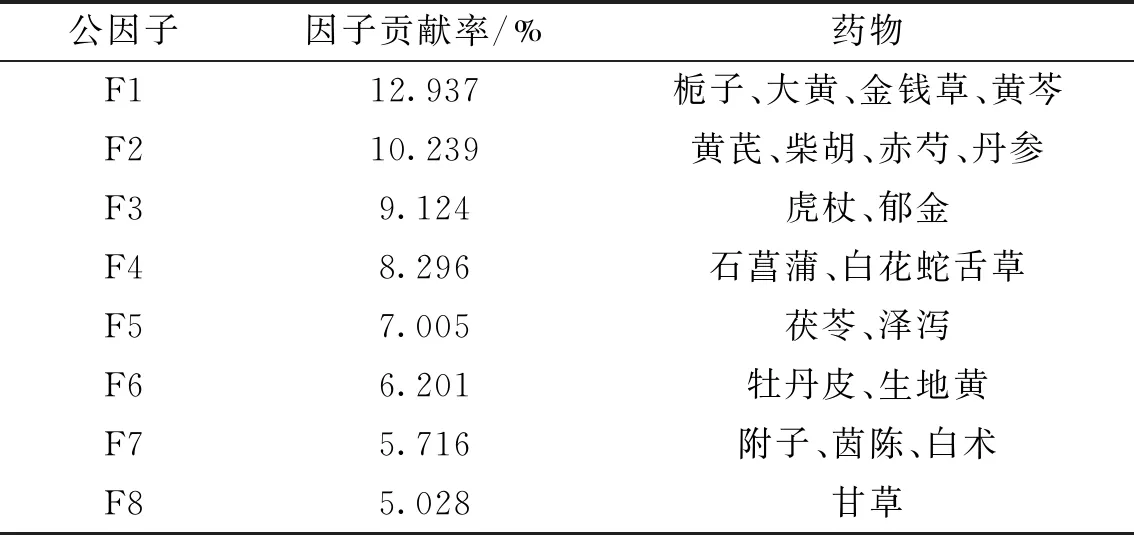
表3 高频中药因子分析信息表Tab.3 High frequency Chinese medicine factor analysis information table
3 网络药理方面
3.1 LF核心药团化学成分
检索TCMSP、 SymMap、TCM-ID数据库获取LF核心药团(茵陈→白术→大黄)化学成分,共获取200个化合物,其中茵陈53个、白术55个、大黄92个。根据口服利用度(OB≥30 %)及药物相似性(DL≥0.18)筛选得出茵陈13个、白术7个、大黄16个。化合物包含有芦荟大黄素(aloe-emodin)、毛细血管素(capillarisin)、异鼠李素(isorhamnetin)等,LF核心药团各个有效成分的OB、DL值见表4。
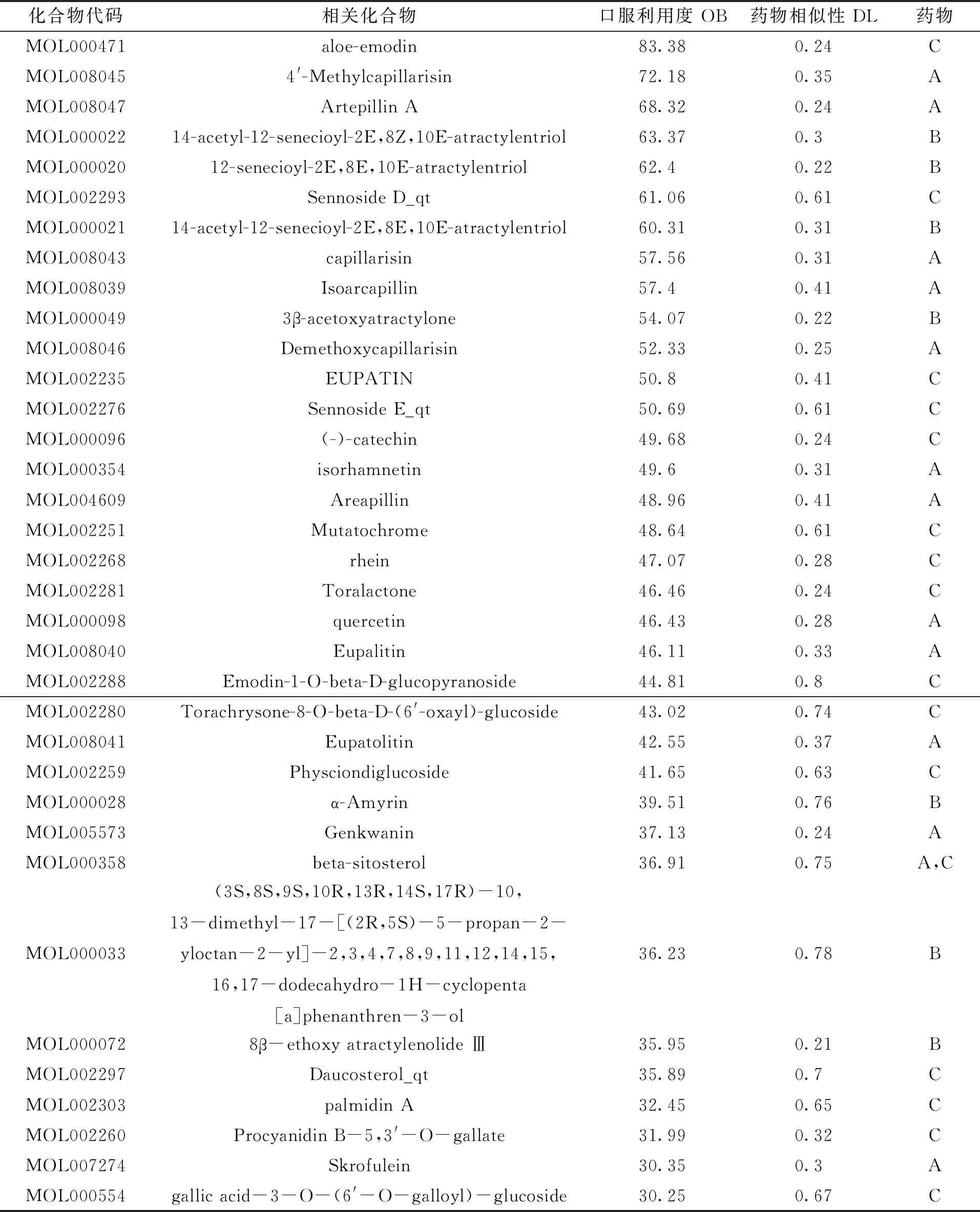
表4 LF核心药团化学成分1Tab.4 LF core drug group chemical composition table
注1:根据OB值降序排列。A:茵陈;B:白术;C:大黄。
3.2 LF核心药团化学成分潜在靶点及相互作用
根据匹配度将获得的潜在靶点进行降序排列,选取LF核心药团化学成分的前十个蛋白进行下一步研究,共得350个。剔除相同的靶点后,最终得到102个靶点。包括PTGS2、HSP90AA1、DPP4、NCOA2、PTGS1等靶点。其中网络度数值越大,提示核心药团通过该靶点治疗LF的可能性越大,具体参数见表5,靶点相互作用关系图见图 3。
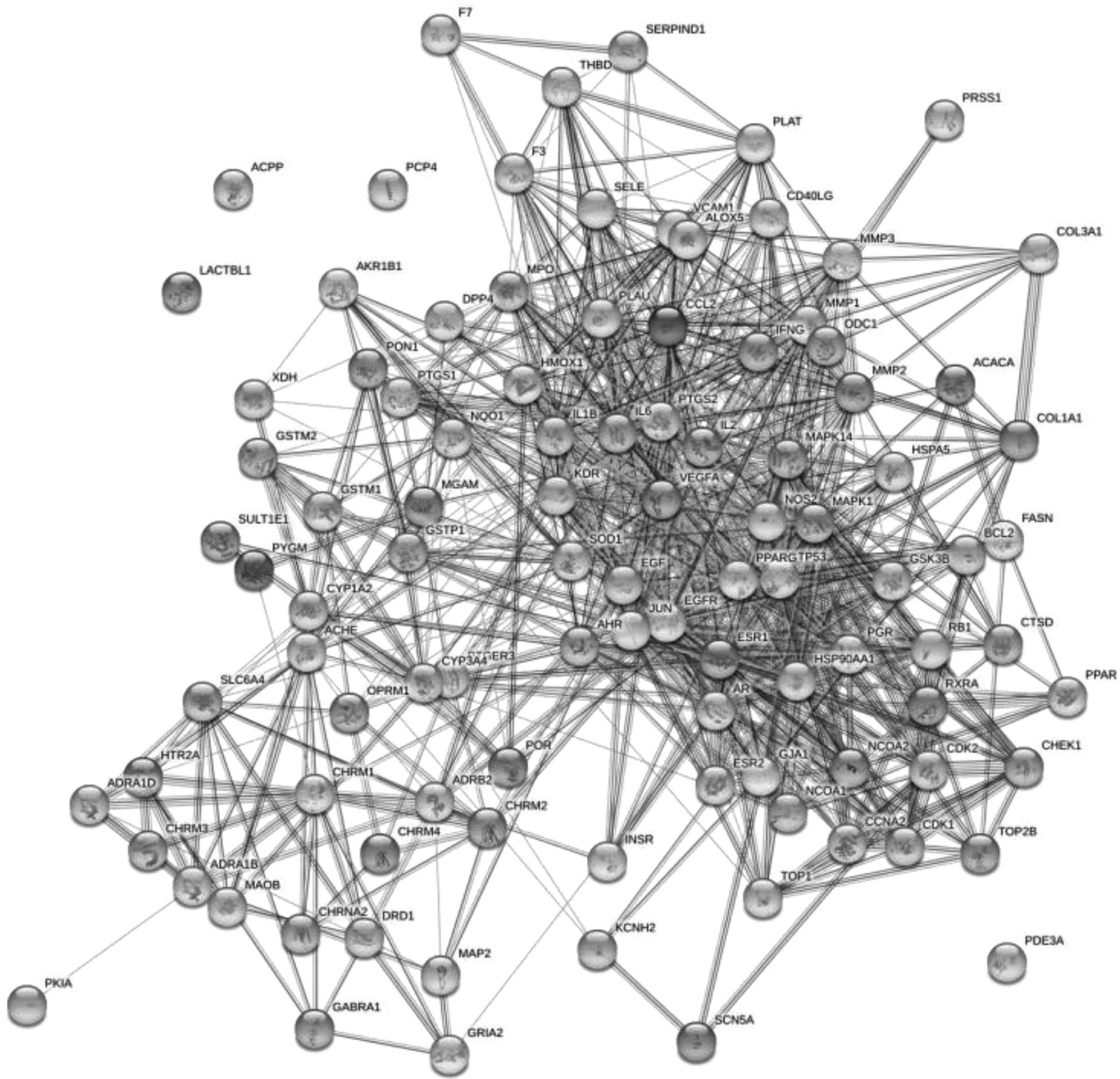
图3 核心药团蛋白互作网络图Fig.3 Protein interaction network diagram of core drug group
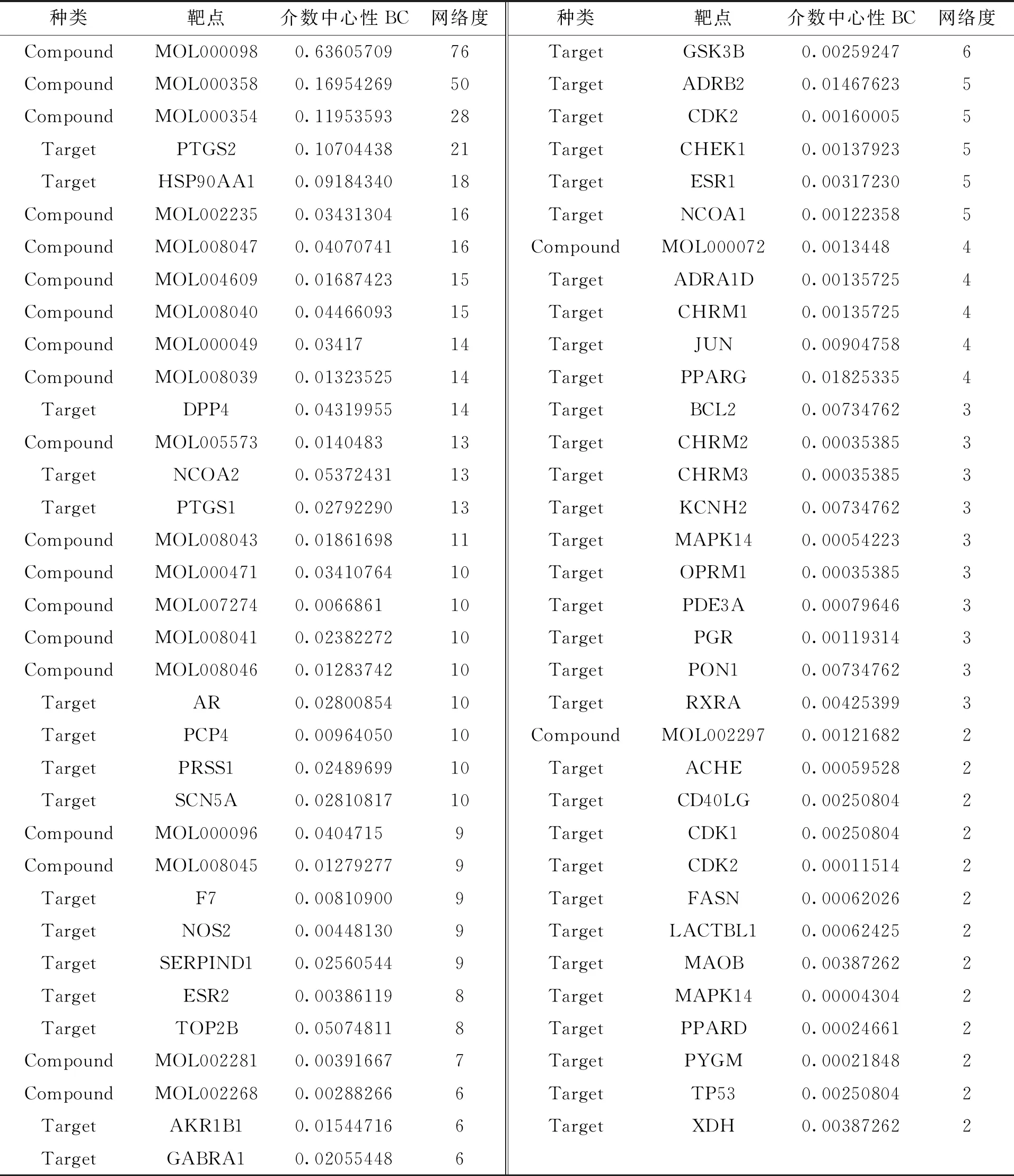
表5 核心药团化学成分化学成分—作用靶点参数Tab.5 Chemical composition-target parameters of core pellets
3.3 LF相关靶点数据构建及比对分析
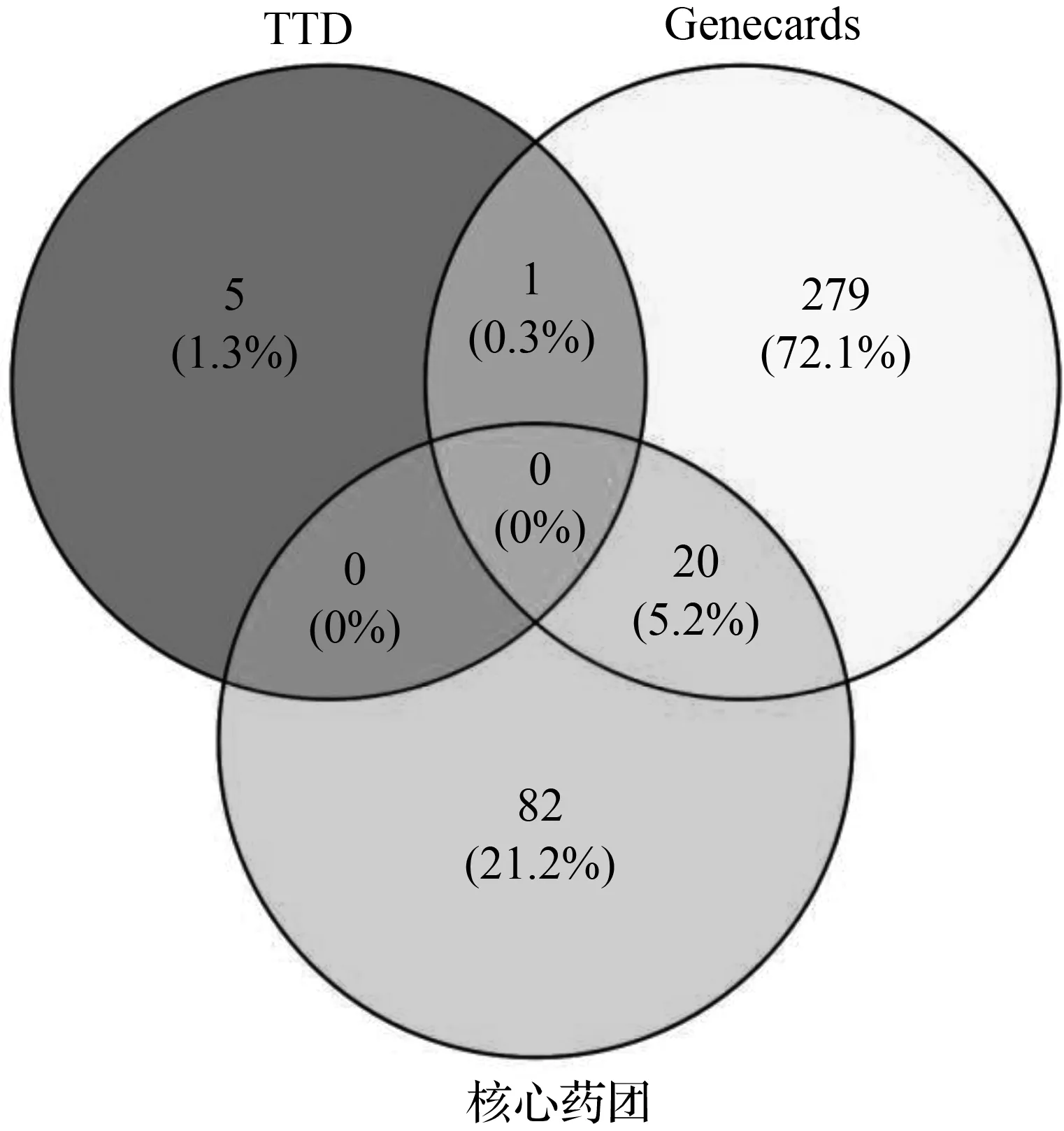
图4 核心药团作用靶点与LF靶点的韦恩图Fig.4 Venn diagram of core drug group target and LF target
查询TTD数据库,获得6个经实验及临床试验的药物治疗性靶点,其中有0个与核心药团的潜在靶点重合;初步筛选Genecards数据库得出1 438个候选基因,依据“Relevance score”度取相关度最高的前300个结果,与核心药团(茵陈→白术→大黄)靶点重合的有20个。通过合并数据库法查询后,共筛选出305个LF高度相关性靶点,与核心药团(茵陈→白术→大黄)有20个重叠靶点,所得韦恩图见图4。
3.4 核心药团主要活性成分对LF作用靶点的生物信息学分析
通过David数据库进行GO分析,富集出28个生物学过程,其中包含一氧化氮生物合成过程的正调控(positive regulation of nitric oxide biosynthetic process)、胶原分解代谢过程(collagen catabolic process)、细胞外基质拆卸(extracellular matrix disassembly)、蛋白激酶B信号转导的正调控(positive regulation of protein kinase B signaling)等。4个细胞组成,其中包括细胞外空间(extracellular space)、细胞外区域(extracellular region)、蛋白质性细胞外基质(proteinaceous extracellular matrix)、细胞外基质(extracellular matrix)等。以及12个分子功能,丝氨酸型内肽酶活性(serine-type endopeptidase activity)、酶结合(enzyme binding)、咖啡因氧化酶活性(caffeine oxidase activity)、金属内肽酶活性(metalloendopeptidase activity)等。具体相关分类见图5。
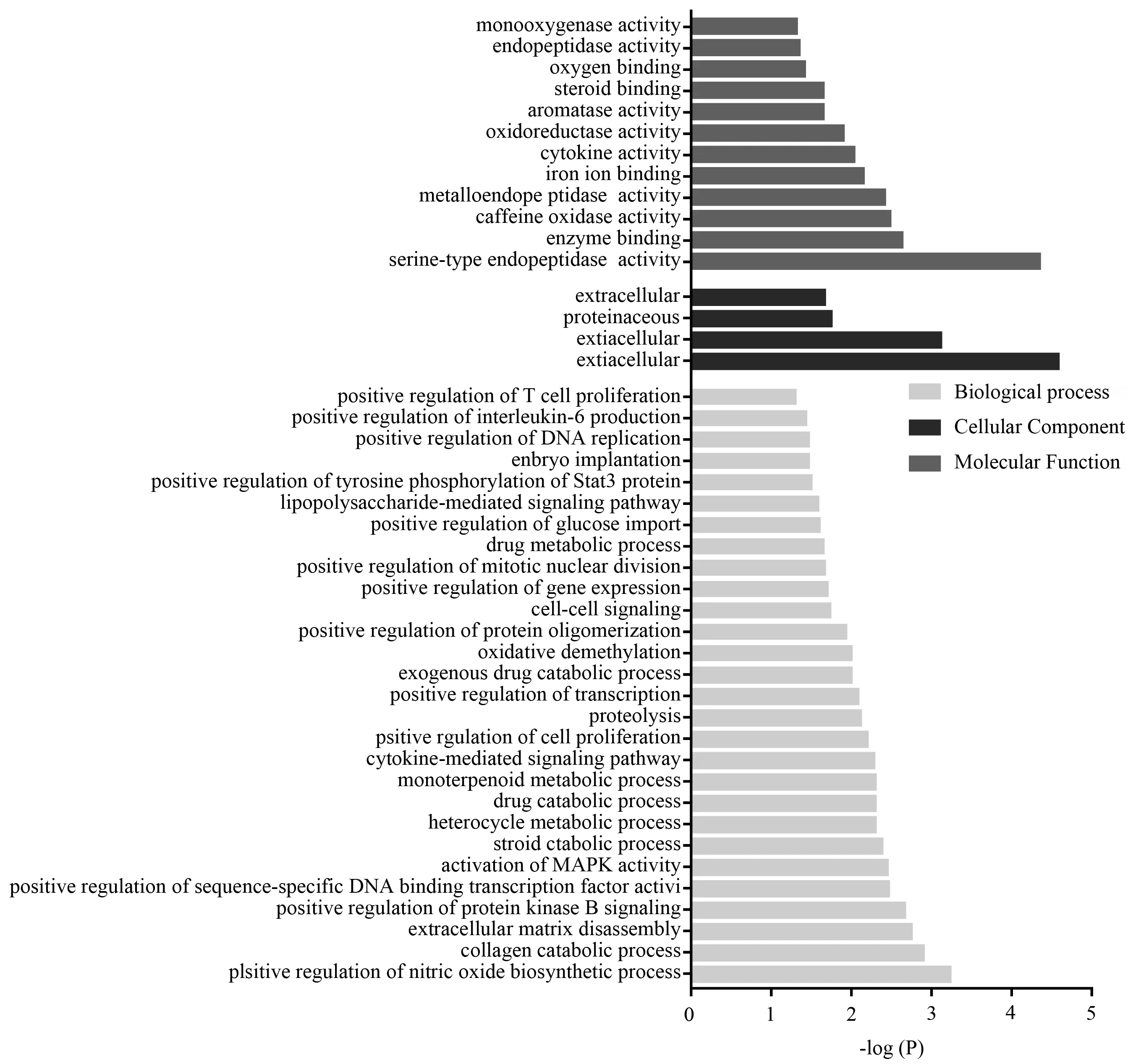
图5 核心药团对LF作用靶点的GO分析结果Fig.5 Results of GO analysis of core drug group on LF target
进行KEGG分析可得到11条信号通路,其中包含有TNF信号通路、NOD样受体信号通路、Toll样受体信号通路及FoxO信号通路,KEGG分析结果见表6;利用“富集因子=目标基因集中属于该通路的基因数量/背景基因集中该通路所有基因的数量”计算出富集因子,并绘制气泡图,见图6。

表6 核心药团对LF作用靶点的KEGG分析结果Tab.6 Results of KEGG analysis of Core drug group on LF target
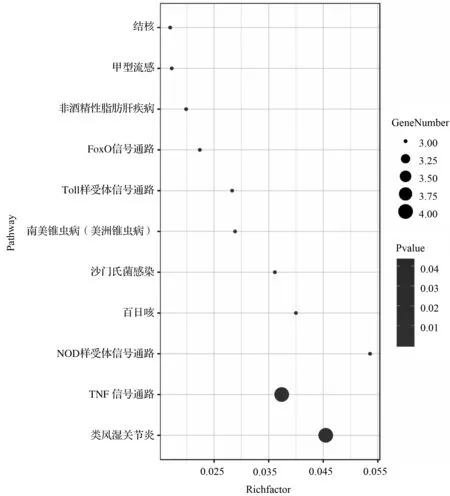
图6 核心药团对LF作用靶点KEGG分析的气泡图
Fig.6 Bubble map of KEGG analysis of targets of core drug group on liver failure
4 讨论
数据挖掘方面,处方用药统计后显示,治疗肝衰竭(LF)的高频用药以清热药和利湿药为主,辅以活血化瘀药、补气药及泻下药。清热药以“清泄里热”为主功效,其中不少清热药功效广泛,同时有泻火、凉血和解毒的作用。利湿药以“渗泄水湿、通利水道”为主,根据各类药物功效可分为利湿退黄、通淋和利水消肿三类。提示对LF的临床用药,可注重选用清热药及利湿药,如清热泻火,兼凉血、解毒及清利湿热的栀子;以利湿为主,兼可退黄、清热解毒的茵陈、虎杖;具有利水渗湿,兼有健脾作用的茯苓。随证辅以郁金活血凉血利胆退黄,白术补气健脾燥湿利尿,大黄清泄湿热泻火解毒等活血化瘀、补虚、泻下等药物。这也符合清热利湿为主,兼化瘀解毒的中医治疗法则。
高频中药关联分析发现,关联强度的最高的高频中药组合有10个,置信度均为100 %,提示10个LF高频中药组合预测准确程度可信。其中支持度最高的LF核心药团是茵陈→白术→大黄,余为茵陈→金钱草、茵陈→白花蛇舌草、茵陈→金钱草→大黄、茵陈→郁金→丹参→大黄、茵陈→白花蛇舌草→赤芍、茵陈→柴胡→大黄、茵陈→虎杖→郁金、大黄→郁金→栀子→赤芍、茵陈→郁金→丹参→大黄→赤芍。由此得出,对于LF的临床用药需注重利湿药—补虚药—泻下药及利湿药—清热药—活血化瘀药—泻下药的配伍应用,提示此配伍可作为LF临床研究的未来研究方向。
高频中药因子分析得出8个公因子,F1栀子、大黄、金钱草、黄芩(清热—泻下—利湿—清热);F2黄芪、柴胡、赤芍、丹参(补虚—解表—活血化瘀—活血化瘀);F3虎杖、郁金(利湿—活血化瘀);F4石菖蒲、白花蛇舌草(开窍—清热);F5茯苓、泽泻(利湿—利湿);F6牡丹皮、生地黄(清热—清热);F7附子、茵陈、白术(温阳—利湿—利湿);F8甘草(补虚)。可见清热药及利湿药在中医药治疗LF中发挥着重要作用,且注重清热药、利湿药与活血化瘀药、补虚药的搭配应用。
网络药理方面,筛选LF核心药团(茵陈→白术→大黄)后发现部分化合物对肝衰竭具有重要的作用。如芦荟大黄素(aloe-emodin)、毛细血管素(capillarisin)、异鼠李素(isorhamnetin)等。经研究验证,芦荟大黄素具有抗HBV病毒作用,药效与拉米夫定相当,而且芦荟大黄素具有激活CYP3A4的特性,可增强抗HBV的疗效[6]。实验研究表明,毛细血管通过至少两种不同的途径对大鼠原代肝细胞中t-BHP诱导的细胞毒性和遗传毒性具有抑制作用[7]。亦有研究[8]发现毛细血管素在保护肝功能方面具有强保护作用。实验结果[9]显示毛细血管素可抑制脂多糖(LPS)所诱导产生的TNF-α、IL-6、IL-1β、NO及PGE2,且能抑制LPS诱导的TLR4表达及NF-κB和MAPKs的活化,即毛细血管素可抑制LPS诱导的炎症。经实验[10]发现异鼠李素可抑制肝星状细胞(HSC)活化,减少细胞外基质(ECM)的形成和自噬,能显著抑制肝纤维化。同时研究表明异鼠李素在肝纤维化和肝纤维化模型中均具有抗纤维化活性[11]。LF核心药团的化合物靶点网络中,起重要作用的靶点有PTGS2、HSP90AA1、DPP4、PTGS1等。这些靶点与抗肝纤维化[12、13]、保护肝功能[13]等过程有关,且部分存在着协同作用。
分析LF核心药团靶点网络时发现核心药团中存在多个与保护肝功能、抗肝炎病毒、抗肝纤维化相关的重要靶点。为此对LF核心药团作用于LF的作用靶点进行进一步的GO功能及KEGG通路分析。GO功能分析中发现LF核心药团对一氧化氮生物合成过程的正调控、胶原分解代谢过程、细胞外基质拆卸的作用。在KEGG道路分析中发现TNF信号通路、NOD样受体信号通路、Toll样受体信号通路及FoxO信号通路等信号通路所含基因大致相似,如IL6、MAPK14、IL1B等,各信号通路通过研究表明与LF相关。实验结果显示BAPTA-AM脂质体(BAL)在急性肝衰竭(ALF)小鼠模型中可逆转形态变化并调节TNF-α和NF-κB表达,降低巨噬细胞中LPS刺激的炎症反应,从而有效治疗肝衰竭[14]。研究发现[15]负调节NOD样受体3(NLRP3)表达的负调节因子microRNA-223在慢性肝损伤及其他肝脏疾病中起重要作用,且发现miR-223的类似物miR-2233p可下调急性肝炎的炎症因子IL6和IL12以及趋化因子Ccl2,Ccl3,Cxcl1和Cxcl2的转录表达,在慢性肝损伤中可显着缓解纤维化发展和肝星状细胞(HSC)活化,提示负调控NOD样受体信号通路可用于治疗急慢性肝损伤性疾病。GTE可通过降低内毒素-TLR4(Toll样受体4)-NFκB(核因子kappa-B)的炎症来缓解非酒精性脂肪性肝炎(NASH)[16]。
本研究运用现代技术挖掘中医药治疗LF的临床数据,从而得出治疗LF的处方用药规律及LF核心药团。进一步运用网络药理学从微观层面初探LF核心药团治疗LF的相关潜在靶点、复杂生物学过程和通路机制,以期为后续涵括LF核心药团新处方的有效成分及作用机制提供前期理论基础,更好地论述LF中药成方应用的科学性,给临床用药提供理论支持。

